COSA PUO’ NASCONDERE UN ARRESTO CARDIACO?
F. Mautone, D. Ruggeri, G. Casavecchia, M. Gravina, N.D. Brunetti
Università degli Studi di Foggia
S.C. Cardiologia Universitaria-UTIC, Policlinico Riuniti Foggia
ABSTRACT. La Miocardite acuta da M. Tuberculosis è una forma rara di miocardite. L’espressione clinica varia da forme paucisintomatiche subcliniche ad aritmie potenzialmente letali, shock cardiogeno e morte improvvisa. La clinica, gli esami ematici e l’ecocolordoppler cardiaco transtoracico pongono il sospetto ma solo attraverso l’approccio multimodale e multiparametrico della RM cardiaca è possibile eseguire una corretta diagnosi, terapia e valutazione di efficacia del trattamento [1,2,3].
CASO CLINICO. Un uomo di 25 anni, di etnia non caucasica, senza precedenti cardiologici di rilievo, giunge al PS del nostro nosocomio trasportato dal 118 per un arresto cardiaco extraospedaliero. L’elettrocardiogramma mostra una tachicardia ventricolare sostenuta talora con aspetto BBD (220 bpm), talora BBS (170 bpm), trattata con amiodarone e lidocaina e.v. Il paziente viene ricoverato presso l’Unità di Terapia Intensiva Cardiologica. In anamnesi vengono riferiti episodi di febbricola nell’ultimo mese.
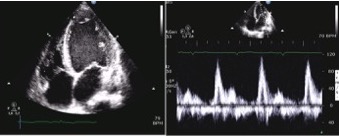
Figura 1. Ecocardiogramma transtoracico all’ingresso: ipertrofia lieve-moderata, FE del ventricolo sinistro del 15%, presenza di effetto smoke. E/A >>1, pattern diastolico di tipo restrittivo.
L’ecocardiogramma mostra una ipertrofia lieve-moderata, con una frazione d’eiezione (FE) del 15% e presenza di effetto smoke; all’indagine con metodica Doppler è evidente una insufficienza mitralica di grado moderato e un pattern diastolico di tipo restrittivo [Figura 1].
Il quadro evolve rapidamente in un blocco atrio-ventricolare completo (frequenza cardiaca 20 bpm), non responsivo ad isoprenalina e atropina, con successivo posizionamento di pacemaker temporaneo, intubazione orotracheale, trasferimento presso la S.C. di Rianimazione ed avvio di trattamento con dobutamina, dopamina e remifentanil e.v.
Allo stabilizzarsi del quadro clinico il paziente viene sottoposto ad esame coronarografico che non evidenzia coronaropatia significativa. Agli esami ematici si riscontrano valori di emoglobina pari a 13,4 g/dl; globuli bianchi 14.300 /dl; GOT 94 u/l; GPT 44 u/l; gamma GT 320 u/l; creatinfosfochinasi 3512 u/l; procalcitonina 3,98 ng/ml; gli esami tossicologici e il pannello virale risultano negativi, il tampone nasale mostra assenza di colonizzazione da S. aureus meticillino resistente; il lavaggio bronchiolo-alveolare mostra assenza di flora batterica microbica, mentre il test T-SPOT-TB mostra presenza di cellule T reattive a M. tuberculosis.
La TC del torace mostra la presenza di noduli polmonari (max 9,6 mm) a livello del lobo Inferiore destro, lobo superiore sinistro e lobo Inferiore sinistro.
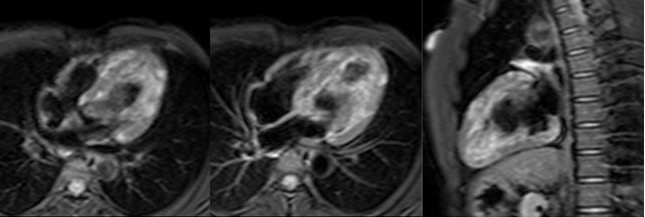
pareti del ventricolo sinistro.
Viene quindi eseguita una Risonanza Magnetica Cardiaca (RMC) che mostra nelle sequenze STIR-T2 aumento di segnale prevalentemente transmurale con aspetto a chiazze (‘patchy’) di tutte le pareti del ventricolo sinistro [Figura 2].
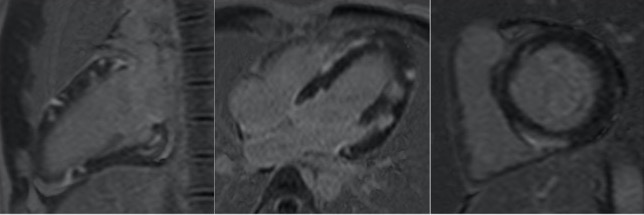
Figura 3. RM cuore (sequenze PSIR): iperintensità di segnale prevalentemente meso-subepicardico
di tutte le pareti del ventricolo sinistro con aspetto a macchia di leopardo.
Le sequenze PSIR per lo studio del Late Gadolinium Enhancement (LGE) mostrano iperintensità di segnale prevalentemente meso-subepicardico di tutte le pareti del ventricolo sinistro (22 gr pari al 13% della massa cardiaca) [Figura 3].
Il quadro di risonanza, associato ai dati clinici-strumentali, è compatibile con Miocardite acuta: viene pertanto impostata una terapia antibiotica con Rifampicina, Isoniazide, Pirazinamide ed Etambutolo, e dal punto di vista cardiologico con Amiodarone e Metoprololo. Tenendo conto delle raccomandazioni ESC per la prevenzione della morte cardiaca improvvisa e per il trattamento delle aritmie ventricolari nei pazienti con miocardite ed episodio di TV emodinamicamente non tollerata si decide di impiantare un AICD in prevenzione secondaria [5].
Il paziente, avendo risposto efficacemente alla terapia antibiotica, con remissione completa della sintomatologia ed assenza di aritmie al monitoraggio telemetrico, viene dimesso in terapia con Amiodarone, Metoprololo, Rifampicina, Isoniazide, Pirazinamide ed Etambutolo. Al controllo eseguito dopo sei mesi di terapia, il paziente riferisce buone condizioni di salute; alla TC Torace di controllo non più presenti le formazioni nodulari precedentemente descritte; la RMC documenta nelle sequenze STIR-T2 assenza di edema, tuttavia permane ancora una lieve zona di LGE meso-subepicardico a livello dei segmenti medio-apicali della parete inferiore ed infero-laterale.
DISCUSSIONE. Il coinvolgimento del miocardio da parte del Mycobacterium tuberculosis è raro. L’interessamento tubercolare del miocardio avviene per disseminazione ematogena, diffusione linfatica o per passaggio diretto dalle strutture contigue e può causare una patologia nodulare, miliare o malattie infiltrative diffuse. In alcuni casi, l’infezione può causare aritmie, tra cui fibrillazione atriale e tachicardia ventricolare, blocco atrioventricolare completo, insufficienza cardiaca, aneurismi del ventricolo sinistro e morte improvvisa [4].
CONCLUSIONI. La Miocardite acuta da M. Tuberculosis è una forma rara di infiammazione miocardica. Esistono tre varianti cliniche: una forma simil-infartuale, che si manifesta con angina e simula un infarto miocardico acuto; una forma cardiomiopatica che esordisce con dispnea ed insufficienza cardiaca ed una forma simil-aritmica che si presenta con aritmie cardiache iper o ipocinetiche. La RM cardiaca ci permette di caratterizzare il tessuto miocardico, di valutare l’estensione delle lesioni e ci da informazioni dal punto di vista prognostico e sull’efficacia del trattamento specifico.
BIBILIOGRAFIA
[1] Francone M, Carbone I, Agati L, et al: Utility of T2-weighted short-tau inversion recovery (STIR) sequences in cardiac MRI: An overviewof clinical applications in ischaemic and non-ischaemic heart disease. Radiol Med 116:32, 2011.
[2] Lurz P, Eitel I, Adam J, et al: Diagnostic performance of CMR imaging compared with EMB in patients with suspected myocarditis. JACC Cardiovasc Imaging 5:513, 2012. [3] Friedrich MG, Sechtem U, Schulz-Menger J, et al: Cardiovascular magnetic resonance in myocarditis: A JACC white paper. J Am Coll Cardiol 53:1475, 2009. [4] Liu A, Hu Y, Coates A: Sudden cardiac death and tuberculosis – how much do we know? Tuberculosis 92:307, 2012. [5] Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al.: ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022 Oct 21;43(40):3997-4126.Metadone: conseguenze non convenzionali della dipendenza da oppioidi
E. Roagna1; V. Dusi1; F. Angelini1; L. Nocera1; G. Giannino1; Prof. G.M. De Ferrari1
1Division of Cardiology, Cardiovascular and Thoracic Department, “Città della Salute e della Scienza” Hospital, Turin, Italy
INTRODUZIONE
Il metadone è un farmaco, utilizzato per ridurre l’assuefazione nella terapia sostitutiva della dipendenza da stupefacenti, noto, in cardiologia, per il potenziale prolungamento dell’intervallo QT, con conseguente incremento del rischio di aritmie ventricolari maligne, tipo torsione di punta (TdP), specie in presenza di altri fattori favorenti, congeniti o acquisiti. La gestione dei pazienti con prolungamento del QTc e aritmie in corso di metadone è complessa, vista anche l’impossibilità, nella maggior parte dei casi, di sospendere il farmaco.
CASO CLINICO
Un uomo di 39 anni, con storia di passato abuso di cocaina ed eroina, da 13 anni in terapia cronica con metadone, si presenta in pronto soccorso per cardiopalmo e sincopi recidivanti durante la notte, dopo recente aumento della dose di metadone da 50 a 130 mg/die.
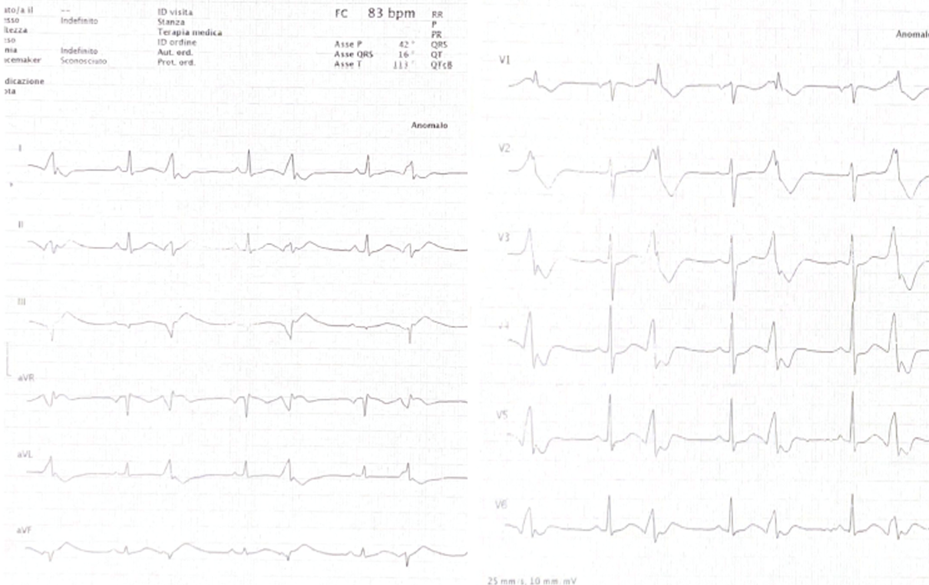
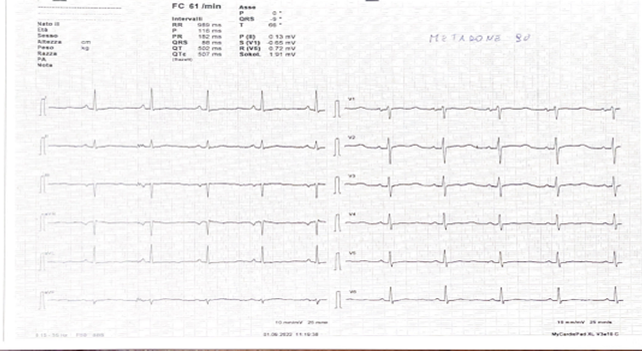
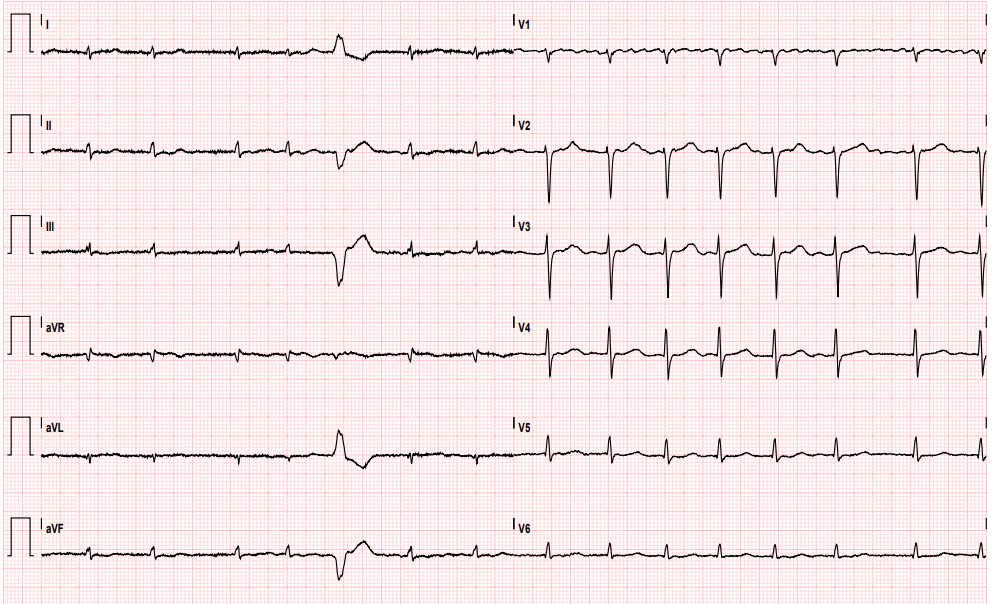
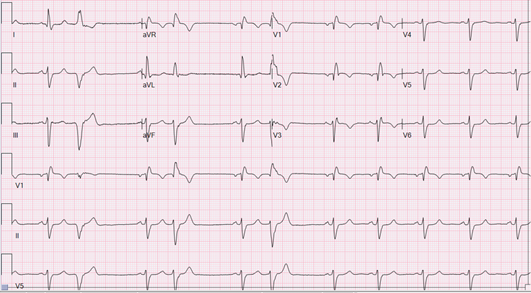
All’ECG di ingresso extrasistolia ventricolare monomorfa bigemina a verosimile origine epicardica dalla parete infero-laterale basale (morfologia a BBDx, concordanza positiva nelle precordiali, DIII e aVF negative); QTc non correttamente quantificabile per bigeminismo, ma desumibile marcato prolungamento (Fig.1).
Durante l’osservazione in DEA plurimi episodi di TdP (Fig.2) con necessità di defibrillazione esterna; trattato in acuto con supplementazione di potassio (K+ 3.1 mEq/L), boli di solfato di magnesio (MgSO4) e lidocaina ev. Viene quindi disposto ricovero in Cardiologia dove si avvia terapia con Nadololo, titolato sino 1 mg/kg/die, e progressivamente ridotta la posologia del metadone fino a 50 mg/die.
Eseguiti Holter ECG delle 24 ore a 12 derivazioni e test ergometrico (in corso di metadone 90 mg/die) con evidenza di onde T notched e molto appiattite (con seconda componente dell’onda T a tratti ai limiti elettrocardiografici della definizione di onda U, a tratti di maggior ampiezza della prima) con QTc marcatamente prolungato (> 550 ms) e con scarso adeguamento alle variazioni cronotrope (Fig. 3).
Intra-ricovero eseguiva:
- Ecocardiogramma FE del Vsx 50% con GLS -13% (più marcatamente ridotto a livello dei segmenti inferiore e infero-laterale); finestra elettromeccanica (EMW) marcatamente negativa e importante dispersione meccanica .
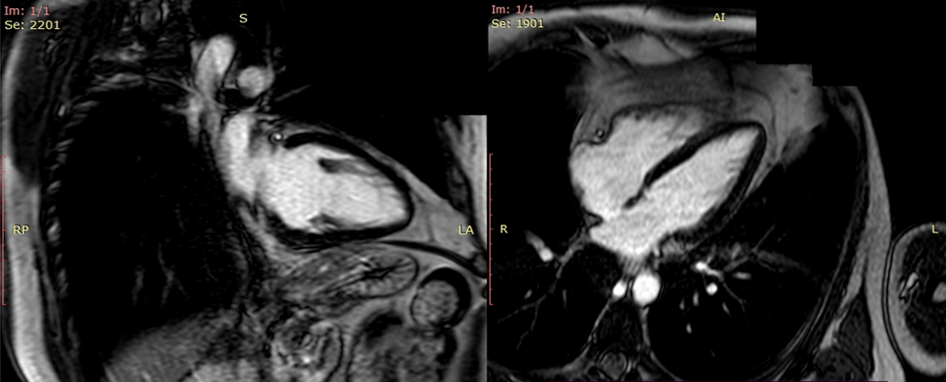
- RM cardiaca (Fig.4) che mostra area di late gadolinium enhancement (LGE) non ischemico omosede alle alterazioni della cinesi (parete inferiore e infero-laterale basale).
- Test alla mexiletina (6 mg/kg) con successiva, contemporanea registrazione di elettrocardiogramma ed ecocardiogramma ripetuti nel corso delle 4 ore successive, senza significativa riduzione dell’intervallo QT, dell’EMW o della dispersione meccanica, per cui il farmaco non è stato avviato in cronico.
Dopo discussione collegiale, vista la necessità di prosecuzione della terapia con metadone, la presenza di sottostante cardiomiopatia all’esordio e considerando la decisa preferenza del paziente, è stato effettuato impianto di defibrillatore cardiaco endocavitario (ICD) bicamerale. A completamento diagnostico è stata infine condotta indagine genetica ad ampio spettro per canalopatie e cardiomiopatie (con tecnica NGS e MLPA) risultata negativa. Al follow-up di un anno (in corso di metadone 40 mg/die) persistenza di QTc prolungato (560 ms), non recidive aritmiche, NYHA I.
CONCLUSIONI
Il nostro caso descrive l’effetto pro-aritmico del metadone a medio-alte dosi, associato ad altri fattori predisponenti (ipokaliemia e cardiomiopatia all’esordio), in un quadro di marcato prolungamento dell’intervallo QT con importante corrispettivo di dispersione elettro-meccanica all’ecocardiografia. Il quadro di bigeminismo ventricolare fisso alla presentazione, del tutto atipico in altre forme di QT lungo acquisito o congenito, è descritto in associazione al metadone e all’effetto del farmaco di inibizione di IK1 oltre che di IKr; nel nostro paziente vi è inoltre una correlazione come sede di origine anche alla sede della fibrosi della cardiomiopatia all’esordio.
BIBLIOGRAFIA
- Funasako M, Aiba T, Ishibashi K, Nakajima I, Miyamoto K, Inoue Y, Okamura H, Noda T, Kamakura S, Anzai T, Noguchi T, Yasuda S, Miyamoto Y, Fukushima Kusano K, Ogawa H, Shimizu W. Pronounced Shortening of QT Interval With Mexiletine Infusion Test in Patients With Type 3 Congenital Long QT Syndrome. Circ J. 2016;80(2):340-5. doi: 10.1253/circj.CJ-15-0984. Epub 2015 Dec 3. PMID: 26632536.
- Ehret GB, Desmeules JA, Broers B. Methadone-associated long QT syndrome: improving pharmacotherapy for dependence on illegal opioids and lessons learned for pharmacology. Expert Opin Drug Saf. 2007 May;6(3):289-303. doi: 10.1517/14740338.6.3.289. PMID: 17480178.
- Titus-Lay EN, Jaynes HA, Tomaselli Muensterman E, Walroth TA, Ott CA, Desta Z, Williams G, Moe PR, Wilbrandt M, Tisdale JE. Methadone-associated QT interval prolongation in patients undergoing maintenance therapy in an urban opioid treatment program. Pharmacotherapy. 2021 Mar;41(3):238-246. doi: 10.1002/phar.2498. Epub 2021 Feb 2. PMID: 33345336.
- Fonseca F, Marti-Almor J, Pastor A, Cladellas M, Farré M, de la Torre R, Torrens M. Prevalence of long QTc interval in methadone maintenance patients. Drug Alcohol Depend. 2009 Jan 1;99(1-3):327-32. doi: 10.1016/j.drugalcdep.2008.06.018. Epub 2008 Sep 5. PMID: 18774239.
- Peles E, Bodner G, Kreek MJ, Rados V, Adelson M. Corrected-QT intervals as related to methadone dose and serum level in methadone maintenance treatment (MMT) patients: a cross-sectional study. Addiction. 2007 Feb;102(2):289-300. doi: 10.1111/j.1360-0443.2006.01668.x. PMID: 17222284.
Primo caso di ablazione di via accessoria epicardica con il nuovo catetere TactiflexTM “high-power-short-duration” in un giovane sportivo
Yari Valeri, MD1,2; Adelina Selimi, MD1,2; Michela Casella, MD, PhD1,3; Antonio Dello Russo, MD, PhD1,2
1 Cardiology and Arrhythmology Clinic, University Hospital “Ospedali Riuniti”, Ancona, Italy;
2 Department of Biomedical Sciences and Public Health, Marche Polytechnic University, Ancona, Italy;
3 Department of Clinical, Special and Dental Sciences, Marche Polytechnic University, Ancona, Italy.
ABSTRACT
L’ablazione trans-catetere delle vie accessorie endo-epicardiche è una procedura “challenging” e insidiosa, che può essere difficoltosa a causa della localizzazione non sempre facilmente accessibile della via accessoria. Presentiamo il caso di un giovane sportivo con via accessoria occulta dove un corretto mappaggio e studio elettrofisiologico per una precisa localizzazione della via accessoria è fondamentale al fine di escludere componenti epicardiche della via per una buona riuscita dell’ablazione. Viene inoltre dimostrata l’efficacia e soprattutto la sicurezza del nuovo catetere TactiFlexTM anche nell’effettuare erogazioni di radiofrequenze all’interno del seno coronarico.
CASO CLINICO
Un giovane ragazzo di 15 anni, sportivo agonista, accedeva in pronto soccorso (PS) per cardiopalmo e presincope durante attività sportiva. Era risultato idoneo a tutte le visite sportive per l’attività fisica agonistica finora effettuate. Non aveva familiarità per morte cardiaca improvvisa o aritmie.
Un anno prima, per multipli episodi di cardiopalmo associati a presincope, aveva effettuato una visita cardiologica in cui tuttavia non venivano riscontrate anomalie all’ECG a 12 derivazioni e all’Holter ECG dei 7 giorni, o reperti patologici strutturali all’ecocardiogramma.
In PS il paziente era vigile e collaborante, agitato, la frequenza cardiaca era di 180 battiti/min, la pressione arteriosa era 110/70 mmHg. Non veniva rilevato nessun reperto patologico degno di nota all’esame obiettivo e agli esami ematochimici.
L’ECG a 12 derivazioni mostrava una tachicardia (180 battiti/min) sopra-ventricolare regolare (SVT) e sostenuta, a complessi QRS stretti con lieve ritardo di conduzione destra (80 ms), con una piccola incisura sulla porzione discendente dell’onda T a circa 110 ms dal QRS; tali reperti potevano essere coerenti con una tachicardia da rientro atrio-ventricolare ortodromica (AVRT), con una tachicardia atriale (AT) o con una tachicardia da rientro nodale atipica (AVNRT).
Durante monitoraggio ECG continuo non fu possibile interrompere la tachicardia o osservare un allungamento del ciclo con le manovre vagali. Durante somministrazione di adenosina si è invece assistito all’interruzione dell’aritmia, terminata con un’onda P ad asse superiore a circa 110 ms dal QRS; questo comportamento della tachicardia suggeriva una possibile AVNRT atipica o AVRT, anche se non poteva essere esclusa con assoluta certezza una TA.
Fu successivamente sottoposto ad uno studio elettrofisiologico (SEF), durante il quale venivano evidenziati normali parametri di conduzione atrioventricolare. Durante stimolazione ventricolare incrementale veniva facilmente indotta una SVT con rapporto A-V 1:1, suggestiva di AVRT da via accessoria sinistra (ciclo regolare, QRS stretto, intervallo AV fuso a livello del seno coronarico distale). Durante conduzione anterograda non era mai evidente alcuna via accessoria manifesta (trattasi dunque di via accessoria occulta).
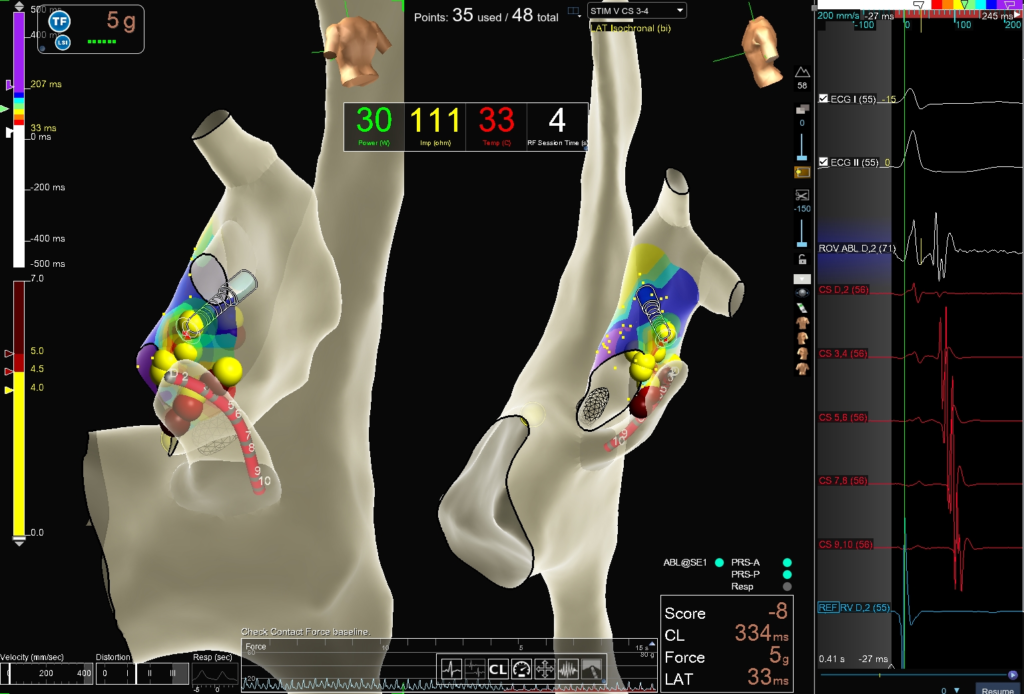
Mappaggio elettro-anatomico dell’atrio destro e della porzione laterale dell’atrio sinistro. Mappa di attivazione durante stimolazione dall’apice del ventricolo destro con ricostruzione in scala colorimetrica del segnale atriale più anticipato sul catetere ablatore rispetto al segnale atriale più anticipato a livello del seno coronarico distale (CS1-2) (bianco: segnale più anticipato, corrispondente al potenziale di Kent; rosso-azzurro-viola segnale progressivamente sempre meno anticipato, lontano dalla via accessoria). Le erogazioni, in corrispondenza dell’anello mitralico antero-laterale, vengono contraddistinte con TAG colorati in relazione all’LSI raggiunto (giallo 0-4.5; rosso >4.5). Nella mappa vengono illustrati il catetere in seno coronarico, in rosso, e il catetere da mappaggio-ablazione TactiCath a livello dell’anello mitralico, in corrispondenza del segnale più anticipato, potenziale di Kent.
Sulla destra, il segnale registrato dal catetere ablatore, con un potenziale atriale anticipato rispetto al seno coronarico distale, con AV fuso e con componente intermedia suggestiva di potenziale di Kent.
Mediante puntura trans-settale si raggiungeva la camera atriale sinistra e con il supporto del nuovo sistema di mappaggio EnsiteX V2 ed il catetere ablatore TactiCath (TactiCathTM Ablation Catheter, Sensor EnabledTM, Abbot) è stata mappata la via accessoria sia durante stimolazione ventricolare sia durante tachicardia, ottenendo la massima fusione del segnale AV, con potenziale di Kent ben rappresentato, a livello dell’anello mitralico antero-laterale (fig. 1). Furono erogati diversi impulsi di radiofrequenza (RF) a livello del versante endocardico (45-50 W, target LSI 4-4.5) sia sul versante atriale che ventricolare, fino all’interruzione dell’aritmia e della conduzione su via accessoria. Durante la stimolazione programmata ed incrementale, sia atriale che ventricolare, non risultava più inducibile alcuna aritmia.
Tuttavia, il giorno successivo, veniva registrata al monitoraggio telemetrico una SVT (190 battiti/min), a ciclo regolare e QRS stretto, sintomatica per cardiopalmo ed interrotta mediante somministrazione di adenosina. Nonostante l’introduzione della terapia medica (Ca++ antagonisti prima, beta-bloccanti dopo) gli episodi continuavano ad essere frequenti nel periodo intra-ricovero. Si optò dunque per un secondo SEF.
Durante la stimolazione ventricolare incrementale è stata confermata la persistenza della via accessoria e la facile indicibilità della AVRT. La via accessoria fu dunque nuovamente mappata con il nuovo catetere da mappaggio-ablazione TactiFlex(TactiFlexTM Ablation Catheter, Sensor EnabledTM, Abbot) sia durante stimolazione ventricolare sia durante tachicardia, ottenendo la massima fusione del segnale AV, con potenziale di Kent ben rappresentato, sempre a livello dell’anello mitralico antero-laterale; tuttavia tale segnale, questa seconda volta, veniva registrato in due regioni leggermente diverse, come da possibile coinvolgimento di una componente epicardica o di vie di conduzione accessorie multiple. Sono stati erogati diversi impulsi di RF (50 W per 10 secondi – 40 W per 20 secondi) senza ottenere l’interruzione della conduzione sulla via di conduzione accessoria.
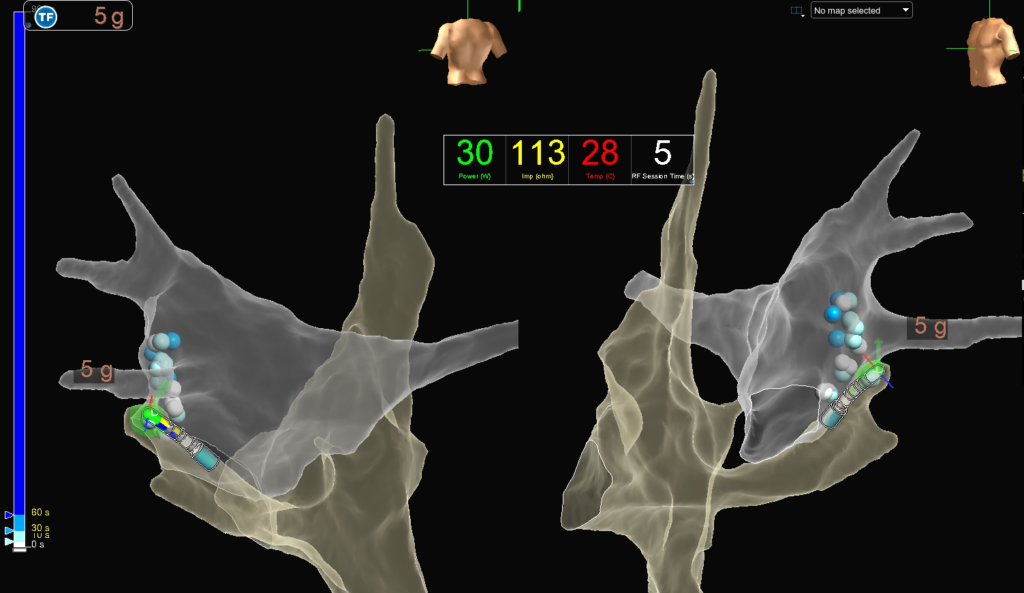
Mappaggio elettroanatomico dell’atrio destro e sinistro (PA a sinistra, LAO a destra). Vengono evidenziate le erogazioni effettuate mediante il nuovo catetere TactiFlex, a livello della porzione antero-laterale dell’atrio sinistro e della porzione speculare a livello epicardico all’interno del seno coronarico.
Pertanto, sono stati effettuati ulteriori impulsi (30-35 W per 20 secondi) nella regione distale del seno coronarico (regioni epicardiche), ottenendo l’interruzione della conduzione sulla via accessoria (fig.2). Ad un anno dalla procedura, non si sono più verificati episodi aritmici di rilievo al follow-up.
DISCUSSIONE
Le vie di conduzione accessoria sono costituite da tralci di cellule miocardiche che bypassano il sistema di conduzione fisiologico e mettono in comunicazione diretta il miocardio delle camere atriali con quello delle camere ventricolari (1). Sebbene molte delle vie accessorie conducano sia in senso anterogrado che retrogrado, alcune permettono la propagazione degli impulsi solo in una direzione (di solito retrogrado, vie accessorie occulte). Le vie accessorie possono essere il substrato sul quale si instaurano aritmie da rientro atrio-ventricolari ortodromiche se l’impulso è condotto dagli atri ai ventricoli mediante le normali vie fisiologiche, antidromiche se è condotto mediante la via accessoria in senso anterogrado e mediante le vie di conduzioni fisiologiche in senso retrogrado.
L’ablazione trans-catetere delle vie accessorie è raccomandata nei pazienti con AVRT sintomatica e recidivante (2). Per i pazienti con via occulta che praticano attività sportiva, deve essere effettuato uno studio di stratificazione del rischio della via; qualora la via fosse ad elevato rischio o si induce la TRAV è indicata l’ablazione della via stessa (2,3).
Tra le principali motivazioni che portano al fallimento dell’ablazione trans-catetere e alla ricorrenza di AVRT vi sono (1) un non accurato mappaggio della via accessoria, (2) la presenza di una via accessoria profonda/con componente epicardica, (3) la formazione di lesioni a radiofrequenza inadeguate, per potenza o per scarso contatto elettrocatetere-tessuto.
L’ablazione ‘’redo’’ di via accessoria, in modo particolare nei bambini, resta al giorno d’oggi una sfida difficile; il mappaggio del seno coronarico dovrebbe essere sempre eseguito quando l’ablazione endocardica non risulta efficace.
Inoltre, l’introduzione dei nuovi cateteri ablatori “high-power-short-duration” potrebbe essere un valido aiuto per trattare le vie accessorie profonde. Il TactiFlex (TactiFlexTM Ablation Catheter, Sensor EnabledTM, Abbot) è un nuovo catetere ablatore che possiede la capacità di erogare lesioni focali con tecnica “high-power-short-duration” e sembra essere efficace e soprattutto sicuro anche per il trattamento di vie accessori con componente epicardica, che necessitano di erogazioni all’interno del seno coronarico.
CONCLUSIONE
L’ablazione trans-catetere delle vie accessorie endo-epicardiche è una procedura “challenging” e insidiosa, che può essere difficoltosa a causa della localizzazione non sempre facilmente accessibile della via accessoria. Questo caso evidenzia l’importanza di un corretto mappaggio e studio elettrofisiologico al fine di evidenziare con quanta più precisione possibile la localizzazione della via accessoria. Viene inoltre dimostrata l’efficacia e soprattutto la sicurezza del nuovo catetere TactiFlexTM anche nell’effettuare erogazioni di RF all’interno del seno coronarico.
BIBLIOGRAFIA
- Kulig J, Koplan BA. Cardiology patient page. Wolff-Parkinson-White syndrome and accessory pathways. Circulation. 2010 Oct 12;122(15):e480-3. doi: 10.1161/CIRCULATIONAHA.109.929372. PMID: 20937983.
- Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, Calkins H, Corrado D, Deftereos SG, Diller GP, Gomez-Doblas JJ, Gorenek B, Grace A, Ho SY, Kaski JC, Kuck KH, Lambiase PD, Sacher F, Sarquella-Brugada G, Suwalski P, Zaza A; ESC Scientific Document Group. 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020 Feb 1;41(5):655-720. doi: 10.1093/eurheartj/ehz467. Erratum in: Eur Heart J. 2020 Nov 21;41(44):4258. PMID: 31504425.
- Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, Collet JP, Corrado D, Drezner JA, Halle M, Hansen D, Heidbuchel H, Myers J, Niebauer J, Papadakis M, Piepoli MF, Prescott E, Roos-Hesselink JW, Graham Stuart A, Taylor RS, Thompson PD, Tiberi M, Vanhees L, Wilhelm M; ESC Scientific Document Group. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021 Jan 1;42(1):17-96. doi: 10.1093/eurheartj/ehaa605. Erratum in: Eur Heart J. 2021 Feb 1;42(5):548-549. PMID: 32860412.
“…L’essenziale è invisibile agli occhi”, o quasi.
Andrea Nevi1; Cristina Demattè2; Giulia Vinco2; Lorenzo Niro1; Cristiana Giovanelli2
1Università di Verona, Verona
2Ospedale Santa Maria del Carmine, Rovereto
ABSTRACT
Un uomo di 47 anni affetto da fibrillazione atriale persistente, già in lista per ablazione del substrato, veniva ricoverato per una cardioversione elettrica.
L’ECG mostrava QRS a basso voltaggio. Un precedente ecocardiogramma documentava una lieve ipertrofia del setto interventricolare. Tali riscontri risultavano anomali in un paziente giovane, senza condizioni che giustificassero i reperti.
Ripetevamo un ecocardiogramma che mostrava un diffuso ispessimento parietale del ventricolo sinistro. La Risonanza Magnetica cardiaca mostrava late-enhancement epi-mesocardico.
Collateralmente, era visibile una massa a livello dello sterno, risultata essere, ad una successiva TC total-body, una lesione litico-espansiva del manubrio sternale. Una biopsia osteomidollare confermava la diagnosi.
CASO CLINICO
Un uomo di 47 anni affetto da fibrillazione atriale persistente e già in lista per un intervento di ablazione transcatetere del substrato, veniva ricoverato a Luglio 2023 nel nostro reparto per una cardioversione elettrica programmata.
L’aritmia era stata riscontrata incidentalmente durante una visita dal Medico del lavoro a Maggio 2022. Il paziente era già stato sottoposto ad una cardioversione elettrica ad Agosto 2022 con successiva recidiva.
All’epoca gli esami di primo livello non erano risultati francamente patologici se non per una lieve ipertrofia del setto interventricolare all’ecocardiogramma.
Il paziente non presentava fattori di rischio cardiovascolare ed in anamnesi riferiva soltanto una lunga storia di tendinopatia della cuffia dei rotatori e un pregresso intervento per tunnel carpale destro.
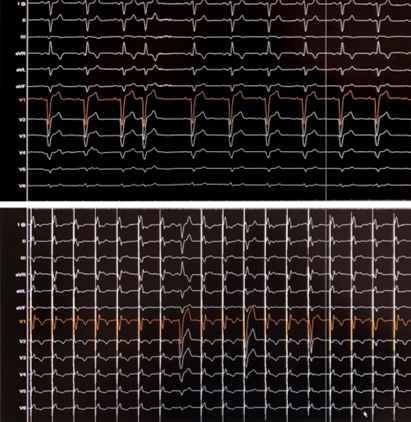
Il suo unico disturbo al momento della nostra valutazione era una lieve riduzione della tolleranza allo sforzo fisico. L’esame obiettivo non mostrava segni di scompenso cardiaco; tuttavia, era evidente una massa dura al tatto, ricoperta da cute sana, a livello del manubrio dello sterno, che il paziente riferiva avere da anni e che era comparsa in seguito ad un trauma sportivo. All’ECG (Fig.1) si riscontravano QRS a basso voltaggio, oltre alla nota fibrillazione atriale.
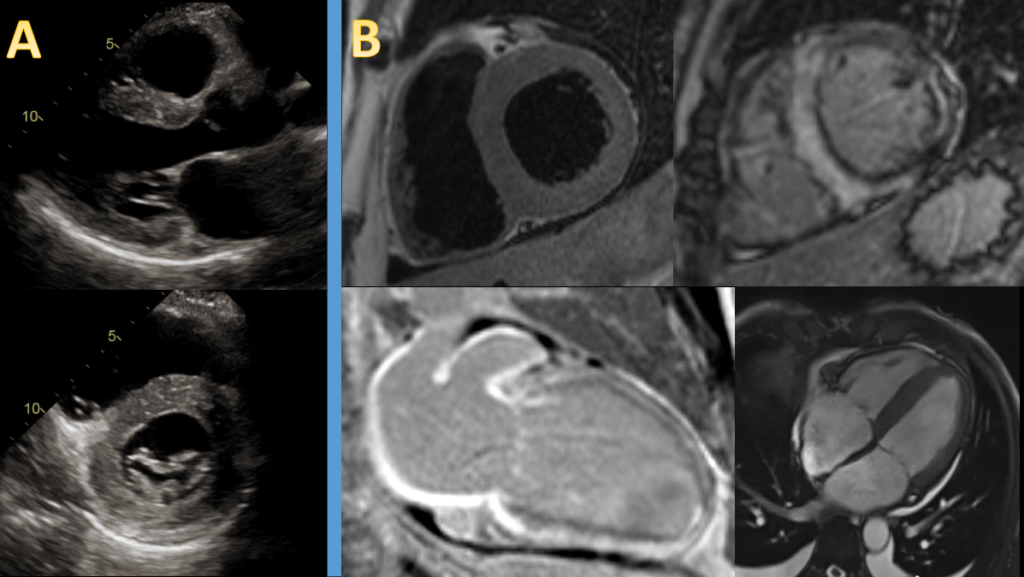
Gli esami ematochimici di routine risultavano nei limiti, ad eccezione di una lieve anemia. Visto il reperto ECG in un paziente giovane senza fattori di rischio cardiovascolare, non obeso o broncopatico, ripetevamo un ecocardiogramma (Fig. 2a).
L’esame mostrava un ventricolo sinistro con moderato ispessimento parietale (SIV 15 mm; PP 13 mm), lieve riduzione della frazione di eiezione (FE BP 46%), disfunzione diastolica di II grado, moderata dilatazione atriale sinistra con setto interatriale ispessito ed un minimo versamento pericardico.
Una volta eseguita la cardioversione con successo, dimettevamo il paziente programmando una risonanza magnetica cardiaca ed esami di laboratorio di approfondimento.
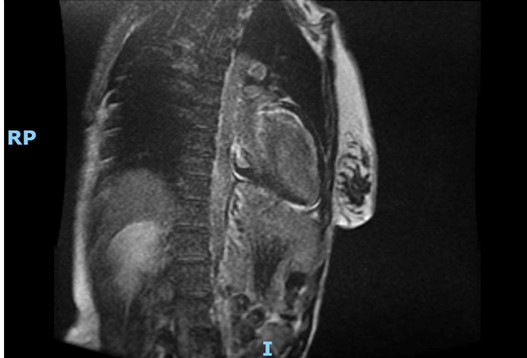
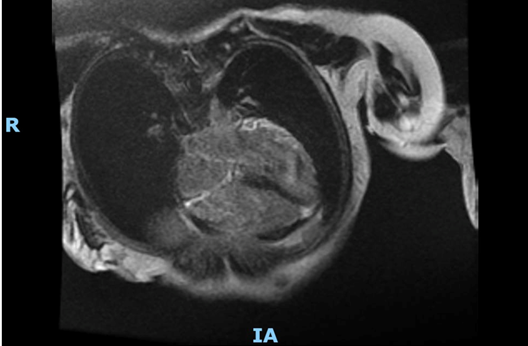
La risonanza magnetica (Fig. 2b) confermava il diffuso ispessimento parietale del ventricolo sinistro e, inoltre, mostrava: ipocinesia diffusa del ventricolo sinistro con maggior compromissione dei segmenti basali e una frazione di eiezione moderatamente ridotta (38%); dilatazione biatriale; assenza di edema miocardico nelle sequenze STIR; marcato late gadolinium enhancement (LGE) con distribuzione meso-epicardica coinvolgente maggiormente i segmenti medio-basali con risparmio relativo dell’apice del ventricolo sinistro; LGE diffuso del ventricolo destro.
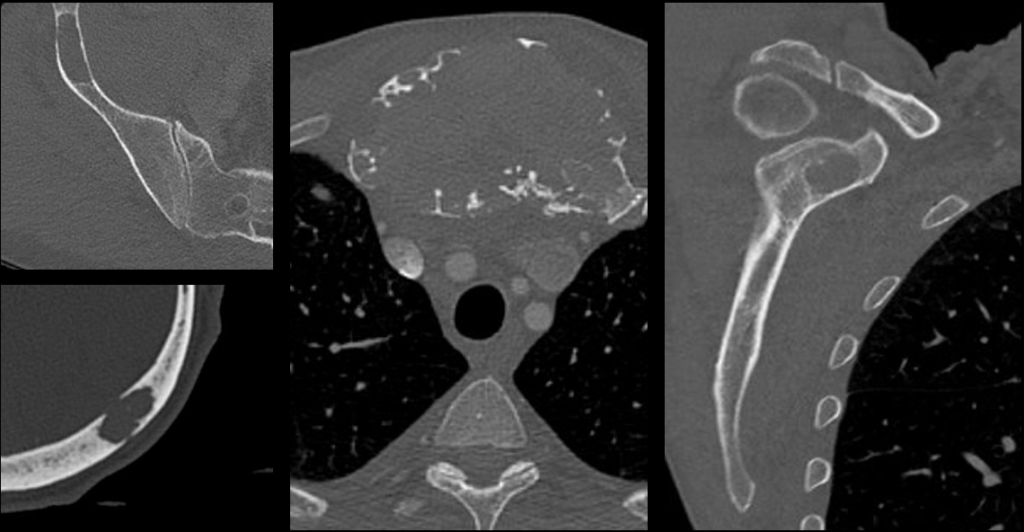
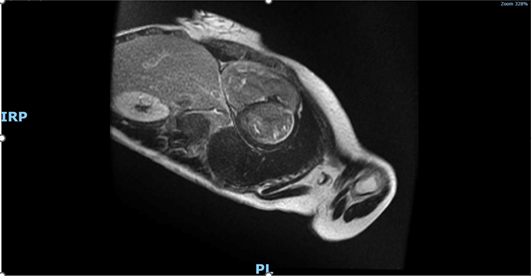
Come reperto collaterale veniva inoltre segnalata una formazione espansiva 10×7 cm nel mediastino antero-superiore. Una tomografia computerizzata (TC) total-body di approfondimento chiariva la sede della lesione (manubrio dello sterno) e la caratterizzava come lesione litico-espansiva; inoltre mostrava numerose lesioni osteolitiche a carico di cranio, scapole, bacino e coste (Fig. 3).
Dagli esami di laboratorio richiesti risultava: NT-proBNP 5759 pg/mL; troponina-T hs 48 pg/ml; ipergammaglobulinemia (20.44 g/L, r.i. 8-13.5); catene leggere libere sieriche elevate (k 70.7 mg/L, v.n. 3.3-19.4 mg/L; lambda 3620 mg/L, v.n. 5.7-26.3; k/lambda ratio 0.02); catene leggere libere urinarie aumentate (k 931.8 mg/L, v.n. <32.9; lambda 18299.4 mg/L, v.n. <3.79); severa proteinuria (3758 mg/L, v.n. <100); proteinuria di Bence-Jones positiva.
Si concludeva, dunque, per una diagnosi di Amiloidosi cardiaca da catene leggere secondaria a Mieloma Multiplo micromolecolare. Una biopsia osteomidollare confermava definitivamente la diagnosi.
DISCUSSIONE
Abbiamo presentato un caso di fibrillazione atriale in un paziente relativamente giovane, senza fattori di rischio cardiovascolare né storia di ipertensione arteriosa non trattata o altre malattie significative.
Questi elementi da soli dovrebbero far sorgere il sospetto che la fibrillazione atriale non sia l’unico problema del paziente, specialmente alla luce del reperto ECG di bassi voltaggi del QRS in un paziente normopeso, senza storia di BPCO od altre condizioni che possano spiegare il dato. Il caso, quindi, mette in luce il ruolo cruciale di una scrupolosa raccolta anamnestica e di una corretta interpretazione degli esami di primo livello. Nel caso specifico, un semplice elettrocardiogramma ci ha indotti a pensare che una manifestazione clinica comune (la fibrillazione atriale) potesse celare un quadro clinico più complesso.
Il caso, infine, sottolinea il ruolo principe della risonanza magnetica cardiaca nell’avvalorare il sospetto diagnostico di amiloidosi cardiaca grazie all’elevato potere di caratterizzazione tissutale e allo studio della distribuzione del mezzo di contrasto paramagnetico.
La biopsia osteomidollare, non solo è stata necessaria per la diagnosi di mieloma multiplo, ma è anche stata indispensabile per la definitiva conferma diagnostica di amiloidosi cardiaca (1).
BIBLIOGRAFIA
1. Garcia-Pavia P, Rapezzi C, Adler Y, Arad M, Basso C, Brucato A, et al. Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2021;42:1554–1568. https://doi. org/10.1093/eurheartj/ehab072
Pacing del Sistema di Conduzione per re sincronizzare il cuore trapiantato: un case-report
Amato Santoro MD2; Claudia Baiocchi MD2; Simone Taddeucci MD1; Giacomo Merello MD1; Federico Landra MD1; Carmine Marallo MD1; Matteo Cameli MD-PhD1
1Dipartimento Biotecnologie Mediche, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia
2Dipartimento Cardio-toraco-vascolare, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia
ABSTRACT
Abbiamo conseguito l’impianto di un device di resincronizzazione cardiaca (CRT) tramite stimolazione del sistema di conduzione (PSC) in un paziente sottoposto a trapianto cardiaco affetto da scompenso cardiaco con frazione d’eiezione severamente ridotta e fibrillazione atriale con disturbi del sistema di conduzione (blocco bifascicolare e QRS > 160 ms). Al monitoraggio elettrocardiografico veniva evidenziato un blocco atrioventricolare parossistico completo. La vasculopatia dell’allotrapianto cardiaco (CAV) è stata esclusa mentre non si evidenziava rigetto alla biopsia endomiocardica. Il pacing biventricolare standard non è stato realizzabile a causa dell’assenza di un ramo del seno coronarico consono all’impianto. Abbiamo pertanto effettuato l’impianto a livello del fascio di His, optando inoltre per l’apposizione di un defibillatore (ICD) data la severa disfunzione sinistra. Durante il follow-up si è verificato un miglioramento della funzione cardiaca sinistra e della qualità della vita (QoL) con un’alta percentuale di stimolazione e resincronizzazione.
INTRODUZIONE
Il blocco atrioventricolare (BAV) è una causa comune di impianto permanente di pacemaker (PM) nei pazienti sottoposti a trapianto cardiaco (Htx). Le cause di BAV permanente o completo non sono completamente chiare, ma l’età avanzata e un tempo operatorio maggiore (incluso il tempo totale di ischemia e il tempo di riperfusione) sono stati associati con un maggior rischio di sviluppare BAV [1].
I pazienti che presentano sia BAV che una frazione d’eiezione ridotta possono beneficiare della terapia di resincronizzazione cardiaca e, nei casi in cui la venografia del seno venoso riveli un’anatomia venosa non idonea all’impianto dell’elettrocatetere sinistro, l’uso del PSC andrebbe considerato come alternativa per la stimolazione [2]. A nostra conoscenza, non sono mai stati descritti impianti di CRT usando PSC nei riceventi Htx con disfunzione cardiaca ventricolare sinistra. In questo report presentiamo una stimolazione del sistema hissiano in un paziente sottoposto a trapianto cardiaco 20 anni orsono con patologia del sistema di conduzione, fibrillazione atriale e disfunzione severa del ventricolo sinistro senza segni di vasculopatia significativa delle arterie coronariche epicardiche e anatomia inadeguata per il pacing biventricolare classico.
CASO CLINICO
Un uomo di 65 anni, sottoposto a trapianto cardiaco 20 anni orsono, veniva ricoverato in terapia intensiva cardiologica (UTIC) per un quadro di scompenso cardiaco acuto congestizio durante episodio di fibrillazione atriale (FA), non nota in precedenza, ad alta risposta ventricolare media. L’analisi ecocardiografica mostrava una severa disfunzione ventricolare sinistra (FE 25%) data da ipocinesia diffusa dei segmenti parietali. Il paziente presentava inoltre insufficienza renale acuta (IRA) su patologia cronica renale.
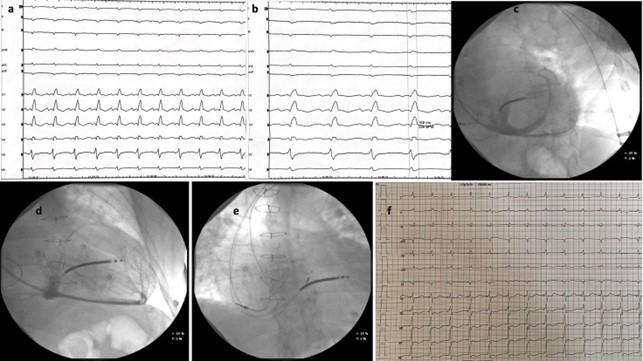
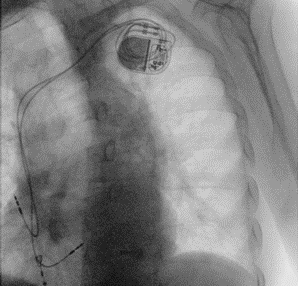
A: ECG basale; B: ECG a 100 mm/s e durata del QRS (168 ms); C: venografia del seno coronarico in RAO 40°; D: fluoroscopia in LAO che mostra una vena posteriore apicale e una piccola vena laterale; E: poisizione a livello del fascio di His dell’elettrocatetere 3830 in visione atero-posteriore; F: ECG finale.
Inizialmente l’aritmia veniva trattata con cardioversione farmacologica a seguito di conferma dell’assenza di trombosi endo-auricolare, dopo la quale l’ECG mostrava blocco di branca destro (BBDx) completo e concomitante emiblocco fascicolare anteriore sinistro (EAsn) con intervallo PR nei limiti (Fig 1A). La durata del QRS misurava 168 ms, come mostrato nella figura 1B. Durante il successivo decorso, nonostante il ripristino del ritmo sinusale, il paziente permaneva in classe funzionale ridotta NYHA III con sintomi per sforzi lievi e disfunzione ventricolare severa. Al monitoraggio telemetrico continuo si evidenziava un BAV completo parossistico. Ai fini dell’esclusione della vasculopatia di allotrapianto cardiaco il paziente veniva sottoposto ad angiografia coronarica che non mostrava sviluppo di tale condizione. Inoltre, la biopsia endomiocardica condotta per investigare le cause di disfunzione ventricolare sinistra nel cuore trapiantato non rivelava uno stato di rigetto cellulare o umorale.
Considerando la bassa frazione d’eiezione con QRS allungato e la necessità di stimolazione in BAV completo, il caso veniva discusso e si poneva indicazione a terapia di resincronizzazione con ICD, seguendo le evidenze delle ultime linee guida europee [2]. In considerazione della pregressa chirurgia cardiaca, previa procedura si eseguiva venografia del sistema venoso sinistro, confermando la pervietà della vena succlavia sinistra. Le guide e i cateteri sono stati avanzati attraverso l’accesso venoso ascellare ottenuto a seguito di tre differenti punture. Due cateteri a fissazione attiva sono stati usati per l’atrio e il ventricolo destro. Il mezzo di contrasto somministrato a livello del seno coronarico non rivelava rami venosi di adeguato calibro ai fini della stimolazione biventricolare classica (Figura 1C e 1D) motivo per il quale si optava per il proseguimento con stimolazione del sistema di conduzione, iniziando con tentativo di pacing del fascio di His (HBP).
L’HBP veniva realizzato usando l’elettrocatetere Select Secure (Model 3830, 69 cm, Medtronic) veicolato tramite un delivery a curva fissa (Modello C315 HIS, Medtronic). La regione hissiana è stata identificata tramite mapping endocardico fino al raggiungimento di un segnale del fascio di His distale. Il tempo HV risultava normale: 45 ms.
Durante il test di stimolazione si osservava cattura del fascio di His con risultante restringimento del QRS e correzione del disturbo di conduzione, dato che permaneva anche a seguito dell’avvitamento dell’elettrocatetere. Dopo il fissaggio, con uno stimolo ad alta soglia l’ECG mostrava cattura non-selettiva del fascio di His (larghezza QRS 110 ms), e cattura miocardica (150 ms) durante stimolo a bassi voltaggi. Durante la procedura è stato eseguito il mappaggio dell’area della branca sinistra ma, nonostante il raggiungimento di QRS stretto (120 ms), le soglie di cattura risultavano essere troppo elevate, probabilmente a causa del substrato tissutale miocardico danneggiato del cuore trapiantato (di cui dettagli verranno discussi nel paragrafo successivo).
In considerazione della durata ottimale del QRS abbiamo preferito impiantare una CRT con stimolazione del fascio di His. Utilizzando la fluoroscopia in LAO 40° abbiamo avanzato il catetere con contemporanea rapida rotazione, ottenendo un QRS finale di 105 ms (Figura 1F). Il posizionamento finale a livello dell’His distale è visualizzabile tramite la fluoroscopia in Figura 1E. Successivamente sono state controllate le soglie, ottenendo una soglia di cattura non-selettiva a 2V x 1ms, con una durata QRS di 105 ms (Figura 1F), mentre con soglia inferiori si otteneva cattura miocardica con QRS più largo. L’ampiezza della soglia è stata quindi programmata a 3V x 1ms con un calcolo della durata della batteria di 4 anni. In ultimo, dopo aver confermato la stabilità del catetere a livello settale è stato retratto il delivery avanzando contemporaneamente il catetere riducendone la tensione ed evitando lo sposizionamento. Durante la seguente degenza non si sono sviluppate complicanze post-procedurali. Dopo monitoraggio dello stato emodinamico utile alla titolazione della terapia medica ottimale, il paziente è stato dimesso con buon compenso e valida decongestione sistemica.
Alla visita di follow-up dopo 6 mesi il paziente ho mostrato un miglioramento della frazione d’eiezione da 25 a 40% con riduzione della classe funzionale NYHA da III a I. La stimolazione biventricolare risultava > del 92%.
DISCUSSIONE
L’aumento dei tassi di sopravvivenza per i riceventi cuori trapiantati nel tempo fa sì che i clinici debbano interfacciarsi con nuove sfide, includendo la gestione di nuove complicanze legate al rigetto cronico, alla CAV, alla disfunzione del graft e alle aritmie. I disturbi del sistema di conduzione sono comuni tra i pazienti sottoposti a Htx [3] e sono legati al danno intrinseco del tessuto miocardico del graft. I fattori che contribuiscono alle alterazioni istologiche del miocardio e del tessuto di conduzione devono essere considerati quando si pone indicazione ad impianto di PM in questa tipologia di pazienti, in quanto possono contribuire alla necessità di alte soglie di cattura, peggiori parametri di sensing e di impedenza. I fattori prima citati, in congiunta con l’infiammazione cronica, porta a fibrosi del tessuto e alla generazione di cicatrici intramiocardiche, assieme ad alterazioni batmotrope legate alla denervazione atriale [4].
Gli attuali trials utili alla valutazione dei benefici della CRT e dei defibrillatori endocavitari non includono i pazienti sottoposti a trapianto cardiaco e le indicazioni sono le stesse dei pazienti non trapiantati. La letteratura sulla CRT si focalizza prevalentemente sul pacing biventricolare classico, con ridotte evidenze riguardo il PSC [5]. Quest’ultimo è un metodo emergente per eseguire una CRT efficace, e le tecniche per ottenerlo sono state descritto solo di recente [6]. Le indicazioni per il PSC sono tutt’ora fonte di dibattito data la presenza di estensiva letteratura sul pacing biventricolare e la carenza di trials clinici randomizzati.
Attualmente le evidenze indicano la CRT come terapia per lo scompenso cardiaco sintomatico con frazione d’eiezione ridotta e il QRS > 130 ms. La tecnica tradizionale prevede l’impianto degli elettrocateteri a livello intracavitario destro e nel sistema venoso sinistro passando dal seno coronarico [7]. Le nuove tecniche permettono la stimolazione del sistema di conduzione a livello del fascio di His o della branca sinistra, provvedendo ad una stimolazione fisiologica della massa ventricolare. Le attuali indicazioni suggeriscono l’uso del PSC sono in casi di insuccesso del pacing biventricolare. Grandi registri hanno dimostrato per il PSC una curva di apprendimento rapida ed un sistema sicuro, oltre che facilmente attuabile, fattori che possono portare a nuove indicazioni per il suo utilizzo. In ogni caso, l’applicazione della CRT nei pazienti Htx non vede la presenza di dati consistenti, soprattutto nella presenza di BBDx, il quale risulta essere un elemento frequente nella disfunzione del graft [8]. Alcuni report suggeriscono che i pazienti soggetti a sviluppo di scompenso cardiaco a seguito di Htx che necessitano inoltre sulla base del quadro patologico di un alto tasso di stimolazione cardiaca traggono beneficio dall’impianto di CRT [7,9].
Nel nostro manoscritto abbiamo riporatato un caso di CRT utilizzando il PSC in un paziente con severa disfunzione ventricolare sinistra, fibrillazione atriale, BBdx, EAsn e BAV completo parossistico. Il BAV nei pazienti trapiantati ha la tendenza a svilupparsi in un momento tardivo in quanto disfunzione del sistema di conduzione long-term, mentre la malattia del nodo del seno si manifesta tipicamente nel primo periodo post-operatorio. Il BAV è solitamente parossistico e spesso sotto-diagnosticato a causa della clinica non specifica di manifestazione. Inoltre, il paziente che riceve un impianto di PM per BAV in Htx può necessitare di un’alta percentuale di stimolazione ventricolare [10], rendendo il PSC potenzialmente efficace nel prevenire la disfunzione ventricolare PM indotta. In ultimo, i dati limitati riguardo l’impianto di CRT nei pazienti post-Htx possono essere correlati all’imputazione della causa di disfunzione a cause potenzialmente correggibili come il rigetto cardiaco, evidenziando la necessità di ulteriori studi sul tema.
CONCLUSIONI
In questo caso clinico viene rappresentata la fattibilità nell’esecuzione di pacing del sistema di conduzione in un paziente sottoposto a trapianto cardiaco da numerosi anni, senza cause specifiche di disfunzione del graft quali il rigetto acuto o la patologia coronarica da vasculopatia dell’allotrapianto, ma con disfunzione ventricolare sinistra severa e BAV. L’indicazione alla CRT nei riceventi Htx non è standardizzata ma la procedura è attuabile nonostante le modifiche anatomiche legate all’intervento e le alterazioni del sistema di conduzione correlate alla fibrosi, data dai vari fattori a cui questo tipo di pazienti sono sottoposti dal momento dell’impianto del graft. Gli esiti post-impianto sono risultati sovrapponibili a quelli dei pazienti a cui è stato eseguito un impianto di CRT-PSC non sottoposti ad Htx. I dati raccolti su questo tipo di strategia di pacing e le indicazioni specifiche in relazione agli outcome sono attualmente molto carenti e pressochè assenti in questo subset di pazienti. In considerazione dello stretto follow-up a cui i pazienti Htx vengono sottoposti e dei molteplici fattori coinvolti al danno del miocardio, nuovi studi sono consigliabili e necessari per approfondire e sviluppare le indicazioni in questo campo dove le possibili cause di disfunzione del sistema di conduzione possono rendere difficile l’adeguata selezione delle terapie.
BIBLIOGRAFIA
1. Wellmann P, Herrmann FE, Hagl C, Juchem G. A Single Center Study of 1,179 Heart Transplant Patients-Factors Affecting Pacemaker Implantation. Pacing Clin Electrophysiol. 2017;40(3):247-54. doi:10.1111/pace.13021
2. Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy [published correction appears in Europace. 2022 Mar 07;:]. Europace. 2022;24(1):71-164. doi:10.1093/europace/euab232
3. DeFilippis, Ersilia M et al. “Cardiac Implantable Electronic Devices Following Heart Transplantation.” JACC. Clinical electrophysiology vol. 6,8 (2020): 1028-42. doi:10.1016/j.jacep.2020.06.023
4. Bharati S, Billingham M, Lev M. The conduction system in transplanted hearts. Chest. 1992;102(4):1182-88. doi:10.1378/chest.102.4.1182
5. Boczar K, Ząbek A, Ulman M, Lelakowski J, Małecka B. His bundle pacing in a patient after heart transplant and complete atrioventricular block. Kardiol Pol. 2021;79(1):81-82. doi:10.33963/KP.15681
6. Burri H, Jastrzebski M, Cano Ó, et al. EHRA clinical consensus statement on conduction system pacing implantation: executive summary. Endorsed by the Asia-Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS) and Latin-American Heart Rhythm Society (LAHRS). Europace. 2023;25(4):1237-48. doi:10.1093/europace/euad044
7. McDowell DL, Hauptman PJ. Implantable defibrillators and cardiac resynchronization therapy in heart transplant recipients: results of a national survey. J Heart Lung Transplant. 2009;28(8):847-50. doi:10.1016/j.healun.2009.04.016
8. Marcus GM, Hoang KL, Hunt SA, Chun SH, Lee BK. Prevalence, patterns of development, and prognosis of right bundle branch block in heart transplant recipients. Am J Cardiol. 2006;98(9):1288-90. doi:10.1016/j.amjcard.2006.06.018
9. Tu SJ, Wong CX, Stokes MB, Pitman BM, Sanders P, Lau DH. Cardiac resynchronization therapy in an orthotopic heart transplant recipient. J Cardiol Cases. 2022;27(2):80-83. Published 2022 Nov 10. doi:10.1016/j.jccase.2022.10.011
10. Raghavan C, Maloney JD, Nitta J, et al. Long-term follow-up of heart transplant recipients requiring permanent pacemakers. J Heart Lung Transplant. 1995;14(6 Pt 1):1081-89.
Coinvolgimento cardiaco in corso di sclerosi sistemica
Enrico Ponti 1, Camilla Cirelli 2, Anna Merlo 2, Emanuele Curti 2, Gaetano Asile 3, Gaia Gasperini 4, Piermario Scuri 2
1. Università degli studi di Sassari
2. Università degli studi di Milano-Bicocca
3. Università degli studi di Napoli Federico II
4. Humanitas University
ABSTRACT
La sclerosi sistemica (SSc) è una rara malattia autoimmune che si manifesta con fenomeni fibrotici e vasculopatici interessanti la cute e talvolta gli organi interni. [1] La SSc può essere associata ad elevata morbilità e mortalità, soprattutto quando sussiste un coinvolgimento poli organo. [2]
Riportiamo un raro caso di una paziente di 27 anni con diagnosi di sclerosi sistemica e concomitante impegno cardiaco.
INTRODUZIONE
La diagnosi di coinvolgimento cardiaco primario nella SSc (pSHI) rappresenta una sfida significativa per i medici che gestiscono questa tipologia di pazienti. Il pSHI può presentarsi clinicamente con un fenotipo clinico variabile: talora con quadri di insufficienza cardiaca acuta o miocardite fulminante, difetti di conduzione asintomatici, aritmie ventricolari ed infine disfunzione diastolica ritenuta secondaria alla fibrosi miocardica.[3] In letteratura vi sono crescenti evidenze sui fenomeni fisiopatologici che portano all’insufficienza cardiaca: quest’ultima potrebbe instaurarsi in seguito a ripetuti episodi di ischemia che portano ad una fibrosi miocardica focale irreversibile. Le ragioni di questo fenomeno sono date dalla compromissione del microcircolo coronarico e l’anormale vasoreattività tipica di questi pazienti. La fibrosi miocardica e la microangiopatia vascolare possono favorire inoltre l’insorgenza di aritmie e disturbi della conduzione. Nonostante le evidenze istopatologiche di coinvolgimento cardiaco all’autopsia, il riscontro di pSHI nella pratica clinica è relativamente raro.[4]
In questo caso clinico vi parleremo di una paziente giunta alla nostra osservazione con il fenotipo clinico sopra menzionato.
CASO CLINICO
Donna di 27 anni, senza fattori di rischio e precedenti cardiovascolari. All’anamnesi patologica remota presenza di bronchite asmatica e disturbo dell’adattamento.
Nel 2016 è stata diagnosticata la Sclerosi Sistemica con interessamento cutaneo diffuso ed ulcere digitali ricorrenti. In tale occasione la paziente ha eseguito un ecocardiogramma che non mostrava alterazioni morfo-funzionali. È stata impostata con beneficio terapia con Metotrexate, Iloprost ev. e Bosentan. La paziente ha eseguito sino al 2021 le visite di follow-up reumatologico in maniera regolare. Persa al FU, ha interrotto le terapie sino a Giugno 2023, periodo in cui ha eseguito una visita reumatologica di controllo per ricomparsa di ulcere digitali. In tale occasione la paziente ha riferito nell’ultimo periodo presenza di dispnea ingravescente. Gli esami ematochimici mostravano un concomitante aumento dei valori di BNP (1112 ng/L). Per tale motivo è stata eseguita una consulenza cardiologica: l’ECG ha mostrato dei disturbi di conduzione (BBDx+EAS), all’ecocardiogramma sono state evidenziate alterazioni della cinetica segmentaria, un’iniziale disfunzione sistolica biventricolare e la presenza di segni indiretti di ipertensione polmonare. È stato inoltre eseguita la registrazione ECG Holter 24h dove sono state identificate numerose extrasistoli sopraventricolari e ventricolari polimorfe (entrambe, talvolta, disposte in ritmo bi e trigemino). Agli esami ematochimici è stato riscontrato un rialzo degli enzimi di miocardiocitonecrosi con andamento a plateau (TnI 400-500 ng/L). La paziente è stata pertanto ricoverata presso l’unità di Cardiologia dell’Ospedale ASST Papa Giovanni XXIII per gli approfondimenti diagnostici del caso.
Durante il ricovero, sono stati eseguiti diversi esami strumentali.
Ecocardiogramma- stress con dobutamina: il test è stato submassimale (66 % FC max teorica), interrotto per malessere e AIVC (triplette). Sono stati descritti verosimili esiti ischemici polidistrettuali: fibrosi della parete inferiore e posterolaterale ed assottigliamento del segmento apicale del setto interventricolare. È stata evidenziata una risposta ischemica sul setto apicale e sul segmento basale della parete laterale. È stata segnalata infine un’adeguata riserva contrattile.
Data l’incidenza in corso di sclerosi sistemica di processi infiammatori coinvolgenti il miocardio, è stata eseguita una RM cardiaca al fine di differenziare un eventuale pattern ischemico da uno miocarditico/infiammatorio.
L’esito della RM cardiaca ha mostrato un ventricolo sinistro con volume telesistolico aumentato e frazione di eiezione ridotta (FE 42%). Ipocinesia della parete antero-settale e anteriore dei segmenti medio-basali. Non sono state evidenziate aree di edema miocardico nelle sequenze T2 pesate. Nelle immagini tardive dopo mdc è stata segnalata la presenza di LGE sub-endocardico della parete anteriore e setto anteriore nei segmenti basali e della parete laterale nei segmenti medio-basale. Presente LGE anche nei muscoli papillari.
Il ventricolo destro presenta volumetrie sisto-diastoliche aumentate, con funzione globale depressa (frazione di eiezione 24 %). Ipocinesia della parete libera nel III medio prossimale. Presenza focale di LGE della parete libera più prossimale alla base.
Dato il riscontro di un pattern ischemico con esteso coinvolgimento del microcircolo coronarico, è stata proposta, al fine di un ulteriore completamento diagnostico, l’esecuzione di una coronarografia e concomitante studio del microcircolo che tuttavia la paziente ha rifiutato.
Alla dimissione, discusso il caso con i colleghi Reumatologi, è stata introdotta una terapia antiaggregante.
BIBLIOGRAFIA
- J.E. Pope, C.P. Denton, S.R. Johnson et al. State-of-the-art evidence in the treatment of systemic sclerosis. Nat Rev Rheumatol. 2023; 19(4): 212–226.
- C- Bruni, L. Ross. Cardiac involvement in systemic sclerosis: Getting to the heart of the matter. Best Pract Res Clin Rheumatol. 2021 Sep;35(3):101668
- L.Nie, X. Wang, T.Zhang et al. Cardiac complications in systemic sclerosis: early diagnosis and treatment. Chin Med J (Engl). 2019 Dec 5; 132(23): 2865–2871
- A. Kruszec, P. Kotyla. Heart involvement in systemic sclerosis. Pol Merkur Lekarski 2016 Sep 29;41(243):156-159.
Peak strain dispersion nel pacing della branca sinistra: case report
Alessandra Nocilla (1), Giuseppe Caliendo (1), Emanuele Nigro (1), Gennaro Vitulano (2), Rodolfo Citro (2), Cristina Esposito (2), Angelo Giano (1), Antonella Rispoli (1), Michele Manzo (2), Carmine Vecchione (1), Gennaro Galasso (1)
1. Azienda ospedaliero Universitaria San Giovanni di Dio Ruggi d’Aragona, Scuola Medica Salernitana, Università di Salerno, Sezione di Cardiologia
2. Azienda ospedaliero Universitaria San Giovanni di Dio Ruggi d’Aragona, Sezione di Cardiologia
ABSTRACT
La stimolazione selettiva della branca sinistra è un nuovo metodo di pacing che prevede il collocamento di un elettrocatetere nell’area della branca sinistra, che risolve buona parte dei problemi correlati alla stimolazione hissiana (1,2). Presentiamo il caso di un paziente di 82 anni con malattia del nodo del seno e blocco di branca sinistra (BBsn), sottoposto ad impianto di pacemaker bicamerale con stimolazione selettiva di branca sinistra. Dopo l’impianto si è evidenziato un netto accorciamento della durata del QRS (da 166 msec a 126 msec) nonché, a livello ecocardiografico, un accorciamento della Peak Strain Dispersion (PSD) da 69 msec a 49 msec, indice di una migliore sincronia della contrazione miocardica.
CASO CLINICO
Paziente di 82 anni giungeva presso il nostro Pronto Soccorso in seguito ad insorgenza improvvisa di dispnea NYHA III. In anamnesi presentava storia di ipertensione arteriosa, diabete mellito di tipo II insulino-dipendente e anemia multifattoriale. L’elettrocardiogramma evidenziava ritmo idioventricolare di scappamento a frequenza ventricolare media di 30 bpm. Gli esami ematochimici mostravano iperkaliemia (K+ 6.8 mEq/L) ed iposodiemia (118 mEq/L) con rialzo dei valori di creatinina (1.5 mg/dl) oltre che un quadro di anemia (Hb 8.7 g/dl).
Si disponeva pertanto per il ricovero presso il reparto di Cardiologia per il proseguimento dell’iter diagnostico-terapeutico. Inizialmente è stata effettuata la correzione delle disionie a seguito delle quali non si riscontrava una risoluzione delle anomalie elettriche del paziente. Veniva pertanto iniziata terapia con isoprenalina in infusione continua a seguito della quale si evidenziava all’ECG di superficie la comparsa di ritmo sinusale a frequenza cardiaca di 58 bpm con BBsn (QRS della durata di 166 msec) e frequente extrasistolia sopraventricolare. A completamento diagnostico, il paziente veniva sottoposto ad esame ecocardiografico con evidenza di funzione contrattile globale conservata (frazione d’eiezione 57%), marcata dissincronia del setto interventricolare (SIV), lieve ipertrofia parietale concentrica, sezioni destre nei limiti per dimensioni e cinesi con segni indiretti di ipertensione sistolica polmonare (PAPs 50 mmHg).
Il paziente veniva inoltre sottoposto a monitoraggio Holter ECG delle 24 ore, da cui si documentava un quadro di malattia del nodo del seno, per cui veniva posta indicazione ad impianto di pacemaker bicamerale. Data la presenza di BBsn con importante dissincronia del SIV e possibile elevata stimolazione ventricolare destra si optava per l’esecuzione di una stimolazione del sistema di conduzione tramite impianto di elettrocatetere sulla branca sinistra.
La procedura decorreva senza complicanze intra-procedurali con buona tolleranza da parte del paziente.
Successivamente, per la valutazione di adeguata stimolazione e posizionamento degli elettrocateteri sono stati misurati i seguenti parametri:
- Elettrocatetere atriale destro: impedenza di stimolazione 526 Ohm; onda P 2 mV; soglia di stimolazione 0.8 V x 0.4 msec di durata dell’impulso;
- Elettrocatetere ventricolare con stimolazione di branca: impedenza di stimolazione 487 Ohm; onda R 14 mV; soglia di stimolazione 0.6 V x 0.4 msec di durata dell’impulso.
Al controllo radiografico post-impianto si confermava l’assenza di complicanze pleuro-parenchimali acute con elettrocateteri normoposizionati (Figura 1).
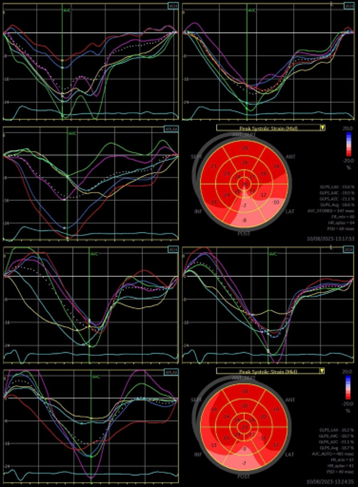
L’’ECG post-impianto mostrava ritmo da pacemaker (atrio guidato-ventricolo stimolato) con QRS della durata di 126 msec (Figura 2). Al controllo ecocardiografico, si evidenziava la presenza di funzione contrattile globale e segmentaria conservata con netto miglioramento della sincronia intraventricolare sinistra. A sostegno di ciò ci si è affidati in post-processing alla tecnica di ecocardiografia avanzata del global longitudinal strain, con evidenza di un accorciamento del PSD da 69 msec a 49 msec (Figura 3). Si è inoltre osservato un miglioramento della gittata cardiaca: sfruttando l’equazione di continuità si è infatti posto a confronto lo stroke volume pre-impianto (60 ml/min) e quello post-stimolazione di branca sinistra (80 ml/min).
DISCUSSIONE
La stimolazione di branca sinistra è una novità relativamente recente nel mondo della cardiostimolazione e prevede il collocamento di un elettrocatetere nell’area della branca sinistra. Nell’ambito della stimolazione del sistema di conduzione (CSP), i vantaggi rispetto alla stimolazione hissiana sono molteplici: l’area target è più ampia, le soglie sono più basse e stabili nel tempo e si riduce il rischio di oversensing atriale (1). Ad oggi, le linee guida europee si limitano a considerare l’utilizzo della stimolazione selettiva di branca sinistra nel caso in cui l’anatomia cardiaca del paziente non consenta l’impianto di un sistema di stimolazione cardiaca biventricolare o in caso in di failure del pacemaker/defibrillatore biventricolare a causa di dislocazione/malfunzionamento (2). Le linee guida americane, invece, prendono in considerazione l’impiego di questa tecnica come alternativa al pacemaker/defibrillatore biventricolare o ancora nei casi in cui, come in questo caso clinico, a dispetto di una conservata funzione contrattile globale ventricolare sinistra (LVEF > 50%), si prospetti una stimolazione ventricolare prolungata (3,4).
Da un punto di vista ecocardiografico, per valutare l’efficacia della tecnica di CSP ci siamo affidati al GLS, metodica che analizza il movimento meccanico di 17 segmenti del miocardio nel ventricolo sinistro (5). In particolare, ci siamo concentrati sull’indice PSD che rappresenta la deviazione standard del tempo al picco di deformazione longitudinale per ciascun segmento del ventricolo sinistro durante la sistole (6). Un accorciamento significativo di questo valore, come dimostrato dalla maggiore sovrapposizione dei picchi delle curve del GLS nella Figura 3, indica una migliore sincronizzazione nella contrazione ventricolare (7, 8).
CONCLUSIONI
Questo caso clinico evidenzia come la stimolazione selettiva della branca sinistra possa determinare un significativo accorciamento del QRS, che a livello ecocardiografico ha comportato un miglioramento della sincronia di contrazione miocardica ed un aumento della gittata cardiaca. La stimolazione di branca garantisce un pacing più fisiologico e una maggiore sincronia cardiaca (9,10). In questo report abbiamo mostrato come la tecnica della stimolazione selettiva della branca sinistra costituisca potenzialmente una valida alternativa all’impianto di pacemaker/defibrillatore biventricolare, con il vantaggio di avere una vasta area target d’impianto e la necessità di stimolazione con basse soglie migliorando la performance cardiaca. Data la carenza dei dati in letteratura, sono necessari studi di larga scala che permettano di poter identificare correttamente i pazienti da candidare a questa tecnica.
BIBLIOGRAFIA
- Jastrzębski M, Kiełbasa G, Cano O et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J. 2022 Oct 21;43(40):4161-4173.
- Michael Glikson, Jens Cosedis Nielsen, Mads Brix Kronborg et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA) European Heart Journal, Volume 42, Issue 35, 14 September 2021, Pages 3427–3520.
- Kusumoto FM, Schoenfeld MH, Barrett C et al. 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines, and the Heart Rhythm Society. J Am Coll Cardiol. 2019 Aug 20;74(7):932-987.
- Chung MK, Patton KK, Lau CP et al. 2023 HRS/APHRS/LAHRS guideline on cardiac physiologic pacing for the avoidance and mitigation of heart failure. Heart Rhythm. 2023 Sep;20(9):e17-e91.
- Lang RM, Badano LP, Mor-Avi V et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 233–270.
- Voigt JU, Pedrizzetti G, Lysyansky P e al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 1–11
- Li, C., Yuan, M., Li, K. et al. Value of peak strain dispersion in discovering left ventricular dysfunction in diabetes mellitus. Sci Rep 10, 21437 (2020).
- Erika, N. A. et al. Left ventricular mechanical dispersion in a general population: data from the Akershus Cardiac Examination 1950 study. Eur. Heart J. Cardiovasc. Imaging. 21, 183–190 (2020).
- Wang Y, Zhu H, Hou X, et al. LBBP-RESYNC Investigators. Randomized Trial of Left Bundle Branch vs Biventricular Pacing for Cardiac Resynchronization Therapy. J Am Coll Cardiol. 2022 Sep 27;80(13):1205-1216.
- Mornos, C. et al. Risk stratification in patients with heart failure: the value of considering both global longitudinal left ventricular strain and mechanical dispersion. Can. J Physiol. Pharmacol. 95, 1360–1368 (2017).
Ablazione bipolare di una tachicardia atriale proveniente dal setto interatriale
Vincenzo Mirco La Fazia, MD1-2, Nicola Pierucci, MD2-3, Giacomo Bonacchi, MD1, Saverio Muscoli, MD1
1 Division of Cardiology, University Hospital “Tor Vergata”, 00133 Rome, Italy
2 Texas Cardiac Arrhythmia Institute, St David’s Medical Center, Austin, Texas, USA
3 Division of Cardiology, University Hospital “Umberto I”, Rome, Italy
ABSTRACT
Paziente maschiodi 70 anni con fibrillazione atriale (FA) ricorrente arriva per ablazione transcatetere con radiofrequenza dopo tre precedenti ablazioni non riuscite. Nonostante fossero state ablate i tipici trigger della FA, l’aritmia persisteva, portando all’identificazione del setto interatriale (IAS) come probabile causa della tachicardia. Data la profondità e lo spessore dell’IAS, l’ablazione tradizionale con radiofrequenza si è rivelata inefficace. Tuttavia, utilizzando la tecnica alternativa di erogare energia in modalità bipolare (B-RFCA), la tachicardia atriale è stata terminata con successo. La B-RFCA si dimostra un potenziale nell’interrompere efficacemente le tachicardie derivanti da localizzazioni intramurali profonde, suggerendo il suo potenziale come tecnica fondamentale per casi complessi come la tachicardia atriale settale.
CASO CLINICO
Un paziente maschio di 70 anni con fibrillazione atriale (FA) persistente si è presentato per ablazione transcatetere dopo recidiva nonostante precedenti ablazioni.
Tramite accesso giugulare è stato posizionato un catetere lineare a 20 poli con elettrodi che dalla SVC e alla crista terminalis (CT) al seno coronarico (CS). L’ecocardiografia intracardiaca (ICE) è stata posizionata nell’atrio destro come aiuto per la puntura transettale. Un catetere mappante circolare (Lasso 20 mm/10 elettrodi) e un catetere per ablazione (QDOT MICROTM) sono stati avanzati nell’atrio sinistro.
Durante il mappaggio, è stato osservato che tutte le PV erano silenti dalle precedenti ablazioni. Nonostante l’isolamento del PW atriale sinistro, SVC, CS e LAA, il paziente è rimasto in AF.
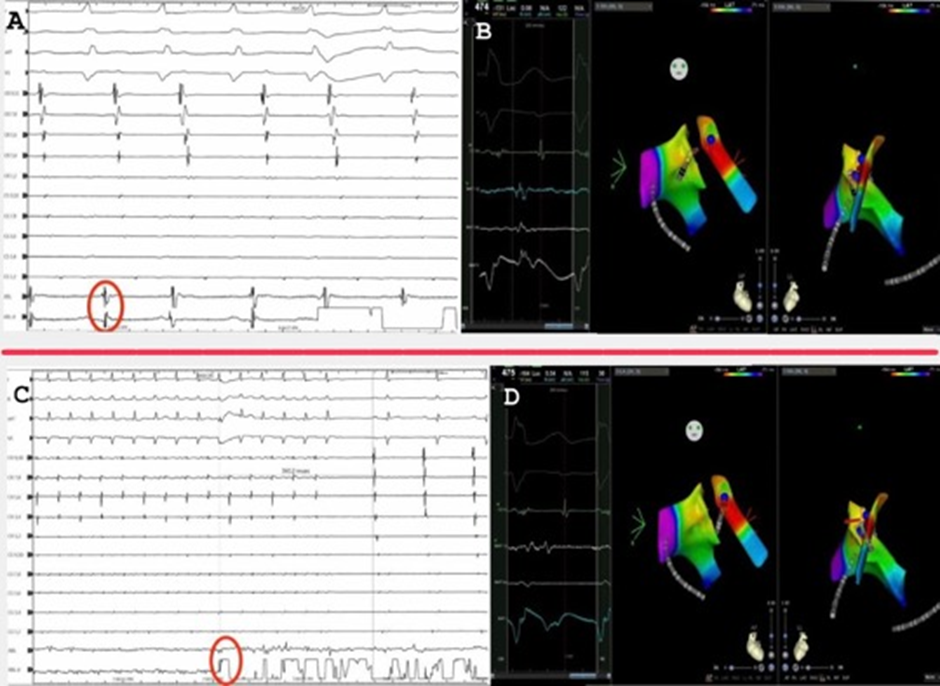
A: Elettrogrammi intracardici prima della prima terminazione sul lato destro dell’IAS.
Il cerchio rosso indica il potenziale più precoce registrato dal catetere ablatore.
B: Mappa di voltaggio CARTO-3D che mostra potenziali precoci (-151 msec) e il corrispondente elettrogramma sharp (near-field) sul lato destro dell’IAS precedenti alla prima terminazione in visione anteroposteriore e laterale sinistra.
C: Elettrogrammi intracardici della seconda terminazione sul lato sinistro dell’IAS. il tempo necessario dall’inizio dell’ablazione alla temppranea ristorazione del ritmo sinusale è stato 3412 msec.
Il cerchio rosso indica il potenziale più precoce registrato dal catetere ablatore e l’inizio dell’ablazione.
D: Mappa di voltaggio CARTO-3D che mostra potenziali precoci (-164 msec) e il corrispondente elettrogramma far-field) sul lato sinistro dell’IAS precedenti alla seconda terminazione in visione anteroposteriore e laterale sinistra.
I cateteri per identificare eventuali trigger extrapolmonari sono stati posizionati per identificare trigger extrapolmonari: il Lasso nella PV superiore sinistra per registrare il far-field proveniente dall’ LAA, il QDOT nella PV superiore destra per registrare il far-field dall’ IAS e fisso, il duodecapolare con gli elettrodi che vanno dalla SVC al CS. Con questa configurazione, quando si osserva un’attività atriale ectopica focale, la sua sequenza di attivazione viene confrontata con quella del ritmo sinusale, portando così all’identificazione della sua area di origine.4 L’onda P è usata come riferimento per identificare il sito di attivazione più precoce in correlazione agli elettrogrammi locali.
È stata eseguita cardioversione elettrica esterna con ripristino del ritmo sinusale e un successivo test di provocazione farmacologica con infusione di isoproterenolo ad alte dosi (20 μg/min) per identificare i trigger extrapolmonari.
Poco dopo, è stata indotta una AT con cycle lenght (CL) di 250 msec.
Sono stata registrate un’attivazione sincrona in entrambi i segmenti CT e CS del duodecapolare e un’attività atriale far-field più precoce sul QDOT, suggerendo così l’origine dall’IAS.
L’ablazione con radiofrequenza è stata eseguita lungo il setto atriale sinistro, con conseguente terminazione dell’AT.
Poche ore dopo l’ablazione, il paziente ha avuto una recidiva di AT sintomatica ed è stato quindi sottoposto a nuova procedura di ablazione di AT il giorno seguente.
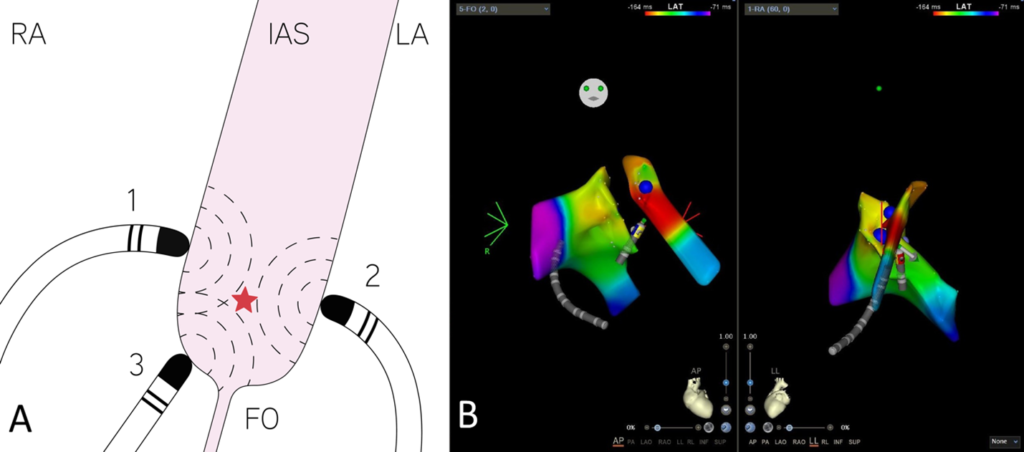
A: Disegno digitale che mostra: il primo punto di terminazione sul lato destro dell’IAS (1), il secondo punto di terminazione sul lato sinkstro dell’IAS (2), il terzo punto di terminazione a livello della fossa ovale (3) e la potenziale posizione intramurale del focus della AT all’interno dell’IAS (stella rossa).
B: Mappa CARTO-3D che mostra i tre punti di terminazione (sfere blu) in visione anteroposterioere e laterale sinistra.
Il paziente arrivava nel laboratorio di elettrofisiologia in AT.
La registrazione degli elettrogrammi e la mappa di attivazione hanno suggerito la stessa origine dall’ IAS della procedura precedente.
Potenziali precoci sono stati registrati dal catetere di ablazione posizionato sul lato destro dell’IAS. (Figura 1A-1B) Il QDOT è stato quindi avanzato nell’atrio sinistro.
Potenziali più precoci sono stati ablati lungo il setto atriale sinistro con breve terminazione dell’AT. (Figura 1C-1D)
Potenziali precoci sono stati quindi mappati e ablati nuovamente dall’atrio destro a livello della fossa ovale, portando a un’ulteriore temporanea cessazione dell’AT. (Figura 2)
Considerando l’ampio spessore del setto evidenziato dal catetere ICE e l’ablazione prolungata richiesta da entrambi i lati del setto, è stata presa la decisione di ablare con un approccio bipolare per creare una lesione transmurale profonda nella IAS.
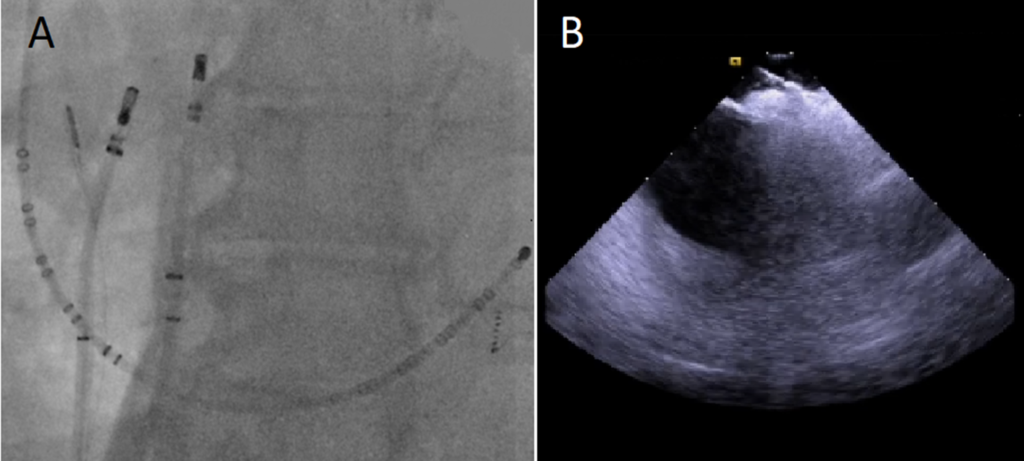
A: Immagine fluoroscopica anteroposteriore che mostra i due cateteri ai due lati dell’IAS durante il rilascio di energia a radiofrequenza bipolare. Uno dei due cateteri SF-J è nell’atrio sinistro, l’altro è nell’atrio destro insieme alla sonda ICE.
B: Immagine ecocardiografica intracardiaca che mostra il catetere SF-J in contatto con il lato destro dell’IAS e l’altro catetere SF-J alla stessa altezza dall’altro lato del setto. In questa immagine si può notare il notevole spessore dell’IAS.
Un ulteriore catetere ablatore Thermocool SF-J è stato posizionato lungo il setto atriale destro, alla stessa altezza del punto di terminazione della tachicardia nel setto atriale sinistro, e l’energia a radiofrequenza è stata erogata dal catetere posizionato nell’atrio sinistro a quello nell’atrio destro. (Figura 3)
L’erogazione di energia bipolare è durata 62s con un aumento progressivo della potenza da 20W a 35W, una temperatura media di 25oC (max 32oC) e un’impedenza media di 142 W (max 171W) e ha portato alla definitiva terminazione della AT.
Dopo un periodo di attesa di 20 minuti, la tachicardia non è stata più osservata.
Durante il follow-up, il paziente è rimasto in ritmo sinusale con sospensione di farmaci antiaritmici.
DISCUSSIONE
La ricorrenza di AT può derivare dalla presenza di substrati aritmogeni atriali residui dopo l’ablazione della AF.1 Le AT da macrorientro settale possono essere relativamente resistenti all’ablazione con catetere e tendono a recidivare durante il follow-up1, a causa della loro posizione intramurale profonda e della difficoltà di ottenere un buon contatto e una buona stabilità del catetere di ablazione sul lato sinistro della IAS.2-3
Nel nostro caso, il focolaio di AT risultava all’interno dell’IAS e sia lo spessore del setto che l’ablazione prolungata necessaria per la terminazione suggerivano una localizzazione intramurale profonda. La difficoltà di ottenere un’ablazione efficace utilizzando un’energia unipolare ha portato alla decisione di optare per un approccio bipolare.
Con la B-RFCA la corrente a radiofrequenza scorre tra gli elettrodi distali di 2 cateteri ablatori situati ai lati opposti del substrato bersaglio, invece di raggiungere l’elettrodo indifferente posto sulla superficie del paziente.
La B-RFCA si è dimostrata molto efficace nel creare lesioni più grandi e nel migliorare la transmuralità delle lesioni4-5, aumentando così le possibilità di successo nell’ablazione di circuiti intramurali profondi, considerando che è stato dimostrato che l’incapacità di creare lesioni transmurali è una causa di fallimento dell’ablazione.6
Il miglioramento della transmuralità della lesione può essere attribuito a diversi meccanismi, come la sinergia termica tra gli elettrodi dei cateteri dovuta al riscaldamento simultaneo, una maggiore densità di corrente che determina una lesione termica concentrata e una maggiore efficacia dell’ablazione.4
CONCLUSIONI
L’ablazione di una tachicardia atriale derivante dal setto può essere difficoltosa a causa della localizzazione intramurale profonda. Questo caso vuole evidenziare la sicurezza e l’efficacia dell’ablazione con radiofrequenza bipolare per interrompere una AT focale settale verificatasi in un paziente con precedenti ablazioni di AF.
BIBLIOGRAFIA
- Chae S, Oral H, Good E, et al. Atrial Tachycardia After Circumferential Pulmonary Vein Ablation of Atrial Fibrillation. J Am Coll Cardiol. 2007;50(18):1781-1787.
- Leonelli F, Bagliani G, Boriani G, Padeletti L. Arrhythmias Originating in the Atria. Card Electrophysiol Clin. 2017;9(3):383-409.
- Heck PM, Rosso R, Kistler PM. The Challenging Face of Focal Atrial Tachycardia in the Post AF Ablation Era. J Cardiovasc Electrophysiol. 2011;22(7):832-838.
- Koruth JS, Dukkipati S, Miller MA, Neuzil P, d’Avila A, Reddy VY. Bipolar irrigated radiofrequency ablation: A therapeutic option for refractory intramural atrial and ventricular tachycardia circuits. Heart Rhythm. 2012;9(12):1932-1941.
- Sivagangabalan G, Barry MA, Huang K, et al. Bipolar Ablation of the Interventricular Septum is More Efficient at Creating a Transmural Line than Sequential Unipolar Ablation. Pacing Clin Electrophysiol. 2010;33(1):16-26.
- Melby SJ, Lee AM, Zierer A, et al. Atrial fibrillation propagates through gaps in ablation lines: Implications for ablative treatment of atrial fibrillation. Heart Rhythm. 2008;5(9):1296-1301.