Non ora, non qui: un caso di dolore toracico da sforzo in giovane atleta
Enrico Incaminato1,2, Stefano Elia1,2, Davide Avenoso1,2, Federica De Vecchi2, Domenico D’Amario1,2, Giuseppe Patti1,2
1Dipartimento di Medicina Traslazionale, Università del Piemonte Orientale, Via Solaroli 17, 28100 Novara, Italy;
2Divisione di Cardiologia, Azienda Ospedaliera Universitaria Maggiore della Carità, Via Mazzini 18, 28100 Novara, Italy.
Abstract
Le anomalie coronariche (CAA) costituiscono un gruppo eterogeneo di varianti anatomiche caratterizzate da anormale origine, decorso o terminazione delle principali arterie coronarie epicardiche. La presentazione clinica è spesso sovrapponibile ad altre condizioni cliniche di interesse cardiologico. Pertanto la gestione diagnostico-terapeutica può risultare complessa, soprattutto nei giovani sportivi, nei quali arriva a rappresentare la seconda causa più comune di morte cardiaca improvvisa (SCD). Vi presentiamo un caso di un giovane paziente che durante una partita di calcio ha lamentato un improvviso dolore toracico ed è giunto alla nostra osservazione in acuto.
Presentazione del caso
Il caso che presentiamo è quello di un giovane paziente di 15 anni che durante una partita di calcio lamentava un improvviso dolore toracico, oppressivo, a seguito del quale veniva trasportato in pronto soccorso (PS). Il dolore variava con gli atti respiratori e si riduceva con l’assunzione della posizione supina e con l’inclinazione anteriore del tronco. L’anamnesi patologica remota e prossima del paziente risultava muta. Il paziente riferiva tuttavia di aver eseguito un test ergometrico (TE) 7 mesi prima, per il rilascio del certificato di idoneità, che non mostrava alterazioni della ripolarizzazione durante lo sforzo o in fase di recupero. I test di laboratorio all’ingresso, rilevavano un andamento di tipo “rise and fall” della troponina (1° rilevazione 252 ng/ml, 2° punto 198 ng/ml, 3° punto 112ng/mL; range di normalità (rn) <57 ng/ml) e della CK-MB (1° punto 7 ng/ml, 2° punto 4.8 ng/ml, valore normale (rn) <5 ng/ml), in assenza di elevazione degli indici di flogosi: VES 8 mm/h (rn 2-15mm/h), PCR 0.15 mg/dl (rn: <1.00). L’elettrocardiogramma (ECG) documentava un sopraslivellamento del tratto ST di circa 1mm in sede infero-laterale interpretato con pattern da ripolarizzazione precoce (ERP). L’ecocardiogramma transtoracico mostrava una normale funzione biventricolare in assenza di anomalie della cinetica regionale e di vizi valvolari di rilievo emodinamico. Era presente, tuttavia, una minima effusione pericardica dello spessore massimo di 2mm, localizzata a livello della parete laterale e apice del ventricolo sinistro, in assenza di segni Doppler di ostacolato riempimento.
Pertanto, alla luce di tali rilevazioni cliniche, della stabilità del quadro emodinamico e imputando il rialzo degli indici di miocardionecrosi all’importante sforzo fisico appena terminato, il paziente veniva dimesso con diagnosi di sospetta miopericardite e posto in terapia con ibuprofene 400mg per tre volte al giorno e indicazione a visita cardiologica di controllo. Dopo due giorni, il paziente accedeva nuovamente in visita urgente per persistenza del dolore da sforzo associato a dispnea. L’ECG mostrava il noto pattern di ERP, associato a fasi di ritmo giunzionale (FC 55-60 bpm). Sebbene la valutazione ecocardiografica fosse sovrapponibile alla precedente, veniva quindi aumentato il dosaggio dell’ibuprofene a 600mg, in associazione a colchicina 0,5mg/die e programmata l’esecuzione di ECG Holter 24h per valutare la turba del ritmo riscontrata. Quest’ultimo dimostrava numerose fasi di dissociazione isoritmica atrioventricolare (AV) e blocco AV di II grado tipo I, con ritmo giunzionale a 50 bpm con QRS stretto (Figura 1A, 1B).
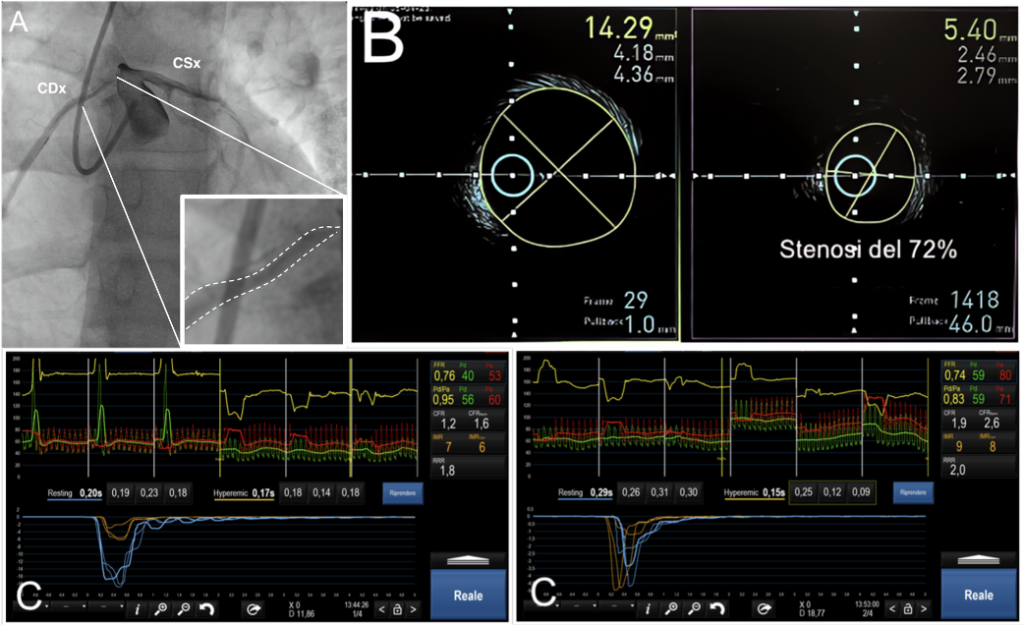
Tali reperti furono imputati in sede di rivalutazione primariamente all’ipertono vagale secondario al condizionamento atletico del paziente. Alla visita di controllo 2 mesi dopo l’evento acuto, il paziente riferiva completa scomparsa del dolore, con riscontro agli esami ematochimici di sierologia compatibile con pregressa infezione da EBV. Nuovamente avvalorata l’ipotesi di episodio miopericarditico, si riduceva terapia antiinfiammatoria e si programmava esecuzione elettiva con risonanza magnetica cardiaca (CMR). La CMR mostrava ventricolo sinistro di normali dimensioni e spessori con conservata cinetica globale e regionale. Le sequenze DIR e TIR in pesature DP e T2 non mostravano alterazioni patologiche. Normali valori del tempo T1 e T2 nelle sezioni indagate. Le sequenze tardive post contrasto non mostravano chiare alterazioni di “enhancement”. Normali valori di ECV venivano riportate nelle sezioni indagate. Veniva documentato un normale rapporto Qp/Qs in assenza di valvulopatie di rilievo. Nelle sequenze di perfusione a riposo appariva non chiaramente distinguibile l’origine dell’arteria coronaria destra (Figura 2A), mentre nelle fasi di perfusione da stress con dobutamina e atropina, si dimostrava un’ipoperfusione prevalentemente sub-endocardica a livello infero-settale medio-basale e inferiore basale. Sulla base di tali riscontri, al paziente veniva interdetta l’esecuzione di ogni attività fisica e posta indicazione ad una tomografia computerizzata coronarica (CCTA). Quest’ultima, confermava la diagnosi di origine anomala dell’arteria coronaria destra (AAORCA) dal seno di Valsalva sinistro, in prossimità della giunzione seno-tubulare (Figura 2B), con ostio tipo “slit-like“, tragitto intramurale e decorso inter-arterioso maligno (tra aorta e arteria polmonare), in circolazione a dominanza destra. Il paziente veniva quindi ricoverato per eseguire coronarografia associata ad imaging intra-coronarico e valutazione della riserva coronarica a riposo e sotto stress farmacologico. L’angiografia coronarica confermava la presenza di una coronaria destra anomala ad origine dal seno coronarico sinistro, con decorso inter-arterioso e anatomia dell’ostio assottigliato “a becco di flauto” (Figura 3A). Per studiare accuratamente la morfologia del vaso, si eseguiva una ecografia intravascolare (IVUS) che mostrava un’area luminare minima (MLA) al tratto medio di 14,3 mm2 ed una riduzione del calibro al tratto ostiale con riduzione del calibro pari al 72% (MLA 5.4 mm2) corrispondente al tratto intramurale (Figura 3B). Veniva eseguita una valutazione funzionale con guida di pressione a riposo e dopo stimolo farmacologico con infusione endovenosa di dobutamina (5γ/Kg/min) (Figura 3C).
Al basale (FC 90 b.p.m), il rapporto Pd/Pa era di 0.95 (rn ≥ 0.92), mentre dopo 5 minuti dall’infusione di dobutamina (FC 130 b.p.m) era di 0.83. Similarmente, l’FFR di base era di 0.76 (rn >0.8), mentre dopo infusione di dobutamina era di 0.74 e coerentemente si associava ad una riduzione della riserva coronarica a riposo e sotto stimolo (CRF 1,2 e 1,9 rispettivamente – rn>2) in assenza di aumentati indici di resistenza microvascolare (IMR 9 e 7 rispettivamente – rn >25 mmHg·s).
Sulla base di queste valutazioni multidimensionali che risultavano coerenti e dimostravano un impatto emodinamico della anomalia coronarica, il paziente veniva riferito ad un centro cardiochirurgico specializzato per correzione del difetto mediante “unroofing” e confezionamento di un neo-ostio della coronaria destra dal seno di Valsalva destro. L’operazione si svolgeva senza complicanze e il monitoraggio ECG prolungato nel post-operatorio non rivelava alcune aritmie maggiori. Al follow-up, veniva eseguito il test cardiopolmonare, che dimostrava una normale capacità funzionale durante l’esercizio massimale. La CMR di follow-up a 6 mesi mostrava l’assenza di alterazioni della cinesi segmentaria e la scomparsa dei difetti di perfusione da stress (Figura 2D). A circa un anno di distanza dalla diagnosi e con tali evidenze a disposizione, il paziente si è quindi sottoposto a nuova rivalutazione medico-sportiva, che ha consentito la ripresa della attività fisica.
Discussione
Le CAA sono delle anomalie congenite che coinvolgono l’origine, il decorso e la terminazione delle arterie coronarie1. Nel tempo sono state proposte diverse classificazioni anatomiche, con l’obiettivo di elencare tutti i sottotipi di decorsi anomali delle coronarie epicardiche.2 La più nota è quella proveniente dal Texas Children’s Hospital, che descrive e classifica sistematicamente il vaso affetto, utilizzando la CCTA con angioscopia virtuale. L’anomalia più comune è l’origine anomala da un seno di Valsalva non corretto, più frequentemente l’origine della coronaria destra dal seno di Valsalva sinistro (presente in circa lo 0.25% della popolazione)3, come nel caso presentato. Il decorso inter-arterioso (tra l’aorta e l’arteria polmonare) che ne deriva, viene definito “variante maligna”, perché l’effetto di compressione “scissor-like” che compare durante lo sforzo, predispone il paziente allo sviluppo di ischemia miocardica acuta e/o cronica e di SCD, soprattutto negli atleti4. L’ostio “slit-like/a fessura“, un angolo di attacco aorta-coronaria molto acuto, un’origine dislocata superiormente ai seni di Valsalva e un decorso intramurale, costituiscono altri fattori prognosticamente negativi. Inoltre, lo stress meccanico sisto-diastolico è un fattore determinante per lo sviluppo di disfunzione endoteliale e quindi di vasospasmo5. L’ecocardiografia con eventuale campionamento del flusso coronarico rappresenta la metodica di prima linea per la identificazione delle CAA, in particolare nei pazienti pediatrici, in virtù anche delle loro finestre acustiche spesso ottimali. La CCTA è tuttavia da considerare come il gold standard nella pratica clinica attuale per la sua elevata accuratezza diagnostica. La CMR sta emergendo come una metodica utile in quanto capace di integrare sequenze di perfusione, della analisi tissutale e valutazione anche di fibrosi e volume della matrice extracellulare6 a riposo e sotto stress farmacologico. Ad oggi, pertanto, la valutazione non può che essere eseguita con più metodologie di imaging e con un approccio multidimensionale e multidisciplinare per garantire al malato il miglior percorso diagnostico e terapeutico.
La sola presenza di CCA, infatti, non giustifica però la riparazione chirurgica in tutti i pazienti. Le linee guida ESC 2020 per la gestione delle cardiopatie congenite nell’adulto4 propongono l’intervento chirurgico quando l’anomalia della coronaria presenti un’anatomia ad alto rischio e si associ ad angina tipica ed evidenza di ischemia miocardica indotta da stress. A tal proposito, è importante ricordare che studi recenti7,8 disincentivano la ricerca di ischemia miocardica inducibile affidandosi al solo TE nelle CAA, soprattutto nelle AAORCA. Infatti, la sensibilità del test ergometrico in questi pazienti è molto bassa con una percentuale di positività di appena l’1.2%. Le medesime raccomandazioni si ritrovano nei “Protocolli cardiologici per il giudizio di idoneità allo sport agonistico (COCIS) 2023”, che aggiungono inoltre l’assoluto divieto allo svolgimento di attività sportiva nei casi di CAA con caratteristiche ad alto rischio come quello preso in esame, sia che sia coinvolta la coronaria di destra che quella di sinistra. È fondamentale, dunque, avviare un percorso diagnostico completo nei pazienti portatori di queste anomalie, possibilmente presso Centri con elevata competenza specifica. A causa della bassa prevalenza nella popolazione generale, sono necessari ulteriori sforzi per comprendere meglio la fisiopatologia di queste entità. Nel caso clinico presentato, emerge l’importanza di un puntuale work-up diagnostico, che selezioni correttamente e nei tempi giusti i pazienti da portare all’intervento chirurgico, al fine di impattare radicalmente sulla prognosi, soprattutto nei casi asintomatici o con presentazione insidiosa.
Bibliografia
- Gentile F, Castiglione V, De Caterina R. Coronary Artery Anomalies. Circulation. 2021 Sep 21;144(12):983-996.
- Agrawal H, Mery CM, Krishnamurthy R, Molossi S. Anatomic types of anomalous aortic origin of a coronary artery: A pictorial summary. Congenit Heart Dis. 2017 Sep;12(5):603-606.
- Cheezum MK, Liberthson RR, Shah NR, Villines TC, O’Gara PT, Landzberg MJ, Blankstein R. Anomalous Aortic Origin of a Coronary Artery From the Inappropriate Sinus of Valsalva. J Am Coll Cardiol. 2017 Mar 28;69(12):1592-1608.
- Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, Lung B, Kluin J, Lang IM, Meijboom F, Moons P, Mulder BJM, Oechslin E, Roos-Hesselink JW, Schwerzmann M, Sondergaard L, Zeppenfeld K; ESC Scientific Document Group. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021 Feb 11;42(6):563-645.
- Nagashima K, Hiro T, Fukamachi D, Okumura Y, Watanabe I, Hirayama A, et al. Anomalous origin of the coronary artery coursing between the great vessels presenting with a cardiovascular event (J-CONOMALY Registry). Eur Heart J Cardiovasc Imaging. 2020 Feb 1;21(2):222-230.
- Tessitore A, Caiffa T, Bobbo M, D’Agata Mottolese B, Barbi E, Chicco D. Anomalous aortic origin of coronary artery: For a challenging diagnosis, a transthoracic echocardiogram is recommended. Acta Paediatr. 2022 Feb;111(2):265-268.
- Qasim A, Doan TT, Dan Pham T, Reaves-O’Neal D, Sachdeva S, Mery CM, Binsalamah Z, Molossi S. Is Exercise Stress Testing Useful for Risk Stratification in Anomalous Aortic Origin of a Coronary Artery? Semin Thorac Cardiovasc Surg. 2023 Winter;35(4):759-768. doi: 10.1053/j.semtcvs.2022.08.009. Epub 2022 Aug 28. PMID: 36041683.
- Doan TT, Sachdeva S, Bonilla-Ramirez C, Reaves-O’Neal DL, Masand P, Mery CM, Binsalamah Z, Heinle JH, Molossi S. Ischemia in Anomalous Aortic Origin of a Right Coronary Artery: Large Pediatric Cohort Medium-Term Outcomes. Circ Cardiovasc Interv. 2023 Apr;16(4):e012631. doi: 10.1161/CIRCINTERVENTIONS.122.012631. Epub 2023 Apr 18. PMID: 37071720.
FIGURE
Figura 1:
L’ECG secondo Holter ha mostrato la presenza di dissociazione isoritmica e ritmo giunzionale (A), in linea con l’elevato tono parasimpatico derivante dalla preparazione atletica del giovane paziente. Inoltre, si evidenziavano fasi di blocco atrio-ventricolare di 2°grado di tipo I (B).
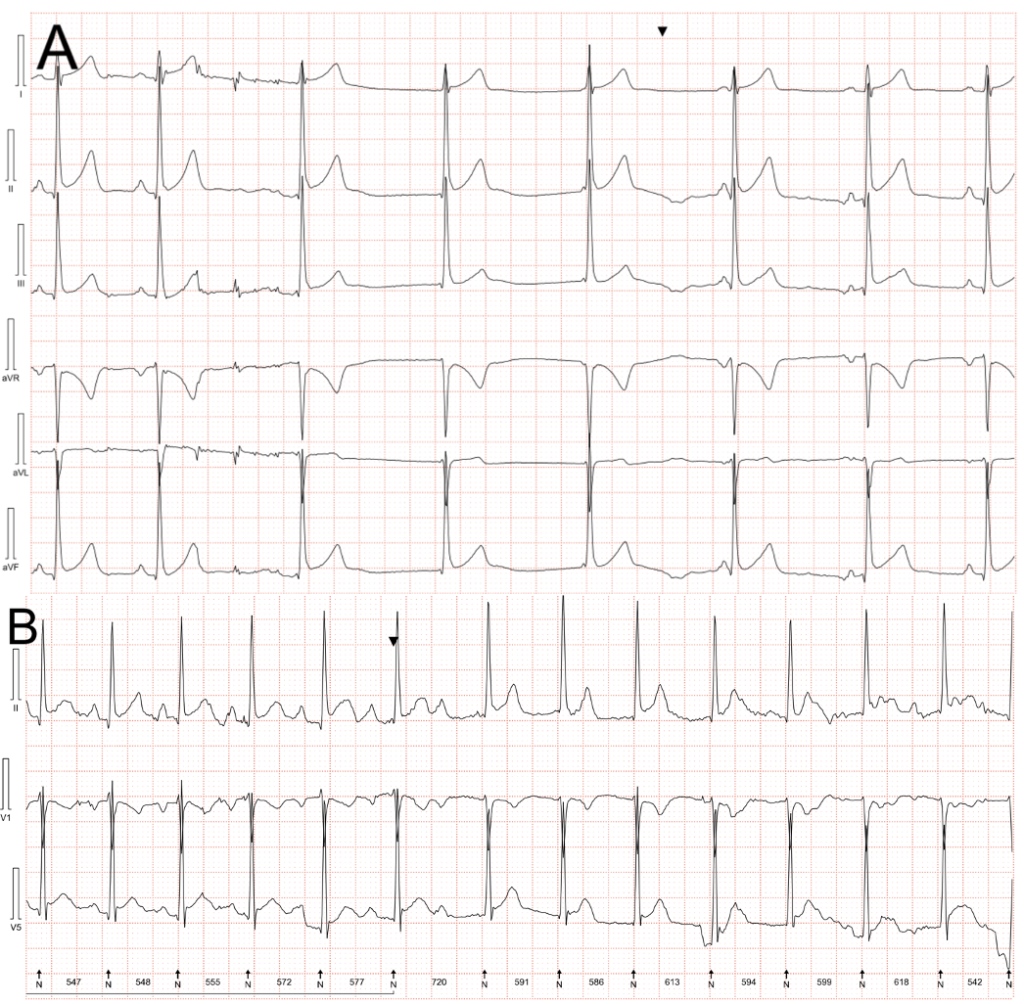
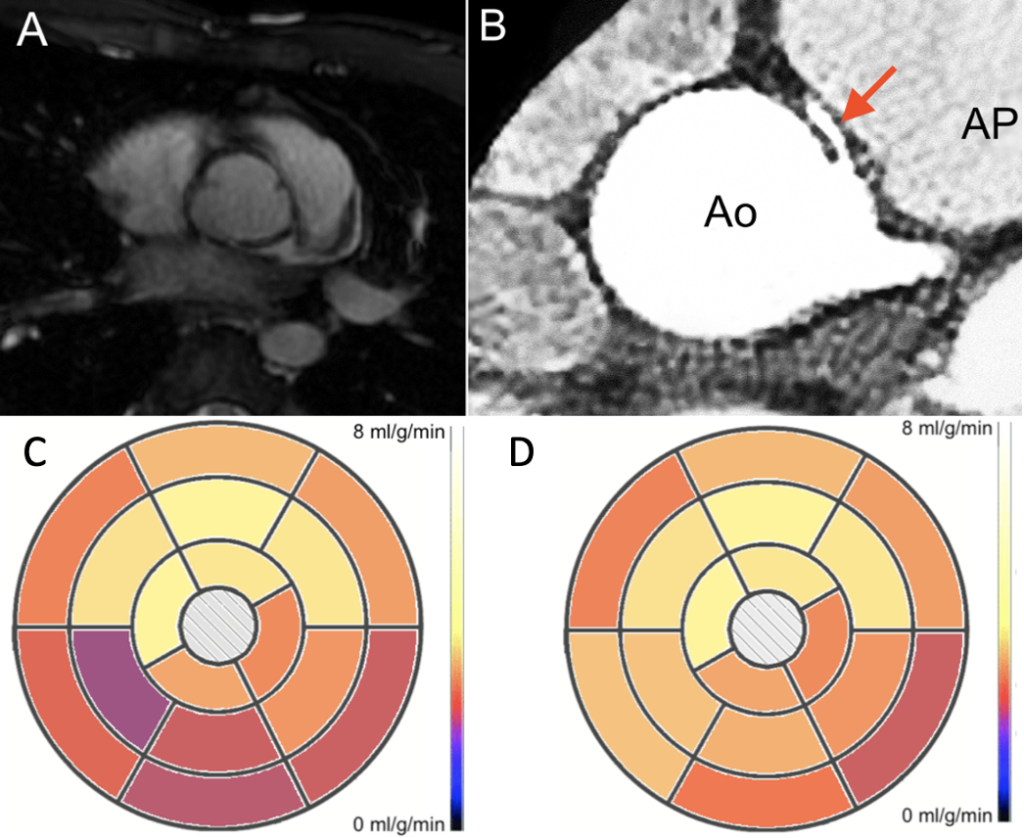
Figura 2
A: Alla prima CMR non era chiaramente visibile l’origine della coronaria destra.
B: Alla CCTA si evidenziava l’origine della coronaria destra dal seno coronarico sinistro, con decorso inter-arterioso maligno.
C,D: “Bullseye plot” del mapping di perfusione alla RMC da stress pre (C) e post (D) “unroofing” chirurgico della coronaria destra.
Figura 3:
A: L’angiografia coronarica mostrava origine della coronaria destra dal seno di Valsalva sinistro con un ostio a “a becco di flauto“.
B: L’ecografia intravascolare (IVUS) della coronaria destra ha rivelato un’area minima luminare nel tratto medio di 14.3 mm2 ed una stenosi emodinamicamente significativa (72%) a livello del tratto prossimale intramurale con MLA di 5,4 mm2.
C: Valutazioni funzionali con guida di pressione sulla coronaria destra, misurate prima (sinistra) e dopo (destra) la somministrazione di dobutamina.

Related Posts