Un caso di miocardite trombofilica: come destreggiarsi tra diagnosi e terapia
Navacchi Rebecca, Signoretta Gianluca, Grassi Francesca, Paoli Giorgia, Notarangelo Maria Francesca
1 Unità operativa di Cardiologia, Dipartimento cardio-toraco-vascolare, Azienda Ospedaliera Universitaria di Parma, Parma
ABSTRACT
Diversi sono ancora i punti insoluti in ambito di miocardite e variano dall’eziopatogenesi agli strumenti diagnostici fino alle strategie terapeutiche. Le infezioni virali ne sono generalmente la causa principale, ma sono state descritte anche forme su base autoimmune o tossica.
La risonanza magnetica nucleare (RMN) costituisce sicuramente l’esame diagnostico fondamentale, sufficiente di solito ad un corretto inquadramento clinico. In una minoranza di casi però essa non basta e occorre ricorrere a una procedura invasiva come la biopsia endomiocardica per giungere a una diagnosi definitiva e di conseguenza alla migliore terapia possibile.
Presentiamo il caso di un giovane paziente con un quadro di miocardite subacuta condizionante una severa disfunzione ventricolare, presentatasi clinicamente in associazione a trombosi cardiaca e a multiple embolizzazioni polmonari, risultata responsiva esclusivamente a terapia immunosoppressiva.
INTRODUZIONE
La miocardite riconosce diversi possibili meccanismi eziopatogenetici (infettivi, autoimmuni, farmacologici, reazioni da ipersensibilità, disordini sistemici, altre forme rare), ma predominano indubbiamente le infezioni virali, il più delle volte clinicamente misconosciute [1].
Una variante meno comune è la miocardite eosinofila. Questo sottotipo, che rimane ampiamente sottodiagnosticato probabilmente anche in relazione allo scarso impiego della biopsia endomiocardica, si riscontra maggiormente nei pazienti affetti da mielodisplasia, tumori solidi o parassitosi. L’infiltrato eosinofilico può mediare direttamente il danno cellulare, ma si verifica anche un’iperattivazione del sistema immunitario e della cascata della coagulazione, con esponenziale aumento del rischio trombotico. [1].
Nel complesso gli esperti concordano infine nel considerare due possibili scenari clinici d’esordio:
- Miocardite acuta (entro 30 giorni dall’insorgenza): senza dilatazione o disfunzione ventricolare sinistra, ma con un esordio clinico improvviso, talvolta necessitante di supporto emodinamico. E’ caratterizzata istologicamente da abbondante infiltrato infiammatorio.
- Cardiomiopatia infiammatoria cronica (> 30 giorni): contraddistinta da grave disfunzione ventricolare e da una sintomatologia clinica da scompenso cardiaco. Si caratterizza dal punto di vista istologico per la relativa scarsità dell’infiltrato infiammatorio [1].
CASO CLINICO
Presentiamo il caso di un ragazzo di 27 anni originario della Costa d’Avorio, in Italia da circa 4/5 anni, con anamnesi patologica e familiare muta per patologie di rilievo.
Nell’ambito di una visita cardiologica effettuata in previsione di un intervento urologico venivano riscontrate all’elettrocardiogramma (ECG) alterazioni della ripolarizzazione di tipo sovraccarico-ischemico. Il paziente inoltre riferiva dispnea da sforzo da circa un mese con associata tosse secca scarsamente responsiva alla terapia antibiotica impostata in precedenza dal Curante. L’iter diagnostico ambulatoriale proseguiva pertanto con esecuzione di ecocardiogramma che evidenziava un ventricolo sinistro severamente dilatato e globoso, con grave disfunzione sistolica (FEVSn 20%) ed aumentate pressioni polmonari stimate. Gli ECG successivi mostravano un’evoluzione con sviluppo di onde T negative nelle derivazioni precordiali. Il dosaggio delle troponine risultava significativamente aumentato (TnI Hs 8750 ng/dl). Alla luce del quadro di scompenso cardiaco in severa cardiopatia ipocinetica-dilatativa di nuovo riscontro il paziente veniva centralizzato presso il nostro centro per il proseguimento del dépistage diagnostico.
All’ingresso in reparto il paziente si presentava profusamente astenico, con dispnea da minimi sforzi (Classe NYHA III-IV), epigastralgia sfumata pressochè costante, disfagia e tosse secca esacerbata al momento dei pasti. Agli esami di laboratorio all’ingresso si riscontrava: TnI Hs 4800 ng/l, BNP 1188 pg/ml e PCR 4,9 mg/dl.
Una volta ottimizzato il quadro emodinamico si è proceduto a titolare la terapia anti-scompenso.
Nei giorni seguenti sono state effettuate ulteriori indagini, quali:
- Esami ematochimici di secondo livello, con pannelli infettivologici, di autoimmunità e trombofilia, risultati tutti sostanzialmente negativi ma con rialzo marcato delle IgE (2110 IU/mL, 5 volte la norma)
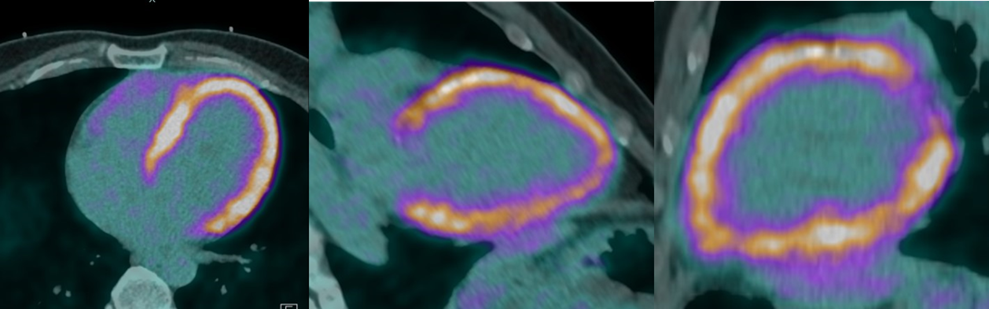
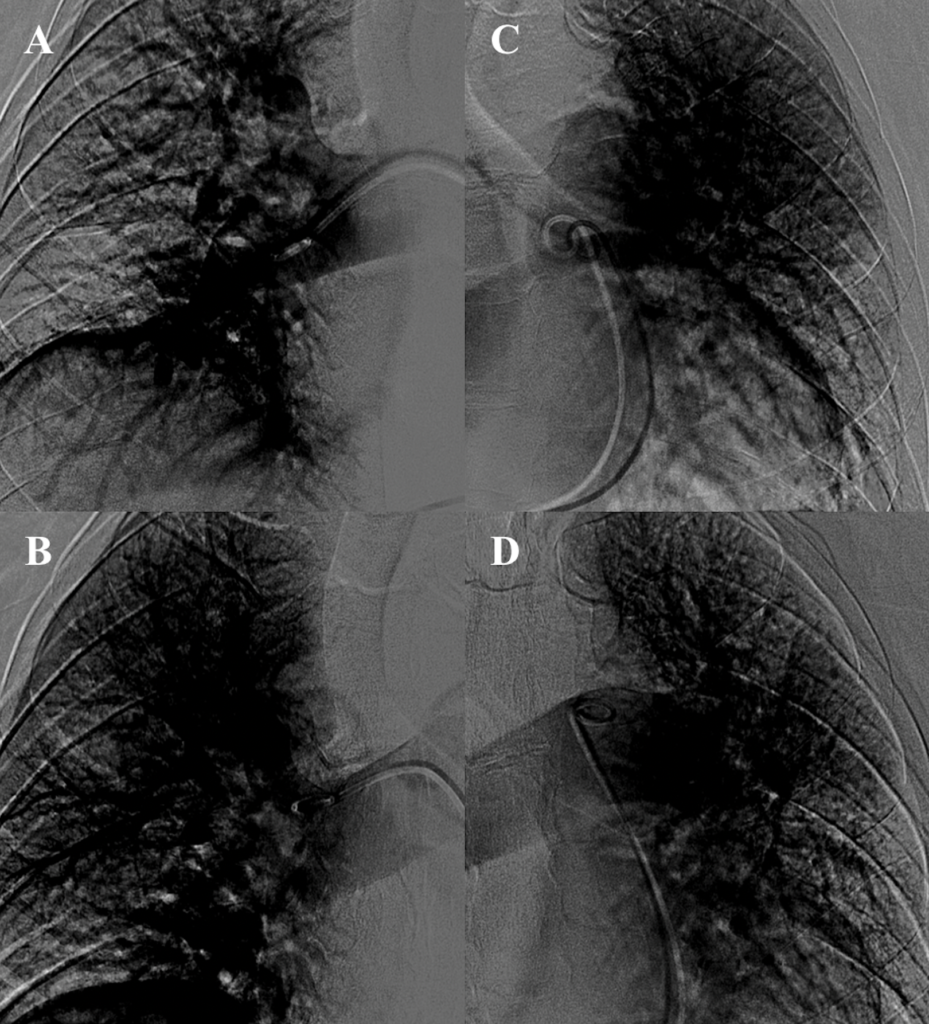
- TC torace e coronaro-TC che escludevano coronaropatie ma rilevavano un quadro di TEP con una piccola consolidazione a livello del parenchima basale-posteriore destro, con cercine a densità ground-glass, compatibile con infarto polmonare. Venivano segnalate inoltre trombosi intracavitarie in auricola destra e a livello apicale del ventricolo sinistro (immagine 1).Si avviava pertanto terapia anticoagulante con eparina a basso peso molecolare (EBPM).
- RM cuore, che confermava una severa dilatazione ed ipocinesia biventricolare (FEVSn 21% e FEVDx 31%) evidenziando positività al LGE oltre che alle sequenze T2 pesate con edema a carico della parete antero-laterale, a distribuzione subepicardica, compatibile con miocardite.
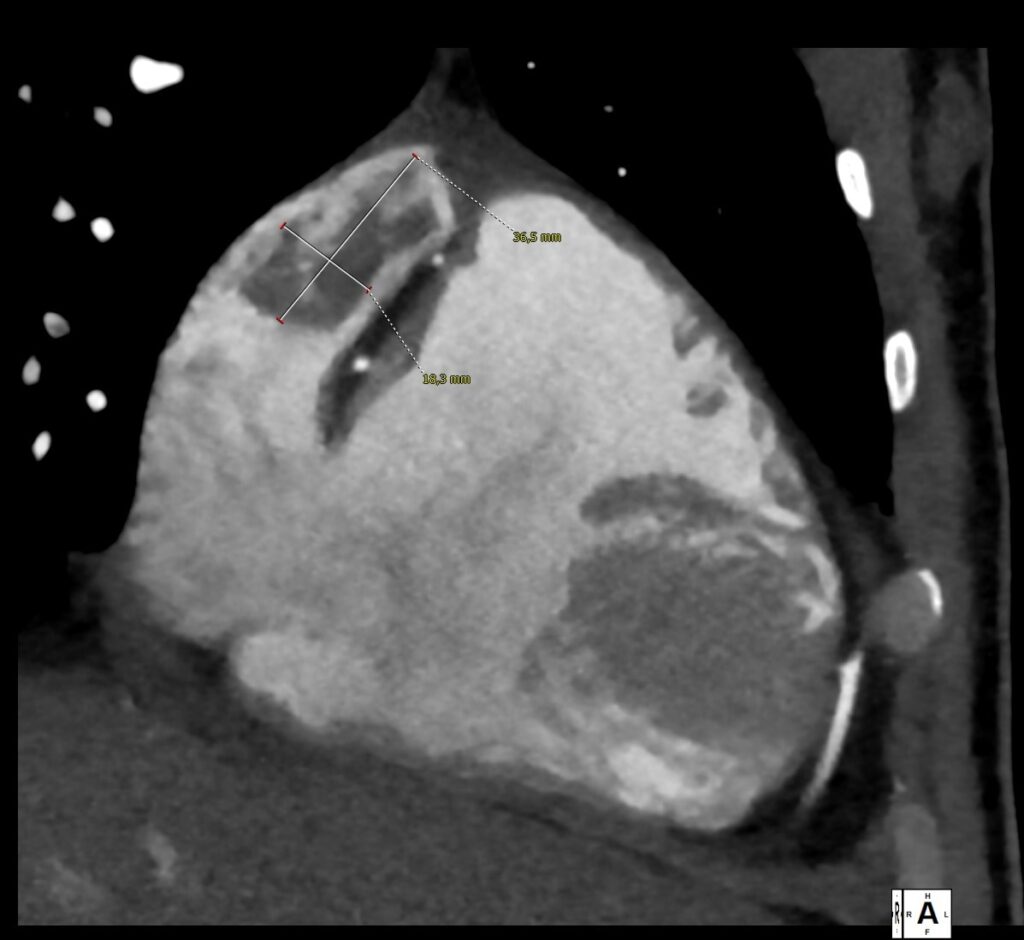
Sebbene in tale contesto la biopsia cardiaca sarebbe risultata di estrema utilità, la presenza di multiple formazioni trombotiche ha rappresentato in questa fase una controindicazione assoluta a qualunque procedura invasiva.
Ci siamo pertanto interrogati sulle varie possibili alternative diagnostiche: data la negatività degli esami microbiologici ma alla luce della spiccata tendenza alla trombosi e all’aumentato valore di IgE, pur in presenza di una normale conta eosinofilica, il nostro primo sospetto è stata la miocardite eosinofila.
Dopo una progressiva normalizzazione degli indici di flogosi e in assenza di elementi clinici suggestivi di infezione, si è avviata una terapia corticosteroidea a dosaggio immunosoppressivo, con metilprednisolone come da protocollo: 1gr per 3 giorni, 70 gr per 7 giorni, 50 gr per 6 giorni, 45 gr per 4 giorni e in seguito a scalare 5 gr ogni 4 giorni fino a sospensione [2].
Nel sospetto di esofagite eosinofila che potesse giustificare il quadro di disfagia e contemporaneamente confermare il nostro sospetto di miocardite eosinofila, è stata inoltre eseguita un’EGDS con biopsia, risultata però negativa per la presenza di inclusi eosinofili.
In corso di ricovero si è osservato un episodio di dolore toracico urente con tosse incessante, associato a un aumento degli indici di flogosi (PCR fino a 141 mg/dl) e significativo rialzo troponinico (TnI Hs 17655 ng/dl). Alla TC torace eseguita in urgenza si è evidenziato l’espansione dell’area di consolidamento polmonare e la formazione di una nuova trombosi a livello della parete inferiore ventricolare sinistra, con regressione delle trombosi precedentemente evidenziate.
Si proseguiva pertanto la terapia anticoagulante embricando Coumadin con EBPM. fino a raggiungimento del target INR 2-3.
Una volta ottenuta la regressione completa della trombosi endoventricolare si è potuto eseguire una biopsia endomiocardica, avvenuta a livello del setto interventricolare destro. Sul campione bioptico è stato identificato il Parvovirus B19, con aree di fibrosi perivascolare in assenza di florido infiltrato infiammatorio.
Tale dato purtroppo non è risultato clinicamente diagnostico: la presenza di Parvovirus alla biopsia infatti non è significativa se non è associata alla positività della sierologia e ad un infiltrato infiammatorio alla biopsia, visto che la presenza di tale virus è stata descritta in casi di miocardite in cui però non ha alcun ruolo causale [3].
Non ci è stato possibile escludere che il mancato isolamento nel siero del virus e l’assenza di infiltrazione infiammatoria siano in realtà dei falsi negativi, dovuti alla terapia immunosoppressiva intrapresa: quest’ultima però si era d’altro canto resa necessaria alla luce della scarsa risposta del paziente alla terapia convenzionale.
Durante la successiva degenza, dopo circa tre mesi di terapia antirimodellamento, il paziente ha eseguito una RMN cuore di rivalutazione, con evidenza di mancato recupero della contrattilità sinistra (FEVSn 27%) con un discreto miglioramento della contrattilità destra (FEVDx 45%). All’LGE veniva descritta nuova area di edema con lesione a livello subepicardio/transmurale a carico della parete inferiore medio-basale sinistra. Permaneva invariato il focolaio di edema e LGE della parete antero-laterale (immagine 2).
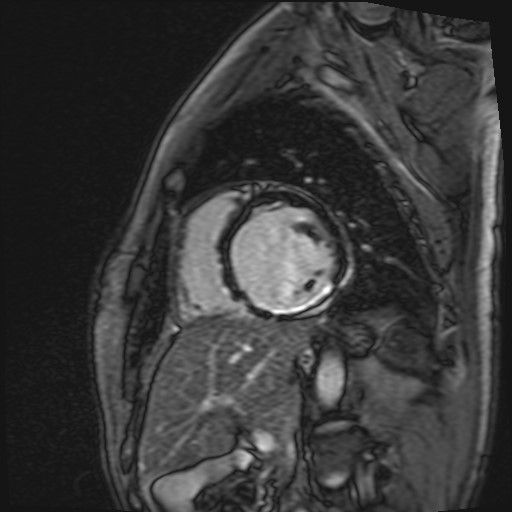
Si procedeva pertanto a impianto di ICD in prevenzione primaria, anche alla luce delle frequenti TVNS scarsamente responsive al betabloccante evidenziate al monitoraggio telemetrico.
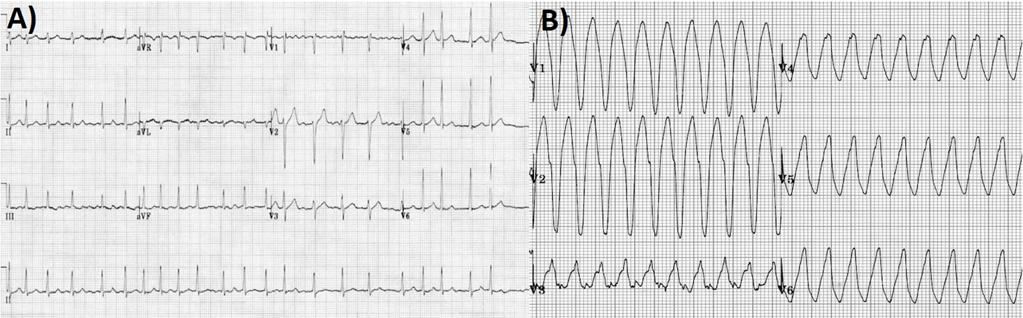
In considerazione della stabilità clinica il paziente veniva trasferito presso altra struttura per un breve ciclo riabilitativo. Si rendeva necessaria però dopo qualche settimana nuova centralizzazione per scarica del device su FV (immagine 3), verosimilmente innescata da una subottimale titolazione della terapia antiaritmica.
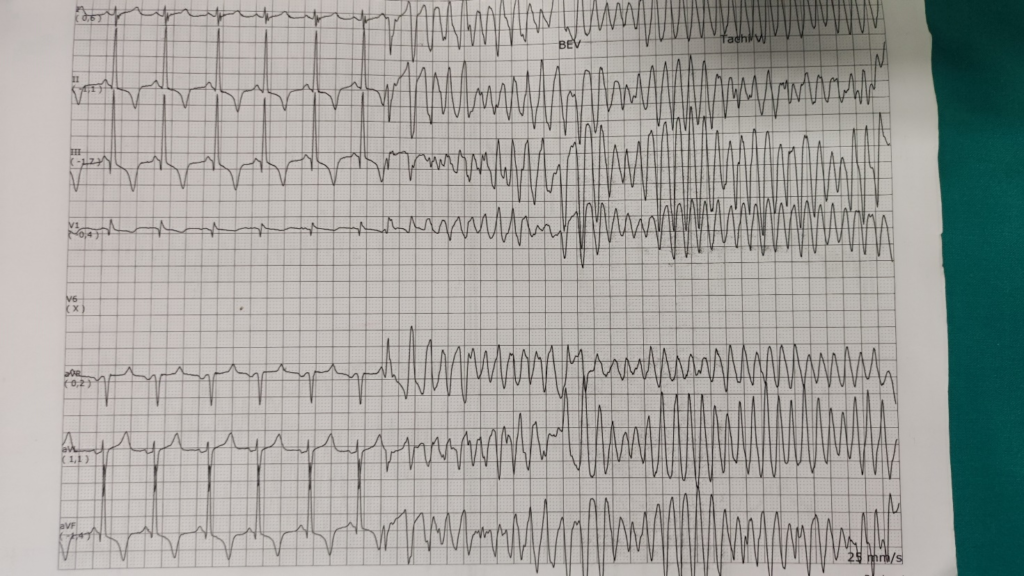
Previa stabilizzazione clinica il paziente veniva dimesso con la seguente prescrizione terapeutica: ARNI a basso dosaggio, SGLT2i, MRA, betabloccante a basso dosaggio, AVK e amiodarone.
Attualmente il paziente è in follow up presso il centro di III livello di Bologna per esecuzione di ulteriori accertamenti, inclusi screening trapiantologico e studi genetici per cardiomiopatie (ancora in corso). E’ stata inoltre eseguita una nuova biopsia endomiocardica, risultata anch’essa negativa per miocardite attiva e con lieve/moderata fibrosi interstiziale.
DISCUSSIONE
Una diffusa trombosi può essere riscontrata in corso di miocardite, più tipicamente nel caso della miocardite eosinofila, ma anche in caso di infezione mediata da Parvovirus B19 [4, 5, 6]. Per quanto riguarda la gestione farmacologica della complicanza trombotica, iniziano a comparire studi sul ruolo della terapia anticoagulante nelle miocarditi eosinofile, oltre che proposte di protocolli immunosoppressivi [2, 4, 5]. Per quanto riguarda la diagnostica invece, per questo sottotipo di patologia, in letteratura sono stati riportati casi in cui la miocardite eosinofila può presentarsi senza eosinofilia periferica, mentre il quadro istologico caratteristico è di infiltrato eosinofilo con presenza di cellule giganti multinucleate [7]. Importante resta la diagnosi differenziale con le altre varianti, tra cui quella descritta nel nostro caso; in corso di miocardite da Parvovirus B19 infatti l’infiammazione tende piuttosto a concentrarsi in sede perivascolare [3].
Questo caso clinico ci ha posto davanti a un bivio: da un lato avevamo una condizione clinica precaria, con episodi recidivanti di embolia polmonare e il contemporaneo rischio di embolizzazione sistemica massiva, e la necessità di ricorrere a una terapia immunosoppressiva ad alti dosaggi; dall’altro vi era la consapevolezza che quest’ultima avrebbe però potuto influenzare negativamente ulteriori importanti accertamenti, tra cui la biopsia endomiocardica, che non si sarebbe potuta comunque eseguire senza risoluzione del quadro trombotico.
Alla fine ha prevalso la necessità di curare al meglio nell’immediato il paziente, anche a costo di rinunciare ad arrivare a una diagnosi definitiva.
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405. Epub 2020 Nov 12. PMID: 33176455; PMCID: PMC7673642.
- Frustaci A, Chimenti C. Immunosuppressive therapy in myocarditis. Circ J. 2015;79(1):4-7. doi: 10.1253/circj.CJ-14-1192. Epub 2014 Dec 2. PMID: 25452202.
- Gun E, Bugra A. Eosinophilic myocarditis from a forensic histopathological perspective. J Forensic Sci. 2023 Mar;68(2):500-508. doi: 10.1111/1556-4029.15197. Epub 2023 Jan 12. PMID: 36633063.
- Pagura L, Imazio M, Merlo M, Sinagra G. Dieci quesiti in tema di miocardite eosinofila [Ten questions about eosinophilic myocarditis]. G Ital Cardiol (Rome). 2022 Apr;23(4):259-267. Italian. doi: 10.1714/3766.37535. PMID: 35343477.
- Bondue A, Carpentier C, Roufosse F. Hypereosinophilic syndrome: considerations for the cardiologist. Heart. 2022 Feb;108(3):164-171. doi: 10.1136/heartjnl-2020-317202. Epub 2021 Jun 25. PMID: 34172539.
- Whitehead NJ, Murch S, Leitch JW, Hackworthy RA. Acute myocarditis with thrombus near left ventricular outflow tract. Echocardiography. 2018 Apr;35(4):575-577. doi: 10.1111/echo.13840. Epub 2018 Feb 19. PMID: 29457263.
- Sugiyama E, Takenaka T, Kato M, Minoshima A, Muto H, Fujita M, Sato M, Inoue H, Nakamura H, Hasebe N. Eosinophilic myocarditis without hypereosinophilia accompanied by giant cell infiltration. J Cardiol Cases. 2015 Aug 4;12(5):169-171. doi: 10.1016/j.jccase.2015.07.004. PMID: 30546587; PMCID: PMC6281835.
Cardiotossicità da immune checkpoint inhibitors: non solo miocardite.
Daniela Di Lisi1,2, Francesca Castro2, Domenico Scelfo2, Luca Ganci2, Vincenzo Sucato1,2, Egle Corrado1,2, Giuseppina Novo1,2, Alfredo Ruggero Galassi1,2
1 Dipartimento di Cardiologia, Ospedale Universitario Paolo Giaccone, Palermo
2 Dipartimento ProMISE, Università di Palermo
ABSTRACT
Gli inibitori dei checkpoint immunitari (ICI) possono provocare effetti tossici cardiovascolari: miocardite, pericardite, vasculite, aterosclerosi accelerata, aritmie, ictus, blocchi atrio-ventricolare. La miocardite rappresenta la complicanza più frequente e temibile e, talora, può associarsi a sintomi neurologici e miosite. La diagnosi e il trattamento delle tossicità da ICI non sempre sono facili. Una diagnosi precoce e un trattamento tempestivo sono dunque essenziali per prevenire lo sviluppo di complicanze cardiovascolari severe. Descriviamo il caso di una paziente di 76 anni trattata con Pembrolizumab/Nivolumab, complicata dallo sviluppo di miocardite associata a miosite/miastenia.
INTRODUZIONE
La miocardite correlata alla terapia con inibitori dei checkpoint immunitari (ICI) è un evento avverso immuno-correlato poco comune (incidenza 0.04-1.14%), ma gravato da un alto tasso di mortalità (25-50%). Sia l’incidenza che la mortalità raddoppiano nel caso di terapia di combinazione con ICI (1). Frequentemente, la miocardite si associa a forme di miastenia-gravis e miosite. Lo spettro clinico di presentazione è assai variabile, da forme lievi con sole alterazioni ECG e laboratoristiche, a forme severe con scompenso cardiaco e danno d’organo, fino a forme fulminanti, con un quadro di instabilità emodinamica e/o aritmie fatali (1).
Descriviamo dunque il caso di una forma severa di miocardite ICI-correlata associata a miastenia gravis/miosite, paradigma di quanto la diagnosi e il trattamento di queste forme rappresenti una sfida per il cardiologo clinico.
CASO CLINICO
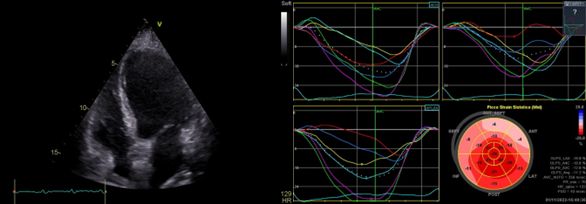
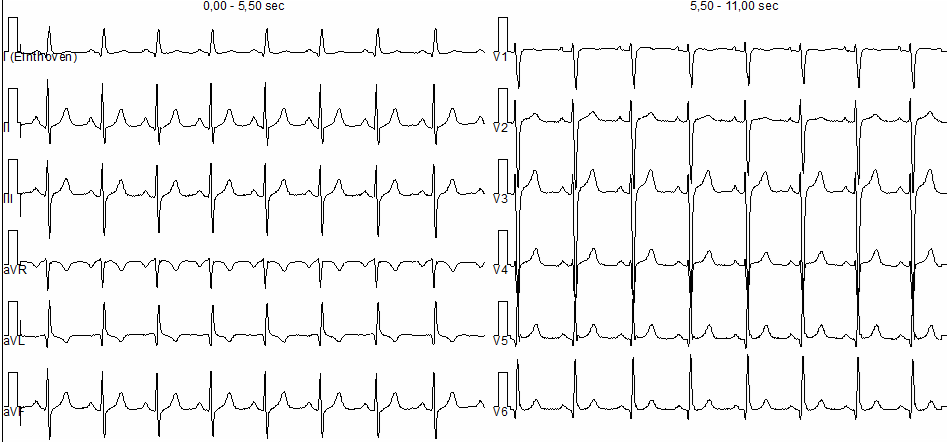
Una donna di 76 anni affetta da melanoma ulcerato al I dito del piede sinistro metastatico è stata ricoverata presso la nostra U.O di Cardiologia, a seguito dell’insorgenza di severa astenia, dispnea, edemi declivi e periorbitario con ptosi palpebrale bilaterale venti giorni dopo la somministrazione del primo ciclo di Pembrolizumab-Nivolumab. All’ECG si documentava fibrillazione atriale, emiblocco posteriore sinistro e blocco di branca destra (Figura 1). Agli esami ematochimici: aumento significativo degli indici di citolisi epatica, LDH, CPK, Troponina T ad alta sensibilità, mioglobina ed NT-proBNP. All’ecocardiogramma color-Doppler: ventricolo sinistro di dimensioni endocavitarie ai limiti superiori di norma, ipocinesia della parete inferiore basale e media; funzione sistolica ventricolare sinistra lievemente ridotta (FE biplana 44%); riduzione degli indici di deformazione miocardica del ventricolo sinistro (GLS -17,2% con picco sistolico di strain maggiormente ridotto a livello dei segmenti inferiori) (Figura 2). Al monitoraggio ECG-grafico si osservavano episodi di tachicardia ventricolare non sostenuta. La paziente lamentava inoltre diffuse algie muscolari per cui veniva eseguito dosaggio degli anticorpi anti-AchR e anti-Musk, risultati negativi. Nel sospetto clinico-strumentale di miocardite e miosite periferica da ICI, la paziente veniva trattata con metilprednisolone ad alte dosi (1000 mg/die) con scarso beneficio. Infatti, durante la degenza si assisteva a progressivo deterioramento delle condizioni cliniche (ipotensione, oligo-anuria, insufficienza respiratoria) con conseguente necessità di supporto inotropo e ,ventilazione non invasiva. Il quadro di instabilità emodinamica non consentiva, pertanto, il ricorso a test diagnostici di conferma, quali la risonanza magnetica cardiaca, e rendeva necessario il trasferimento in terapia intensiva, dove veniva eseguita terapia immunosoppressiva di II linea in associazione a plasmaferesi. Tuttavia, la paziente andava incontro ad exitus.
DISCUSSIONE
La miocardite ICI-correlata insorge frequentemente nelle prime 12 settimane dalla somministrazione del farmaco. Il sospetto iniziale è basato sulla valutazione dei sintomi (dispnea, astenia, dolore toracico), sull’incremento dei valori di troponina e sulla comparsa di alterazioni ECG (per es. sotto-slivellamento del segmento ST, inversione diffusa delle onde T, frequenti extrasistoli e aritmie ventricolari, disturbi di conduzione di nuova insorgenza, etc.), ecocardiografiche (riduzione della frazione d’eiezione e anomalie della cinesi segmentaria) e presenza alla risonanza magnetica cuore dei criteri di Lake Louise modificati. (1) (2) (3) Spesso tale forma di miocardite si associa a concomitante presenza di miosite/miastenia gravis, con sieronegatività anticorpale (4). In letteratura casi similari di sovrapposizione della miocardite da ICI con miosite/miastenia sono stati documentati. Il trattamento della tossicità neurologica non sempre è facile. Il nostro caso sottolinea l’importanza di una valutazione globale (cardiologica e neurologica) e di una diagnosi e trattamento tempestivi. L’ecocardiogramma e la risonanza magnetica cardiaca rappresentano il gold standard nella diagnosi non invasiva di miocardite. Il global longitudinal strain (GLS) del ventricolo sinistro può fornire importanti dati prognostici nei pazienti con miocardite (5). Il trattamento si basa sull’uso tempestivo di immunosoppressori. Le recenti linee guida europee (6) raccomandano di iniziare quanto prima il trattamento con alte dosi di metilpredinisolone per almeno 3-5 giorni e di valutare la risposta clinica. In caso di mancato miglioramento (miocardite refrattaria) viene suggerito di intraprendere un trattamento con immunosoppressori di II linea (micofenolato mofetitile, abatacept, alemtuzumab, etc.) o con altre metodiche quali la plasmaferesi. Il nostro caso evidenzia quanto sia necessario durante terapia con ICI il monitoraggio ECG e dei livelli di troponina per poter diagnosticare precocemente l’eventuale insorgenza di effetti tossici cardiovascolari, in quanto anche una singola dose di tali farmaci può avere conseguenze severe.
In conclusione, sebbene la terapia con ICI stia rivoluzionando la storia naturale di molti tumori, la coesistenza di effetti benefici e cardiotossici anche fulminanti, pone ogni cardiologo nelle condizioni di dover risolvere “il mistero diagnostico” legato a tali farmaci, soprattutto nei casi di overlap miocardite/miosite periferica e/o altri sintomi neurologici.
BIBLIOGRAFIA
- Palaskas N, Lopez-Mattei J, Durand JB, et al. Immune Checkpoint Inhibitor Myocarditis: Pathophysiological Characteristics, Diagnosis, and Treatment. J Am Heart Assoc. 2020;9(2): e013757.
- Ferreira VM, Schulz-Menger J, Holmvang G, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018;72(24):3158-3176.
- Luetkens JA, Faron A, Isaak A, et al. Comparison of original and 2018 Lake Louise criteria for diagnosis of acute myocarditis: results of a validation cohort. Radiology: Cardiothoracic Imaging. 2019;1: e190010.
- Huang YT, Chen YP, Lin WC, et al. Immune Checkpoint Inhibitor-Induced Myasthenia Gravis. Front Neurol. 2020 Jul 16; 11:634.
- Awadalla M, Mahmood SS, Groarke JD, et al. Global Longitudinal Strain and Cardiac Events in Patients with Immune Checkpoint Inhibitor-Related Myocarditis. J Am Coll Cardiol. 2020; 75:467-478
- Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-4361.
Un raro caso di cardiomiopatia non-amiloidotica da depositi di catene leggere con pattern aritmogeno alla risonanza magnetica
Raimondo Pittorru1, Simone Ungaro1, Antonella Capomolla1, Vittorio Zuccarelli1, Federico Migliore1, Giuseppe Tarantini1, Annalisa Angelini1, Sabino Iliceto1, Manuel De Lazzari1, Martina Perazzolo Marra1
1. Dipartimento di Scienze Cardio-Toraco-Vascolari e Sanità Pubblica, Università degli Studi di Padova, Padova, Italia
ABSTRACT
La malattia da deposito di catene leggere (LCDD) è una rara discrasia plasmacellulare caratterizzata da una deposizione di catene leggere (LC) mal ripiegate, che presenta diverse differenze con l’amiloidosi AL1,2. Il coinvolgimento cardiaco è considerato un evento raro oltre che tardivo nella storia naturale della patologia3, e potrebbe associarsi ad un’aumentata instabilità elettrica. La risonanza magnetica cardiaca, l’esame istopatologico con caratterizzazione tissutale e la microscopia elettronica sono elementi diagnostici essenziali per giungere ad una diagnosi corretta.
CASO CLINICO
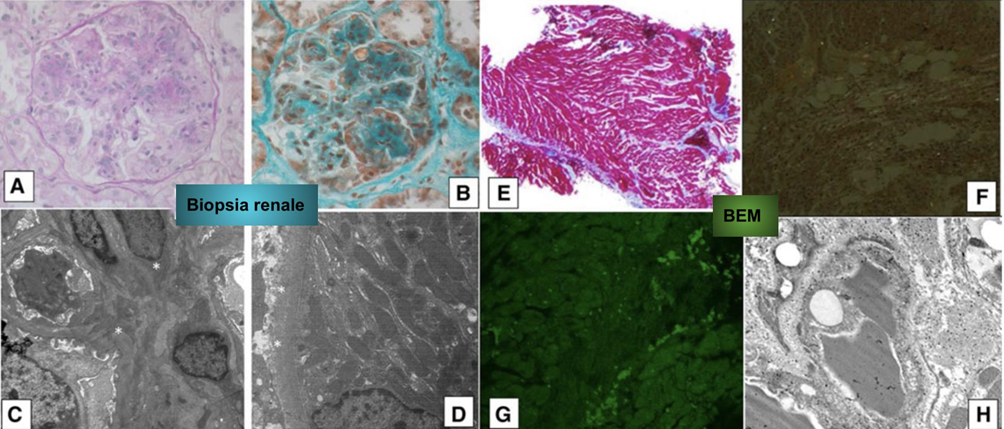
Riportiamo il caso di un uomo di 52 anni affetto da gammopatia monoclonale IgGk + k e sindrome nefrosica. Tale patologia era stata diagnosticata mediante biopsia del midollo osseo, che mostrava una presenza di plasmacellule del 60%, mentre la biopsia renale, attraverso tecniche di immunofluorescenza e microscopia ottica ed elettronica, confermava la presenza di malattia da deposito di catene leggere. Alla biopsia si riscontravano reperti caratteristici della malattia (Figure 2A e 2B); il microscopio elettronico mostrava un particolare materiale granulare, non fibrillare, elettrondenso lungo la membrana basale dei capillari glomerulari entro i nodulo mesangiali e lungo la membrana basale tubulare (Figure 2C, 2D).
Il paziente, trattato inizialmente con protocollo chemioterapico a base di Bortezomib-desametasone, veniva poi sottoposto a trapianto autologo di cellule staminali con remissione clinica e laboratoristica completa della patologia, renale ed ematologica.
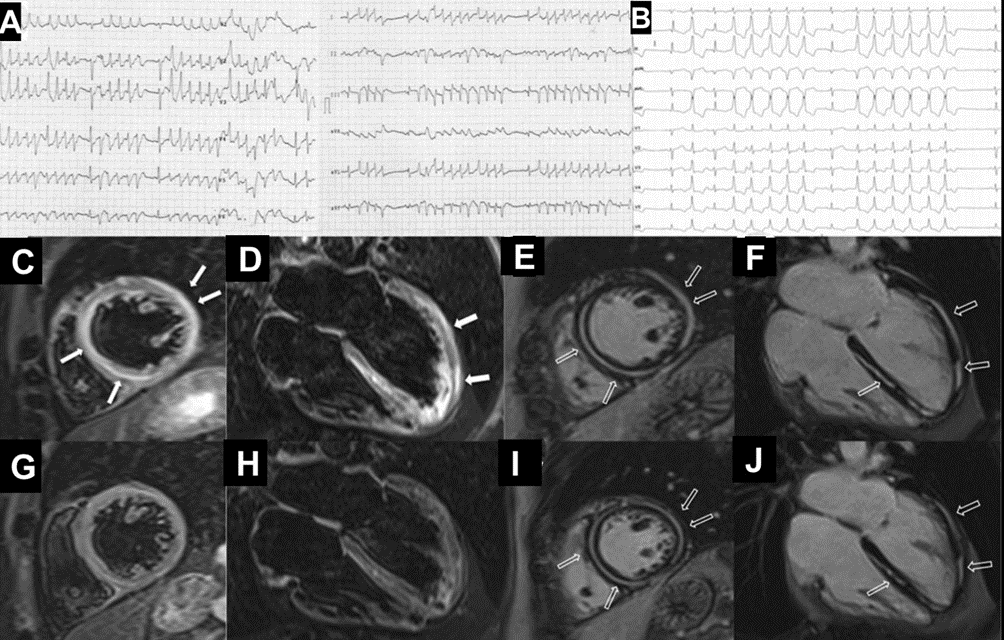
In seguito, tuttavia, si assisteva ad una ripresa di malattia testimoniata da un repentino aumento sierico delle IgG/k e delle catene leggere k, pertanto veniva introdotta la Lenalidomide. Due mesi dopo la modifica terapeutica, il paziente accedeva in Pronto Soccorso per comparsa di un episodio sincopale a riposo. Durante il ricovero, i valori degli indici di miocardiocitolisi registrati risultavano negativi, mentre al monitoraggio elettrocardiografico, si riscontravano onde T negative in sede infero-laterale in presenza di un bigeminismo ventricolare alternato a episodi ditorsioni di punta innescati dal fenomeno “R su T” (Figura 1A).
Nonostante la frazione di eiezione conservata, si proponeva approfondimento diagnostico mediante coronarografia con riscontro di ponte intramiocardico lungo il decorso dell’arteria coronaria discendente anteriore. Si procedeva quindi all’esecuzione di una risonanza magnetica cardiaca (RM), che mostrava un ventricolo sinistro non ipertrofico e con frazione di eiezione preservata, nonostante la presenza di ipocinesia regionale. Particolare attenzione veniva indirizzata nei confronti del late-gadolinium enhancement e nella valutazione dell’edema intramiocardico. L’edema, infatti, era localizzato in corrispondenza della parete subepicardica infero-laterale del ventricolo sinistro e associato a una stria edematosa a livello medio-settale (Figure da 1C a 1F). Alle sequenze post-contrastografiche, si rilevava LGE nelle medesime sedi con pattern ring-like (Figure da 1G a 1L) di natura non ischemica e non-amiloidotica.
Sulla scorta dei reperti della RM, il paziente veniva sottoposto a biopsia endomiocardica: i preparati colorati con ematossilina-eosina mostravano reperti aspecifici, tra cui fibrosi e necrosi miocardica focale, in assenza di infiltrato infiammatorio (Figura 2 E); le colorazioni specifiche per amiloidosi, ossia Rosso congo (Figura 2F) e Tioflavina T (Figura 2G) risultavano altresì negative.
Risultava, invece, dirimente l’analisi al microscopio elettronico che documentava materiale elettrondenso granulare a livello interstiziale, senza dimostrazione di alcun pattern o caratteristica tipica di patologia amiloidotica cardiaca (tra cui foglietti-beta fibrillari; Figura 2H).
Durante la degenza, si registravano ripetuti episodi di tachicardia ventricolare non sostenuta (Figura 1B) per i quali, anche in considerazione delle evidenze strumentali, il paziente veniva sottoposto a impianto di ICD transvenoso.
Veniva quindi dimesso con una diagnosi finale di “LCDD (κ) con coinvolgimento cardiaco”, e prosecuzione del regime chemioterapico con la lenalidomide.
Dopo 3 mesi dall’impianto dell’ICD, a causa di endocardite su elettrocatetere, si procedeva all’estrazione transvenosa e all’impianto di un nuovo dispositivo, previa ripetizione di RM. Tale esame, rispetto al precedente, rivelava una significativa riduzione di edema miocardico e persistenza di LGE.
DISCUSSIONE
La LCDD è una rara discrasia delle plasmacellule caratterizzata da una deposizione non-amiloidotica di catene leggere (LC) malripiegate in organi e tessuti1,2. Il coinvolgimento cardiaco è considerato un evento raro oltre che tardivo nella storia naturale della patologia3. Proprio per questo motivo, il pattern di deposizione non fibrillare delle catene leggere nel miocardio è stato evidenziato solo in poche biopsie endomiocardiche. Le aritmie ventricolari life-threatening e gli ecocardiogrammi non-diagnostici rappresentano i due hallmarks di tale coinvolgimento3,4,5.
In letteratura esistono poche evidenze in merito al coinvolgimento cardiaco in presenza di LCDD, verosimilmente a causa della rarità della patologia, per tale motivo non si dispone di dati in merito all’imaging in vivo di tale condizione. In merito al caso, la presenza di edema alla prima RM identifica la deposizione subacuta interstiziale di LC, che, considerata la loro intrinseca proteotossicità, sono alla base dell’instabilità elettrica e del burden aritmico. Inoltre, il pattern LGE che risparmia l’endocardio confermerebbe le evidenze in merito agli studi autoptici relativi a tale patologia3.
CONCLUSIONI
Il nostro gruppo, per la prima volta, ha descritto un pattern in vivo del coinvolgimento cardiaco in corso di LCDD mediante la caratterizzazione tissutale ottenuta attraverso risonanza magnetica cardiaca, preparati istologici e microscopia elettronica. Abbiamo dimostrato che la LCDD ha, quindi, una distribuzione ed un’organizzazione ultrastrutturale diverse rispetto alle caratteristiche tissutali evidenziabili in corso di amiloidosi AL, e si associa ad una importante instabilità elettrica.
BIBLIOGRAFIA
1. Sayed RH, Wechalekar AD, Gilbertson JA, Bass P, Mahmood S, Sachchithanantham S, Fontana M, Patel K, Whelan CJ, Lachmann HJ, Hawkins PN, Gillmore JD. Natural history and outcome of light chain deposition disease. Blood. 2015 Dec 24;126(26):2805-10. doi: 10.1182/blood-2015-07-658872. Epub 2015 Sep 21. PMID: 26392598; PMCID: PMC4732758.
2. Masood A, Ehsan H, Iqbal Q, Salman A, Hashmi H. Treatment of Light Chain Deposition Disease: A Systematic Review. J Hematol. 2022 Aug;11(4):123-130. doi: 10.14740/jh1038. Epub 2022 Aug 30. PMID: 36118549; PMCID: PMC9451548.
3. Ramdane BA, Joseph J, Thomas M, O’Hara C, Barlogie B, Walker P, Joseph L. Cardiac nonamyloidotic immunoglobulin deposition disease. Mod Pathol. 2006;19:233–237.
4. Buxbaum JN, Genega EM, Lazowski P, Kumar A, Tunick PA, Kronzon I, Gallo GR. Infiltrative nonamyloidotic monoclonal immunoglobulin light chain cardiomyopathy: an underappreciated manifestation of plasma cell dyscrasias. Cardiology. 2000;93:220–228. doi: 10.1159/000007030
5. Manuel De Lazzari, Marny Fedrigo, Federico Migliore, Andrea Cianci, Luisa Cacciavillani, Giuseppe Tarantini, Benedetta Giorgi, Sabino Iliceto, Gaetano Thiene, Marialuisa Valente, Annalisa Angelini, Fausto Adami, Martina Perazzolo Marra. Nonamyloidotic Light Chain Cardiomyopathy: The Arrhythmogenic Magnetic Resonance Pattern. Circulation. 2016. 10.1161/CIRCULATIONAHA.115.019895
Pseudoaneurisma infettivo: quando un BAV può nascondere sorprese
Dario Fabiani1, Andrea Vergara1, Fabrizia Terracciano1, Antonio De Pasquale1, Paolo Calabrò1
1. Dipartimento di Scienze Mediche Traslazionali, Università degli Studi della Campania “Luigi Vanvitelli”, A.O.R.N. Sant’Anna e San Sebastiano, Caserta
ABSTRACT
L’endocardite infettiva (EI) su protesi valvolare costituisce la forma più severa di EI e si verifica nell’1-6% dei pazienti portatori di protesi valvolare (1). Rappresenta il 10-30% di tutti i casi di EI e colpisce in egual misura sia le protesi meccaniche che biologiche, provocando solitamente la comparsa di insufficienza protesica, e più raramente anche all’ostruzione di protesi. La conoscenza delle indicazioni all’intervento cardochirurgico, il timing dell’intervento e il ruolo dell’ “Endocarditis Team”, risultano fondamentali ai fini terapeutici. Riportiamo il caso clinico di un paziente di 75 anni in cui è stato riscontrato un blocco atrioventricolare di III grado secondario a un’EI della protesi biologica aortica con estensione perivalvolare. Il corretto inquadramento anamnestico-laboratoristico associato all’accuratezza diagnostica delle tecniche di imaging (ecocardiogramma transesofageo, TEE), sono risultati fondamentali ai fini prognostici.
CASO CLINICO
Presentiamo il caso clinico di un uomo di 75 anni, affetto da ipertensione arteriosa sistemica, dislipidemia, diabete mellito di tipo 2, portatore di protesi biologica aortica da circa 7 anni. Il paziente in questione si è presentato al nostro Dipartimento di Emergenza e Accettazione riferendo storia di febbricola intermittente (T 37.5°C) da qualche settimana, associata ad astenia marcata e bradicardia. A domicilio era stato trattato empiricamente con farmaci antibiotici e anti-infiammatori senza ottenere una franca risoluzione della sintomatologia. Al momento della nostra valutazione, le condizioni generali del paziente erano scadute.
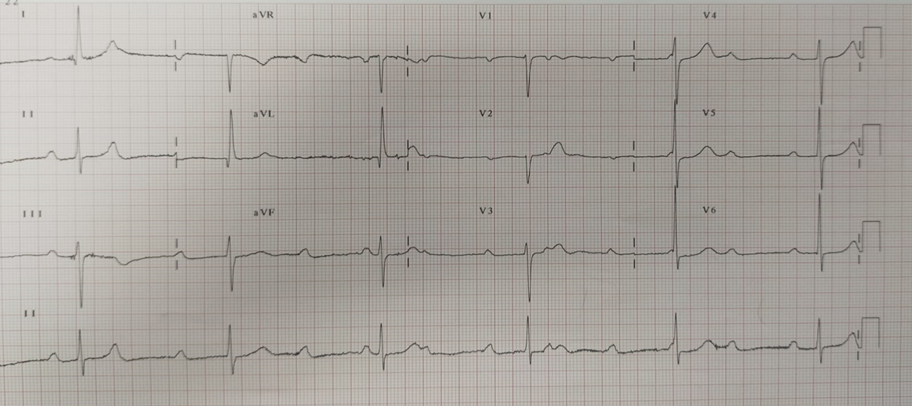
Obiettivamente presentava ipotensione (PA 90/50 mmHg), bradicardia marcata (Fc 35 bpm), SpO2 90% in aria ambiente e temperatura corporea pari a 38°C. All’ECG di superficie a 12 derivazioni si diagnosticava un BAV di III grado a frequenza ventricolare di 35 bpm (Figura 1). Dopo aver escluso disionie e altre cause reversibili di blocco atrio-ventricolare, veniva posizionato un PMK temporaneo per via venosa transfemorale con stabilizzazione del quadro clinico-emodinamico. Gli esami di laboratorio eseguiti in urgenza, mostravano una leucocitosi neutrofila (GB 19.000/mm3 con 90% di neutrofili) associata ad anemia (Hg 8.6 g/dL) e ad incremento degli indici di flogosi (VES, PCR e pro calcitonina). Considerando la storia anamnestica del paziente e gli esami di laboratorio, entrambi suggestivi di endocardite infettiva, veniva posta indicazione all’ esecuzione di TEE a completamento diagnostico.
Si evidenziava, pertanto, la presenza di una cavità a contenuto anecogeno a sede periprotesica, con estensione alla fibrosa intervalvolare mitro-aortica, fistolizzata nel tratto di efflusso del ventricolo sinistro con presenza di flusso color-Doppler al suo interno (Figura 2 e Figura 3). Il reperto ecocardiografico descritto era quindi compatibile con la diagnosi di pseudoaneurisma periprotesico aortico. Si associava a questo, l’evidenza di deiscenza totale ed instabilità della protesi biologica aortica.
Il paziente veniva, quindi, trasferito presso la nostra terapia intensiva cardiologica dove si praticavano emocolture seriate e veniva impostata terapia antibiotica empirica ad ampio spettro. In terza giornata di degenza, il laboratorio comunicava il risultato dell’esame colturale, con l’isolamento di Staphilococco Aureo meticillino-resistente (MRSA) per cui veniva posta diagnosi di endocardite infettiva in base ai criteri di Duke modificati (1). Il caso veniva sottoposto a discussione da parte dell’ “Endocarditis Team”, che poneva indicazione ad effettuare l’intervento cardochirurgico urgente in accordo con le ultime linee guida ESC in tema di EI (1). Il paziente veniva quindi sottoposto, con successo, ad intervento cardochirurgico di ricostruzione della fibrosi mitro-aortica con patch e sostituzione della bioprotesi aortica con nuova protesi. Il decorso post-operatorio è stato regolare. La terapia antibiotica endovena è stata proseguita per ulteriori 4 settimane. A negativizzazione ottenuta degli esami colturali, il paziente è stato sottoposto ad impianto di pace-maker definitivo. Al follow-up a 6 mesi, il paziente si presentava apiretico e in buone condizioni cliniche generali.
DISCUSSIONE
Un’EI viene definita “non controllata” nel caso di persistenza dell’agente patogeno nonostante antibioticoterapia o, in alternativa, in presenza di un’infezione ad estensione locale perivalvolare. Le infezioni non controllate rappresentano una delle complicanze più temibili dell’EI e generalmente sono causate da microrganismi resistenti alla terapia antibiotica oppure particolarmente virulenti. La formazione di ascessi, pseudoaneurismi e fistole, rappresenta la causa più comune di EI “non controllata” (1). Essi sono associati ad una prognosi sfavorevole e il loro riscontro costituisce un’indicazione ad un intervento cardochirurgico urgente.
La formazione di ascessi perivalvolari è comune nei portatori di protesi valvolari aortiche (56-100%) e la localizzazione più frequente è a livello della fibrosa intervalvolare mitro-aortica (2). Nonostante i tassi di ricorso alla chirurgia in questa popolazione siano elevati (87%), la mortalità intraospedaliera rimane alta (41%). Altre complicanze correlate ad una significativa estensione locale dell’infezione, soprattutto a livello aortico, sono l’insorgenza di difetti del setto interventricolare, di blocchi atrioventricolari e, più raramente, le sindromi coronariche acute (3). La persistenza di febbre di origine sconosciuta associata allo sviluppo di blocchi atrioventricolari devono indurre a sospettare un’ EI con insorgenza di complicanze periprotesiche, soprattutto se l’infezione è localizzata a livello aortico. Dopo la diagnosi, in caso di iniziale strategia conservativa, è importante l’esecuzione di controlli TEE seriati, eseguiti in corso di terapia antibiotica mirata, specialmente nei casi di EI su protesi valvolare aortica. Tuttavia ascessi di piccole dimensioni, soprattutto se localizzati in sede mitralica con coesistente calcificazione dell’anulus, posso risultare misdiagnosticati con tale metodica. Il ricorso all’imaging multimodale, mediante l’integrazione di vantaggi e svantaggi di varie metodiche come TEE, TAC cardiaca e PET/TC, consente una migliore accuratezza diagnostica (4).
Bibliografia
- Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, Dulgheru R, El Khoury G, Erba PA, Iung B, Miro JM, Mulder BJ, Plonska-Gosciniak E, Price S, Roos-Hesselink J, Snygg-Martin U, Thuny F, Tornos Mas P, Vilacosta I, Zamorano JL; ESC Scientific Document Group. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015 Nov 21;36(44):3075-3128
- Graupner C, Vilacosta I, SanRomán J, Ronderos R, Sarriá C, Fernández C, Mújica R, Sanz O, Sanmartín JV, Pinto AG. Periannular extension of infective endocarditis. J Am Coll Cardiol. 2002 Apr 3;39(7):1204-11.
- Anguera I, Miro JM, San Roman JA, de Alarcon A, Anguita M, Almirante B, Evangelista A, Cabell CH, Vilacosta I, Ripoll T, Munoz P, Navas E, Gonzalez-Juanatey C, Sarria C, Garcia-Bolao I, Farinas MC, Rufi G, Miralles F, Pare C, Fowler VG Jr, Mestres CA, de Lazzari E, Guma JR, del Rio A, Corey GR. Periannular complications in infective endocarditis involving prosthetic aortic valves. Am J Cardiol 2006;98:1261–1268.
- Thuny F, Gaubert JY, Jacquier A, Tessonnier L, Cammilleri S, Raoult D, Habib G. Imaging investigations in infective endocarditis: current approach and perspectives. Arch Cardiovasc Dis 2013;106:52–62.
Staged protected percutaneous coronary intervention with Impella CP® device in patient with recent acute coronary syndrome, arrhythmic storm, and severe left ventricular dysfunction: sometimes waiting is better!
Domenico Simone Castiello1, Domenico Angellotti1, Fiorenzo Simonetti1, Andrea Mariani1, Rachele Manzo1, Maddalena Immobile Molaro1, Dalila Nappa1
1Dipartimento di Scienze Biomediche Avanzate, Università Federico II di Napoli
ABSTRACT
Negli ultimi anni si è assistito ad un significativo aumento dell’uso dei dispositivi percutanei di assistenza ventricolare (pVADs, Percutaneous Ventricular Assist Devices) come supporto emodinamico nello shock cardiogeno e durante le procedure interventistiche, incluse le procedure di angioplastica coronarica percutanea (PCI, Percutaneous Coronary Intervention) ad alto rischio, che, supportata dai pVADs, viene attualmente definita “Protected” PCI. In questo report presentiamo il caso clinico di un paziente di 67 anni con diagnosi di sindrome coronarica acuta con sopraslivellamento del tratto ST (STE-ACS, ST-elevation Acute Coronary Syndrome) che, data la complessità anaatomica coronarica, la disfunzione ventricolare sinistra, le severe co-morbidità ed il burden aritmico, in seguito alla PCI primaria in urgenza, veniva candidato a staged Protected PCI con il dispositivo Impella CP® per il trattamento di una stenosi sub-occlusiva calcifica di Tronco Comune non protetto dell’Arteria Coronaria Sinistra.
CASO CLINICO
Presentiamo il caso clinico di un paziente di 67 anni con i seguenti fattori di rischio cardiovascolare: ipertensione arteriosa, diabete mellito di tipo II in trattamento insulinico dislipidemia e pregressa abitudine tabagica. In anamnesi, inoltre, il paziente presenta malattia renale cronica (CKD, Chronic Kidney Disease) in trattamento dialitico dal 2008 e sottoposta a trapianto renale nel 2011, ipotiroidismo e BPCO. Il paziente si reca in pronto soccorso per l’insorgenza, da circa due ore, di dolore epigastrico oppressivo, palpitazioni e sudorazione algica. Viene quindi eseguito un elettrocardiogramma che evidenzia un sopraslivellamento del tratto ST nelle derivazioni AVR e V1 con associato sottoslivellamento diffuso (in 8 derivazioni). Viene quindi posta diagnosi di infarto miocardico con sopraslivellamento del tratto ST (STEMI, ST-elevation Myocardial Infarction) dato che un simile quadro elettrocardiografico va considerato come uno STEMI-equivalente [1]. Per tale motivo il paziente viene trasferito presso il nostro centro Hub per essere sottoposto ad angiografia coronarica in urgenza.
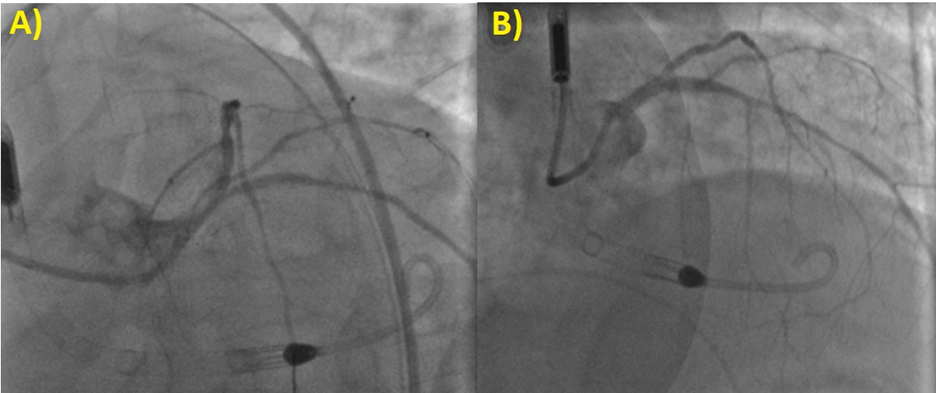
Il quadro angiografico mostra una malattia aterosclerotica coronarica (CAD, Coronary Artery Disease) multivasale e complessa: si evidenzia infatti un’occlusione cronica totale (CTO, Chronic Total Occlusion) del Ramo Circonflesso dell’Arteria Coronaria Sinistra, ben riabitata per via etero-coronarica dall’Arteria Coronaria Destra che appare ateromasica, esente da stenosi angiograficamente significative. Si riscontra altresì una stenosi subocclusiva, trombotica al tratto prossimale e medio del Primo Ramo Diagonale dell’Arteria Coronaria Sinistra e soprattutto una stenosi subocclusiva e calcifica al tratto medio del Tronco Comune dell’Arteria Coronaria Sinistra coinvolgente l’ostio del Ramo Interventricolare Anteriore (Figura 1).
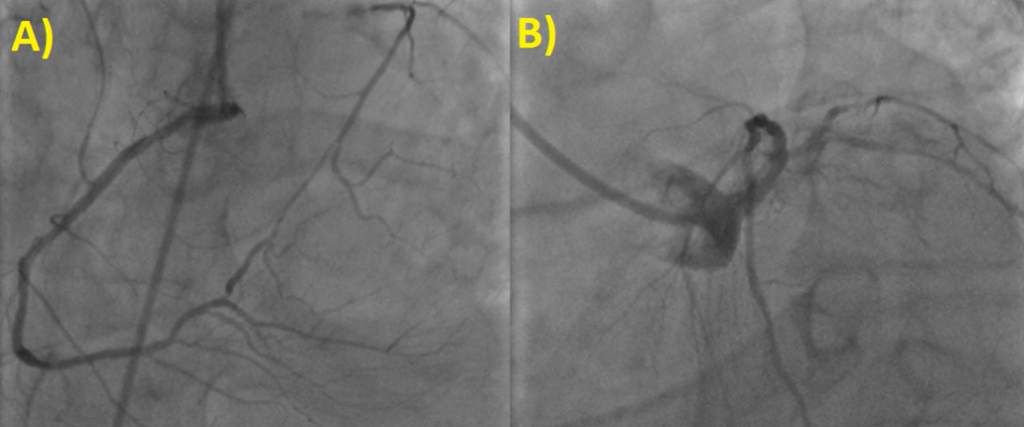
A) CTO del Ramo Circonflesso con buona riabitazione per via etero-coronarica dall’Arteria Coronaria Destra. B) Stenosi subocclusiva e calcifica al tratto medio-distale del Tronco Comune dell’Arteria Coronaria Sinistra coinvolgente l’ostio del Ramo Interventricolare Anteriore.
Si decide di procedere a PCI primaria con impianto di due stent medicati (DES, Drug-Eluting Stent) in overlap al tratto prossimale e medio del Primo Ramo Diagonale ottenendo un ottimo risultato angiografico finale con flusso anterogrado coronarico TIMI 3 (Figura 2).
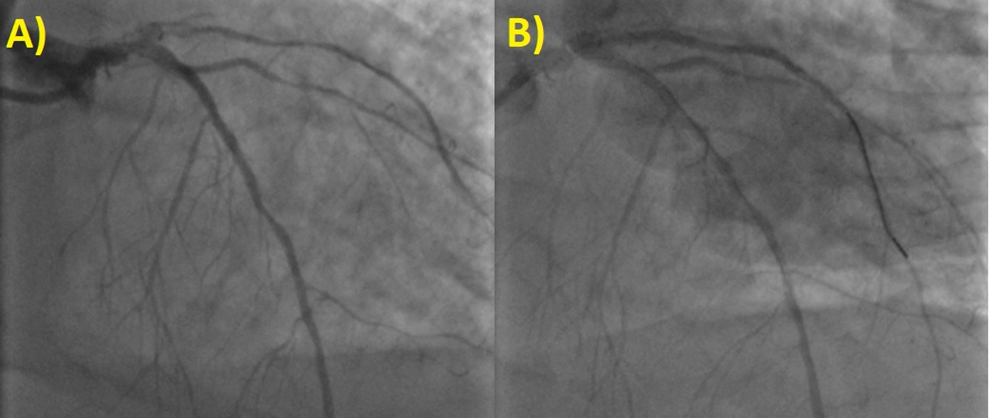
A) Stenosi subocclusiva, trombotica al tratto prossimale e medio del Primo Ramo Diagonale dell’Arteria Coronaria Sinistra. B) PCI con impianto di due DES al tratto prossimale e medio del Primo Ramo Diagonale con ottimo risultato angiografico finale.
Il paziente si presentava in condizioni di stabilità emodinamica, per cui si decideva di discutere successivamente in Heart Team la strategia ottimale di rivascolarizzazione per il Tronco Comune non protetto. In UTIC il paziente veniva sottoposto ad ecocolorDoppler cardiaco transtoracico che evidenziava una severa disfunzione ventricolare sinistra con acinesia dell’apice in toto ed ipocinesia diffusa determinanti una Frazione di Eiezione (EF, Ejection Fraction) del 30%. Il giorno seguente il paziente sviluppava fibrillazione atriale ad alta risposta ventricolare determinante un quadro di instabilità emodinamica, trattato con cardioversione elettrica ed infusione endovenosa di amiodarone. Poche ore dopo si assisteva all’insorgenza di un quadro di Storm Aritmico, con sei episodi di tachicardia ventricolare sostenuta che venivano trattati con infusione endovenosa di amiodarone, metoprololo e lidocaina, dopo un tentativo infruttuoso di cardioversione elettrica, ottenendo il ripristino del ritmo sinusale (Figura 3).
In Heart Team si decretava che il paziente non era candidabile alla rivascolarizzazione chirurgica, data la severa disfunzione ventricolare sinistra, l’elevato burden aritmico, la lunga storia di CKD severa e l’anatomia coronarica favorevole per la rivascolarizzazione percutanea [2]. Si poneva quindi indicazione all’esecuzione di staged Protected PCI con il dispositivo di supporto al circolo Impella CP, una pompa micro-assiale intravascolare che viene posizionata per via retrograda in posizione trans-valvolare aortica che, aspirando il sangue dal ventricolo sinistro per espellerlo direttamente in aorta ascendente, permette l’unloading ventricolare offrendo un flusso continuo, non pulsatile, fino a 4 L/min. Tre giorni dopo la PCI primaria, il paziente viene quindi condotto nuovamente nel Laboratorio di Emodinamica per essere sottoposto alla procedura. Il device veniva impiantato per via percutanea arteriosa femorale sinistra, attraverso un introduttore di 14 Fr. Il Tronco Comune veniva quindi sottoposto a multiple predilatazioni e successivamente trattato con l’impianto di un DES con un ottimo risultato angiografico finale (Figura 4).
Al termine della procedura il paziente veniva condotto nuovamente in UTIC dove l’ecocolorDoppler cardiaco transtoracico evidenziava un corretto posizionamento dell’Impella con l’aliasing visibile oltre il piano valvolare aortico, in aorta ascendente e con il marker dell’inlet localizzato 4 cm al di sotto dell’anulus aortico (Figura 5).

Due giorni dopo la procedura si intraprendeva lo svezzamento del paziente dal device che veniva quindi rimosso con l’utilizzo del sistema di chiusura Manta® 14 Fr. Il resto della degenza trascorreva senza complicanze ed il paziente veniva dimesso in buone condizioni cliniche ed in stabilità emodinamica in decima giornata dalla Protected PCI.
DISCUSSIONE
Nei pazienti candidati a PCI ad alto rischio, l’Impella fornisce un supporto emodinamico e protegge dall’ischemia miocardica. Infatti, determinando un unloading diretto del ventricolo sinistro, consente un’immediata riduzione del lavoro miocardico e della richiesta di ossigeno. Simultaneamente il flusso coronarico aumenta con un miglioramento della perfusione sistemica attraverso un aumento della pressione arteriosa media e una riduzione della pressione tele-diastolica del ventricolo sinistro. L’Impella è inoltre un device dipendente dal precarico, ma non ritmo dipendente e garantisce un’azione continua, non pulsatile determinando quindi una gittata cardiaca e una pressione arteriosa media stabili. Grazie a queste caratteristiche, permette il mantenimento della stabilità emodinamica garantendo il tempo necessario per raggiungere la rivascolarizzazione completa. Solitamente andrebbe considerata ad alto rischio una PCI in presenza di specifici criteri clinici (disfunzione ventricolare sinistra con EF ≤35%, instabilità emodinamica, diabete mellito, ACS, CKD, pregressa chirurgia cardiaca) ed anatomici (CAD multivasale, malattia di Tronco Comune non protetto, malattia di biforcazione, presenza di CTO, lesioni severamente calcifiche) [3].
L’impiego dell’Impella nelle PCI ad alto rischio è stato valutato nella serie di studi PROTECT. Il PROTECT I ha evidenziato che il dispositivo Impella 2.5 è sicuro, facile da impiantare e garantisce un eccellente supporto emodinamico durante PCI ad alto rischio [4]. Successivamente il PROTECT II trial, uno studio prospettico multicentrico randomizzato ha confrontato IABP e Impella 2.5 nel setting di PCI elettiva ad alto rischio. Nel follow-up a 90 giorni, l’Impella è risultato associato ad una significativa riduzione degli eventi cardiovascolari maggiori (MACEs, Major Adverse Cardiovascular Events) rispetto all’IABP (p=0.023) con una riduzione del rischio relativo pari al 22% [5]. Infine, il successivo PROTECT III trial ha evidenziato una riduzione dei MACEs a 90 giorni con Protected PCI con Impella (2.5 and CP), comparato con i pazienti sottoposti a Protected PCI con Impella 2.5 arruolati nello studio PROTECT II [6]. Per quanto riguarda le raccomandazioni delle linee guida, un consensus document Europeo congiunto EAPCI/ACVC sull’impiego dei pVADs enuncia che l’impiego delle pompe micro-assiali, come l’Impella CP, potrebbe essere considerato in pazienti altamente selezionati candidati a PCI ad alto rischio secondo criteri clinici ed anatomici in caso di accessi femorali adeguati (diametro dell’arteria femorale comune >6 mm, in assenza di severe tortuosità) [7]. Una simile raccomandazione viene fornita dalle linee guida Americane ACC/AHA/SCAI riguardo la rivascolarizzazione miocardica (Classe IIb, livello di evidenza C) [8].
CONCLUSIONE
Le pompe micro-assiali (come l’Impella CP) rappresentano degli eccellenti devices per supportare le procedure di PCI ad alto rischio. Questi dispositivi garantiscono un supporto emodinamico durante la procedura, prevengono episodi di ipoperfusione e consentono un tempo sufficiente per raggiungere la rivascolarizzazione miocardica completa. Il PROTECT IV trial, attualmente in fase di arruolamento, fornirà probabilmente l’evidenza necessaria per ottenere in futuro una raccomandazione di Classe I nelle linee guida per l’impiego dell’Impella nelle PCI ad alto rischio.
BIBLIOGRAFIA
[1] Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD; Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018 Nov 13;138(20):e618-e651.
[2] Park DW, Park SJ. Percutaneous Coronary Intervention of Left Main Disease: Pre- and Post-EXCEL (Evaluation of XIENCE Everolimus Eluting Stent Versus Coronary Artery Bypass Surgery for Effectiveness of Left Main Revascularization) and NOBLE (Nordic-Baltic-British Left Main Revascularization Study) Era. Circ Cardiovasc Interv. 2017 Jun;10(6):e004792.
[3] Leick J, Werner N, Mangner N, Panoulas V, Aurigemma C. Optimized patient selection in high-risk protected percutaneous coronary intervention. Eur Heart J Suppl. 2022 Dec 8;24(Suppl J):J4-J10.
[4] Dixon SR, Henriques JP, Mauri L, Sjauw K, Civitello A, Kar B, Loyalka P, Resnic FS, Teirstein P, Makkar R, Palacios IF, Collins M, Moses J, Benali K, O’Neill WW. A prospective feasibility trial investigating the use of the Impella 2.5 system in patients undergoing high-risk percutaneous coronary intervention (The PROTECT I Trial): initial U.S. experience. JACC Cardiovasc Interv. 2009 Feb;2(2):91-6.
[5] O’Neill WW, Kleiman NS, Moses J, Henriques JP, Dixon S, Massaro J, Palacios I, Maini B, Mulukutla S, Dzavík V, Popma J, Douglas PS, Ohman M. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intra-aortic balloon pump in patients undergoing high-risk percutaneous coronary intervention: the PROTECT II study. Circulation. 2012 Oct 2;126(14):1717-27.
[6] O’Neill WW, Anderson M, Burkhoff D, Grines CL, Kapur NK, Lansky AJ, Mannino S, McCabe JM, Alaswad K, Daggubati R, Wohns D, Meraj PM, Pinto DS, Popma JJ, Moses JW, Schreiber TL, Magnus Ohman E. Improved outcomes in patients with severely depressed LVEF undergoing percutaneous coronary intervention with contemporary practices. Am Heart J. 2022 Jun;248:139-149.
[7] Chieffo A, Dudek D, Hassager C, Combes A, Gramegna M, Halvorsen S, Huber K, Kunadian V, Maly J, Møller JE, Pappalardo F, Tarantini G, Tavazzi G, Thiele H, Vandenbriele C, Van Mieghem N, Vranckx P, Werner N, Price S. Joint EAPCI/ACVC expert consensus document on percutaneous ventricular assist devices. EuroIntervention. 2021 Jul 20;17(4):e274-e286.
[8] Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. Circulation 2022;145:e18–e114.
Un singolare caso di severa disfunzione ventricolare sinistra: “Breaking Bad” alla milanese
Donisi Luca 1,2, Guareschi Alessandro 1,2, Calcagnino Margherita 2, Gherbesi Elisa 2, Garascia Andrea3, Faggiano Andrea 1,2, Vicenzi Marco 1,2, Carugo Stefano 1,2
1 Department of Clinical Sciences and Community Health, University of Milano, Italy
2 Department of Cardio-Thoracic-Vascular Diseases, Foundation IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Italy
3 “De Gasperis” Cardio Center, Niguarda Hospital, ASST Grande Ospedale Metropolitano Niguarda, Piazza Ospedale Maggiore, 3, 20162 Milan, Italy
ABSTRACT
In un uomo di 39 anni di origini filippine e un’anamnesi dimostratasi successivamente incompleta con nuovo riscontro di severa cardiopatia ipocinetica dilatativa veniva indagata l’eziologia mediante l’esecuzione di risonanza magnetica cardiaca, PET-TC, angio-TC coronarica, angiografia coronarica e biopsia endomiocardica con riscontro di verosimile methamphetamine-associated cardiomyopathy in overlap con un quadro di coronaropatia trivasale critica.
CASO CLINICO
Il protagonista del caso clinico è un uomo di 39 anni di origini filippine che si presentava in Pronto Soccorso per un primo riscontro di dispnea ed edemizzazione declive da circa una settimana. Dall’anamnesi raccolta si evinceva la presenza di plurimi fattori di rischio cardiovascolare: diabete mellito di tipo 2, storia pregressa di abuso alcolico (5 UI/die fino a due anni prima), steatosi epatica e fumo attivo.
Il primo elettrocardiogramma non mostrava significative alterazioni patologiche, se non un lieve sotto-livellamento nelle derivazioni infero-laterali.
Gli esami del sangue mostravano uno stabile movimento enzimatico (Troponine T 128>78>115 ng/dl), un profilo infiammatorio fluttuante senza richiamo d’organo e una funzionalità epatica alterata. All’RX del torace si evidenziava un aumento dell’ombra cardiaca con aumento della trama vascolare.
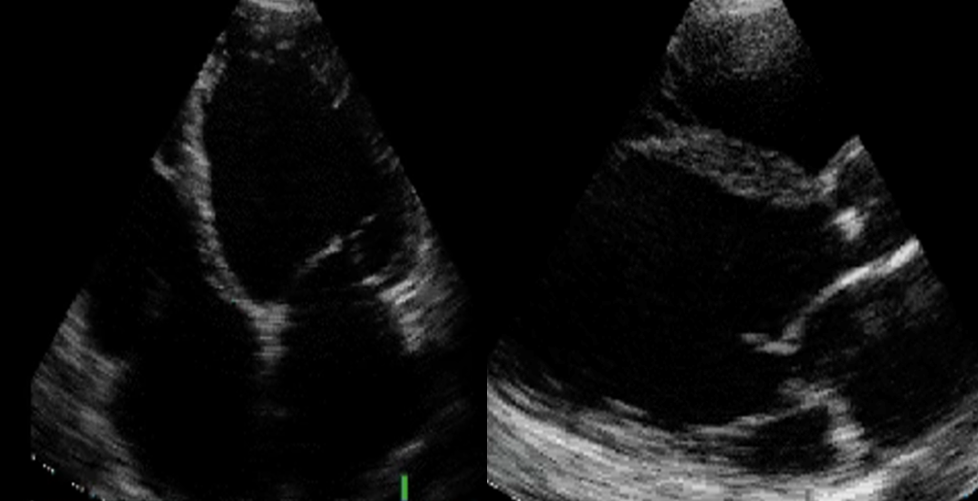
L’ecoscopia cardiaca eseguita in PS evidenziava un ventricolo sinistro dilatato (volume telediastolico VTD: 160 ml), con spessori parietali aumentati (setto/parete posteriore 13/13 mm) ed ipocinesia diffusa condizionante una severa disfunzione biventricolare (frazione d’eiezione FE 20%, Frazione d’accorciamento 20%).
Veniva quindi posta diagnosi di scompenso cardiaco a frazione d’eiezione ridotta (HFrEF) di nuovo riscontro con indicazione a ricovero in terapia intensiva cardiologica. Durante il monitoraggio i parametri vitali si mantenevano stabili con un quadro di congestione venosa senza ipoperfusione periferica. Veniva quindi impostata terapia diuretica endovenosa con rapida risoluzione degli edemi declivi e della dispnea. A paziente stabilizzato, veniva impostata la terapia specifica per l’HFrEF.
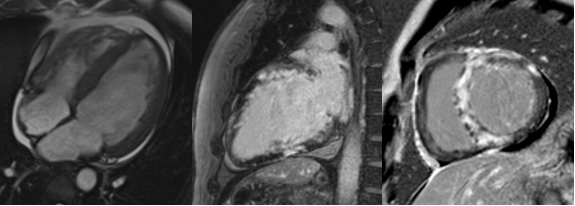
Data la giovane età e l’assenza di sintomatologia anginosa si decideva di eseguire in prima istanza la risonanza magnetica cardiaca che mostrava dimensioni aumentate del ventricolo sinistro (VTDi 112.8 ml/mq) e normali del ventricolo destro, una funzione sistolica significativamente ridotta (FE 17%), massa miocardica aumentata in presenza di diffusa ipertrofia. Inoltre, si evidenziava sia diffusa iperintensità di segnale di parete nelle sequenze STIR, con accumulo di late gadolinium enhancement (LGE) dopo somministrazione di mezzo di contrasto a carico del setto, della parete anteriore ed inferiore con aspetto patchy diffuso intramiocardico e subepicardico di significato non ischemico. Si confermava quindi un quadro di grave cardiopatia dilatativa ipocinetica con evidenza di fibrosi a distribuzione tipica di patologie infiammatorie quali la miocardite e/o la sarcoidosi.
Nonostante l’assenza di aritmie, in considerazione dell’età inferiore a 40 anni e il dosaggio dell’enzima ACE positivo (81.5 U/L) si decideva, per escludere la sarcoidosi, di eseguire una PET/TC con 18- FDG la quale mostrava una diffusa ipercaptazione miocardica sinistra e moderata destra in assenza di lesioni ipercaptanti in sede extra-cardiaca. Questo aspetto era compatibile con il quadro di scompenso acuto, mentre la sarcoidosi è solitamente caratterizzata da un accumulo patchy con noduli ipercaptanti extracardiaci, per cui veniva esclusa.
Dunque, i segni clinici, elettrocardiografici e di imaging suggerivano il sospetto di miocardite acuta. Si decideva, a completamento, nonostante la bassa probabilità pre-test di cardiopatia ischemica di eseguire una angio-TC coronarica con riscontro di coronaropatia trivasale coinvolgente il tronco comune. La severità delle lesioni veniva confermata dall’angiografia coronarica.
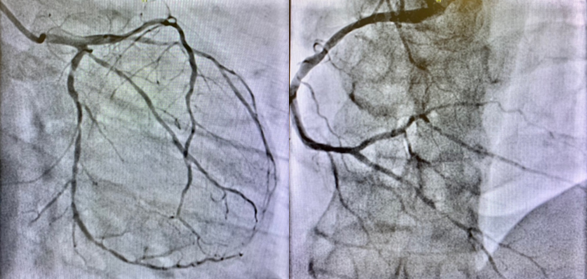
Dopo discussione in Heart Team veniva posta indicazione a bypass aortocoronarico, nonostante il quadro di coronaropatia difficilmente giustificasse il riscontro di una disfunzione ventricolare sinistra di tale entità, oltretutto caratterizzato da un pattern non-ischemico alla RM cardiaca. Pertanto, si decideva, prima di procedere a chirurgia, di eseguire una biopsia endomiocardica al fine di escludere una concomitante miocardite acuta. Il reperto anatomopatologico era privo di infiltrati infiammatori ma mostrava lieve fibrosi interstiziale senza alterazioni morfologiche dei cardiomiociti. Veniva quindi escluso anche il sospetto di miocardite acuta.
A fronte di tali riscontri di non univoca interpretazione, si decideva di effettuare una più scrupolosa anamnesi con l’aiuto di un collega psichiatria. Dal colloquio emergeva che il paziente avesse una lunga storia di abuso di shaboo, iniziata a 21 anni e sospesa solo 2 mesi prima. Lo shaboo è una droga a base di metamfetamina e caffeina particolarmente diffusa nella comunità filippina, che ha evidenziato in letteratura molteplici ripercussioni sul sistema cardiovascolare, tra cui una tossicità diretta sui miocardiociti, aumento dello stress ossidativo, disfunzione mitocondriale, vasoconstrizone polmonare e coronarica, incremento del processo aterosclerotico. L’uso cronico di queste sostanze può portare ad un quadro di severa disfunzione ventricolare che viene riconosciuto come methamphetamine-associated cardiomyopathy 1, 2, quadro compatibile con la storia del nostro paziente in cui era presente anche la cardiopatia ischemica in overlap. Il paziente veniva comunque sottoposto a rivascolarizzazione miocardica mediante duplice bypass aorto-coronarico (mammaria sinistra su interventicolare anteriore e safena su primo marginale). Dopo tre settimane di riabilitazione post-cardiochirurgia si assisteva ad un netto miglioramento del quadro ecocardiografico con normalizzazione del volume ventricolare sinistro (VTDi 80ml/mq) e solo lieve riduzione della FE (45%). A breve verrà eseguita RMN cardiaca di controllo per valutare l’eventuale miglioramento del burden di fibrosi.
CONCLUSIONI
La cardiomiopatia associata alla metanfetamina (MACM) è una condizione clinica caratterizzata da disfunzione del ventricolo sinistro e alterazioni strutturali del miocardio attribuite all’uso cronico di metanfetamine, sempre più diffuso a livello mondiale. Nell’iter diagnostico è importante soffermarsi approfonditamente sull’anamnesi perché spesso questa categoria di pazienti nasconde l’abuso di stupefacenti allo stesso staff medico che la raccoglie. Riconoscere la tossicodipendenza è fondamentale per accelerare l’iter diagnostico e impostare quanto prima la terapia adeguata per la disfunzione cardiaca sottostante. Cessare l’abuso della sostanza stupefacente rimane uno dei principali fattori prognostici in grado di favorire la reversibilità di questo tipo di cardiomiopatia3.
BIBLIOGRAFIA
[1] Kevil CG, Goeders NE, Woolard MD, Bhuiyan MS, Dominic P, Kolluru GK, Arnold CL, Traylor JG, Orr AW. Methamphetamine Use and Cardiovascular Disease. Arterioscler Thromb Vasc Biol. 2019 Sep;39(9):1739-1746. doi: 10.1161/ATVBAHA.119.312461. Epub 2019 Aug 21. PMID: 31433698; PMCID: PMC6709697.
[2] Osekowski M, Trytell A, La Gerche A, Prior D, MacIsaac A, Paratz ED. A Comprehensive Approach to Managing Methamphetamine-Associated Cardiomyopathy. Am J Cardiovasc Drugs. 2022 Jul;22(4):385-393. doi: 10.1007/s40256-022-00523-y. Epub 2022 Feb 14. PMID: 35157254.
[3] Schürer, Stephan et al. “Clinical Characteristics, Histopathological Features, and Clinical Outcome of Methamphetamine-Associated Cardiomyopathy.” JACC. Heart failure vol. 5,6 (2017): 435-445. doi:10.1016/j.jchf.2017.02.017
Embolia polmonare ad alto rischio: quando la terapia interventistica è la meno rischiosa
Laura Torlai Triglia1, Luigi Gerra1, Rachele Bertolini1, Marco Stuani1, Giulia Gorlato1, Giuseppe Boriani1
1Università degli Studi di Modena e Reggio Emilia
ABSTRACT
La prevalenza dell’embolia polmonare nel paziente oncologico è elevata, con un rischio che arriva fino al 20% nel primo anno dopo la diagnosi, a seconda del tipo di neoplasia[1]. Il tromboembolismo venoso rappresenta la seconda causa di morte nei pazienti con neoplasie a causa dei numerosi fattori di rischio trombotico[2]. L’embolia polmonare ad alto rischio nel
paziente con neoplasie cerebrali primitive o secondarie rappresenta una sfida terapeutica dato l’elevato rischio emorragico e la controindicazione assoluta alla fibrinolisi. Il trattamento percutaneo rappresenta una valida alternativa in caso di controindicazione o fallimento della terapia standard in centri con esperienza[3].
CASO CLINICO
Presentiamo il caso di un uomo di 65 anni, senza precedenti cardiologici, affetto da glioma diffuso astrocitario anaplastico recidivante trattato in precedenza con chemio e radioterapia, in evoluzione all’ultimo follow-up oncologico. Il paziente giungeva in Pronto Soccorso per
dispnea e addominalgia. All’ingresso si mostrava vigile con pressione arteriosa di 90/60 mmHg, frequenza cardiaca di 110 bpm, saturazione arteriosa 97% in aria ambiente, apiretico. Agli esami ematochimici si evidenziavano: D-dimero di 22180 ng/ml, moderata piastrinopenia (PLT 83000) e creatininemia di 1.9 mg/dl. L’emogasanalisi arteriosa era nei limiti di norma. All’elettrocardiogramma si riscontrava una tachicardia sinusale con blocco di branca destra, non noto in precedenza. La TAC del torace eseguita in regime d’urgenza evidenziava una tromboembolia polmonare con trombo non occludente disposto a cavaliere a carico dei rami
principali e multipli difetti di riempimento analoghi, non occludenti a livello delle diramazioni lobari e segmentarie di entrambi i lobi inferiore e superiore di destra (Figura 1).
polmonare.
All’ecocardiogramma le sezioni destre risultavano dilatate e ipocinetiche con vena cava inferiore di 25 mm e non collabente. La funzione ventricolare sinistra risultava invece nei limiti di norma (Figura 2). Dopo poche ore di osservazione in Pronto Soccorso, il paziente si presentava soporoso, fortemente ipoteso (PA 70/40 mmHg), oligo-anurico e con compromissione degli scambi respiratori. Pertanto, veniva trasferito presso la nostra Unità di Terapia Intensiva Cardiologica.
Visto il quadro di tromboembolia polmonare a rischio elevato in presenza di controindicazione assoluta alla terapia fibrinolitica, risultava indicato il trattamento percutaneo con trombolisi reologica mediante AngioJet.
Il caso veniva discusso collegialmente con l’Oncologo di riferimento che confermava la prognosi del paziente superiore a 12 mesi e con il Neurochirurgo che, alla luce dell’assenza di focolai emorragici all’ultima RMN encefalo, non poneva controindicazioni al trattamento percutaneo e
alla terapia anticoagulante successiva.
Il paziente veniva condotto in sala di Emodinamica dove, tramite accesso venoso femorale (8F), si eseguiva angiografia polmonare destra con evidenza di formazioni trombotiche a livello dei rami per il lobo medio e superiore. All’angiografia polmonare sinistra si evidenziavano
formazioni trombotiche a livello dei rami per il lobo inferiore e per la lingula (Figura 3 A. e C.).
AngioJet. Si noti il ripristino del circolo polmonare in particolare a livello dei campi inferiore sinistro e
superiore/medio destro.
Tramite catetere destro e guida angiografica 0.35 mm si eseguivano multipli passaggi di AngioJet in entrambi i campi polmonari destro e sinistro, con completamento a livello del tronco
dell’arteria polmonare. Le successive angiografie hanno documentato un netto incremento della perfusione dei distretti interessati e contestualmente si otteneva un miglioramento delle condizioni cliniche, della pressione arteriosa con ripresa della diuresi spontanea.
In seguito, è stata intrapresa terapia con Eparina non frazionata in infusione continua a dosaggio anticoagulante a basso range. Durante il decorso clinico si assisteva a ripristino della piastrinopenia e miglioramento della funzionalità renale, in assenza di anemia o sanguinamenti maggiori. Ottenuta la stabilità clinica e strumentale, in seguito a nuova discussione collegiale, veniva sospesa eparina e si introduceva terapia anticoagulante orale con Edoxaban 60 mg.
Il paziente è stato successivamente trasferito in Medicina Oncologica, dalla quale è stato poi dimesso al domicilio in buone condizioni generali.
CONCLUSIONI
Il trattamento percutaneo dell’embolia polmonare, come l’AngioJet ed altri
dispositivi attualmente in via di sviluppo, rappresentano una valida opzione terapeutica nel paziente ad alto rischio con controindicazione assoluta o fallimento della terapia fibrinolitica. In questi casi l’approccio interventistico può essere la scelta meno invasiva e meno rischiosa
per il paziente.
BIBILIOGRAFIA
[1] Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies. BMJ. 2020 Aug 5;370:m2177. doi: 10.1136/bmj.m2177. PMID: 32759284.
[2] Alexander R Lyon and others, 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (ICOS):
Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC), European Heart Journal, Volume 43, Issue 41, 1 November 2022, Pages 4229–4361
[3] Stavros V Konstantinides and others, 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC), European Heart Journal, Volume 41, Issue 4, 21 January 2020, Pages 543–603
[4] Ajar Kochar , Brian A Bergmark, Catheter-directed interventions for pulmonary embolism, European Heart Journal. Acute Cardiovascular Care, Volume 11, Issue 9, September 2022, Pages 721–727
[5] AngioJet thrombectomy. Lee MS, Singh V, Wilentz JR, Makkar RR. s.l. : J Invasive Cardiol, 2004 Oct, Vol. 16(10):587–91.
Diverticolo congenito del ventricolo sinistro: Utilizzo dell’imaging multimodale per la diagnosi e la stratificazione del rischio
Marcello Cosenza1,2, Michele Morosato1,2 , Gabriele Paci1,2, Eustachio Agricola1,2 , Federico Biondi1
1Unità di Imaging Cardiovascolare, IRCCS Ospedale San Raffaele, Milano, IT
2Università Vita-Salute San Raffaele, Milano, IT
ABSTRACT
I diverticoli o aneurismi congeniti del ventricolo sinistro costituiscono un’entità rara con poche centinaia di casi riportati in letteratura, la cui diagnosi è per lo più incidentale. Le possibili complicanze comprendono la rottura, le aritmie ventricolari, il tromboembolismo, lo sviluppo di scompenso cardiaco congestizio e la morte cardiaca improvvisa. Descriviamo il caso di un giovane di 21 anni giunto alla nostra osservazione per riscontro occasionale di multipli diverticoli del ventricolo sinistro in corso di accertamenti per idoneità sportiva. Un approccio imaging multimodale, integrato dalla caratterizzazione tissutale mediante biopsia endomiocardica, ha permesso di giungere alla diagnosi ed ha guidato la successiva gestione clinico-terapeutica.
CASO CLINICO
Descriviamo il caso di un ragazzo di 21 anni, giunto alla nostra osservazione per eseguire accertamenti a seguito del riscontro di anomalie elettrocardiografiche durante visita per idoneità sportiva (Figura 1).
Dalla raccolta anamnestica emergeva familiarità per cardiopatia ischemica precoce (padre sottoposto a bypass aorto-coronarico all’età di 36 anni), in assenza di ulteriori fattori di rischio cardiovascolari. Non era presente familiarità per morte cardiaca improvvisa o cardiomiopatie. Il paziente si presentava asintomatico per angor a riposo o sotto sforzo senza storia di palpitazioni o sincope.
L’ecocardiogramma transtoracico riscontrava lieve disfunzione sistolica e dilatazione del ventricolo sinistro (FEVsx 47%, VTDi 80 ml/mq), in presenza di ampio aneurisma coinvolgente la parete anterolaterale con marcata trabecolatura al suo interno ed ulteriore piccolo aneurisma dell’apice vero. Contestualmente si evidenziavano ipertrofia, apicalizzazione ed impianto anomalo del muscolo papillare anterolaterale a livello del segmento basale della parete laterale in assenza di significativa ipertrofia parietale; ponti muscolari e cordali a partenza dal setto interventricolare ad inserzione sul muscolo papillare anterolaterale; lembi mitralici dismorfici con ipoplasia del lembo posteriore e allungamento dell’anteriore, corde corte, in assenza di insufficienza significativa (Figura 2).
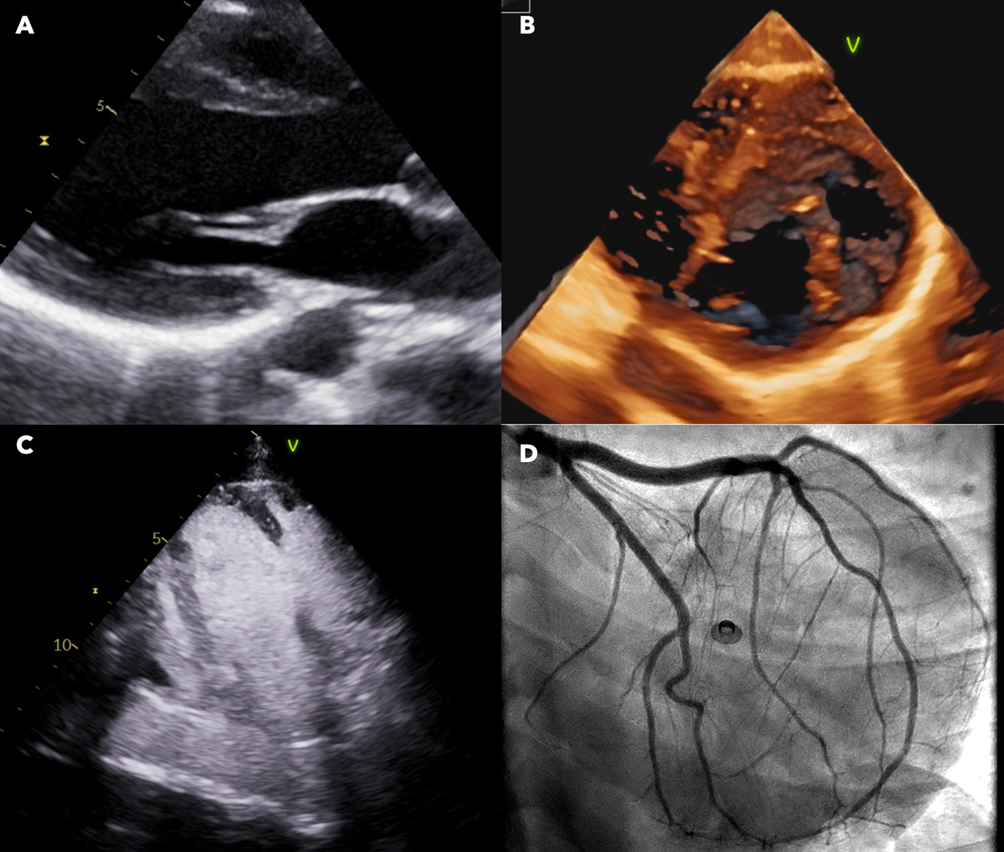
Ventricolo destro nei limiti per dimensioni e funzione. Veniva inoltre eseguito ecocardiogramma sotto sforzo, massimale per frequenza cardiaca raggiunta, risultato negativo per aritmie da sforzo e nel recupero.
Alla cine-RMN cuore con mezzo di contrasto si confermava la presenza di multipli diverticoli/aneurismi della parete anteriore del ventricolo sinistro, a parete assottigliata e con ridotta ma presente contrattilità, estesi dal passaggio basale-medio al passaggio medio-apicale (6.5 x 4 x 2.5 cm) determinanti lieve riduzione della funzione sistolica globale in assenza di asinergie dei restanti segmenti. Normale massa miocardica. Normali valori di tempo di rilassamento T1 e T2 ed assenza di edema o di late gadolinium enhancement (LGE).
Si procedeva a ventricolografia e coronarografia che documentava coronarie epicardiche indenni da lesioni stenosanti ed assenza di ponti miocardici.
A completamento diagnostico è stata eseguita biopsia endomiocardica del ventricolo destro che evidenziava cardiomiociti di normale morfologia, senza evidenza istologica di cellule infiammatorie, fibrosi sostituiva o necrosi su quattro campioni prelevati.
Veniva inoltre eseguito test genetico per ricerca di mutazioni geniche note associate a cardiomiopatie, attualmente ancora in corso.
Vista l’anamnesi familiare negativa per storia di cardiomiopatia o di morte cardiaca improvvisa, l’assenza di sintomi di pertinenza cardiologica nonostante una vita attiva (paziente sportivo, calciatore), la RMN e la biopsia endomiocardica entrambe negative per alterazioni di tipo infiammatorio/sostitutivo a carico del miocardio, l’assenza di aritmie al monitoraggio elettrocardiografico a riposo e alle prove da sforzo è stato deciso collegialmente di avviare il paziente a stretto follow-up ambulatoriale con idoneità ad eseguire attività sportiva non agonistica.
DISCUSSIONE
I diverticoli o aneurismi congeniti del ventricolo sinistro sono una rara entità (prevalenza stimata nella popolazione generale del 0.04% – 0.76%) [1] di cui sono descritti poche centinaia di casi in letteratura sin dalla loro prima descrizione nel 1816 e si presentano frequentemente associati ad altre malformazioni cardiache (valvolari, strutturali o coronariche), vascolari ed extra-cardiache [2].
L’origine sembra essere un difetto del differenziamento embrionale del tubo endocardico a partire dalla quarta settimana di gestazione [3]. La sede più frequente di localizzazione è l’apice del ventricolo sinistro (60% dei casi), seguito dalla regione sub-mitralica [2].
La maggior parte dei pazienti sono asintomatici e la diagnosi è incidentale; ciò giustifica l’età tardiva alla diagnosi, riportata intorno ai 30 anni. Le possibili complicanze includono la rottura, riportata nel 4% dei casi, le aritmie ventricolari, stimate avere un’incidenza tra il 9 e il 18%, il tromboembolismo (3-5% dei casi) e lo sviluppo in età avanzata di scompenso cardiaco congestizio, che coinvolge tra il 7% e il 21% dei pazienti [2].
In assenza di un gold-standard, la diagnosi avviene per esclusione e l’imaging multimodale è chiave per distinguere questa entità dai più comuni aneurismi/pseudo-aneurismi ad eziologia ischemica, infiammatoria (miocarditi, malattia di Chagas), autoimmune (malattia di Kawasaki, Sarcoidosi, malattie del tessuto connettivo) o quali manifestazione di cardiomiopatie [2][4][5]. In mancanza di linee guida specifiche, il trattamento è strettamente individualizzato e orientato dalla modalità di presentazione [3]. Le opzioni chirurgiche comprendono l’aneurismectomia o la sutura diretta dell’orifizio associata alla correzione di eventuali cardiopatie associate. Nel caso di eventi tromboembolici è raccomandata la terapia anticoagulante orale, mentre in pazienti con sincopi o tachicardie ventricolari ad origine dal tessuto peri-aneurismatico è indicato l’impianto di defibrillatore ed eventualmente lo studio elettrofisiologico con ablazione mediante radiofrequenze del substrato aritmico. Nei restanti casi uno stretto follow-up clinico-strumentale è indicato con buoni risultati a distanza [3] [6].
CONCLUSIONI
I diverticoli/aneurismi congeniti del ventricolo sinistro costituiscono un’entità rara. Il ricorso all’ imaging multimodale è imperativo per giungere alla diagnosi, per una corretta stratificazione prognostica e per la successiva gestione terapeutica. In assenza di linee guida specifiche, il trattamento deve essere individualizzato e guidato dalla presentazione clinica.
BIBLIOGRAFIA
[1] Ohlow MA, Lauer B, Geller JC. Prevalence and spectrum of abnormal electrocardiograms in patients with an isolated congenital left ventricular aneurysm or diverticulum. Europace. 2009;11(12):1689-1695. doi:10.1093/europace/eup323
[2] Ohlow MA, von Korn H, Lauer B. Characteristics and outcome of congenital left ventricular aneurysm and diverticulum: Analysis of 809 cases published since 1816. Int J Cardiol. 2015;185:34-45. doi:10.1016/j.ijcard.2015.03.050
[3] Ohlow MA. Congenital left ventricular aneurysms and diverticula: an entity in search of an identity. J Geriatr Cardiol. 2017;14(12):750-762. doi:10.11909/j.issn.1671-5411.2017.12.005
[4] Ohlow MA. Congenital left ventricular aneurysms and diverticula––Definition, pathophysiology, clinical relevance and treatment. Cardiology. 2006;106:63–72.
[5] Ruiz-Esparza E, Roldan FJ, Vazquez-Antona C, et al. 2D and 3D echocardiography of a left ventricular diverticulum. Echocardiography. 2009;26:1087–1088
[6] Haegeli LM, Ercin E, Wolber T, et al. Arrhythmic manifestations in patients with congenital left ventricular aneurysm and diverticula. Am J Cardiol. 2011;108:1826–1830
Riscontro occasionale di trombo in auricola atriale destra in un giovane paziente con scompenso cardiaco congestizio e in ritmo sinusale
Cinzia Pece1,2, Denisa Muraru1,2, Michele Tomaselli1,2, Francesco Paolo Perelli1,2, Noela Radu3
1 University of Milano-Bicocca, Milan, Italy
2 Istituto Auxologico Italiano, IRCCS, San Luca Hospital, Milan, Italy
3 Carol Davila University of Medicine and Pharmacy, Prof. Dr. C. C. Iliescu Institute, Bucharest, Romania
ABSTRACT
L’ amiloidosi cardiaca (CA) è una malattia infiltrativa caratterizzata dalla deposizione di aggregati di fibrille amiloidi nel miocardio. La diagnosi di CA richiede un approccio completo basato su esame fisico, esami di laboratorio, imaging multimodale e istologia. La CA è associata ad un aumento del rischio tromboembolico (TE), anche nei pazienti con ritmo sinusale. La particolarità del nostro caso è il riscontro incidentale di un trombo in auricola atriale destra in un paziente con amiloidosi cardiaca estesa e insufficienza cardiaca senza alcuna evidenza di aritmia atriale, ma con segni all’imaging suggestivi di una “miopatia” atriale bilaterale e disfunzione biventricolare.
PRESENTAZIONE CASO CLINICO
Il protagonista del caso clinico è un uomo di 47 anni con una recente storia clinica di scompenso cardiaco congestizio trattato con diuretici presso un Presidio Ospedaliero periferico, il quale giungeva alla nostra attenzione per eseguire una TC coronarica. La CCT mostrava assenza di malattia aterosclerotica coronarica significativa e rilevava una regione ipodensa in corrispondenza dell’auricola atriale destra (RAA), sollevando il sospetto di un trombo. Il paziente pertanto è stato ricoverato presso il reparto di Cardiologia Acuti dell’Ospedale Auxologico San Luca di Milano per eseguire maggiori accertamenti.
WORK UP DIAGNOSTICO INIZIALE
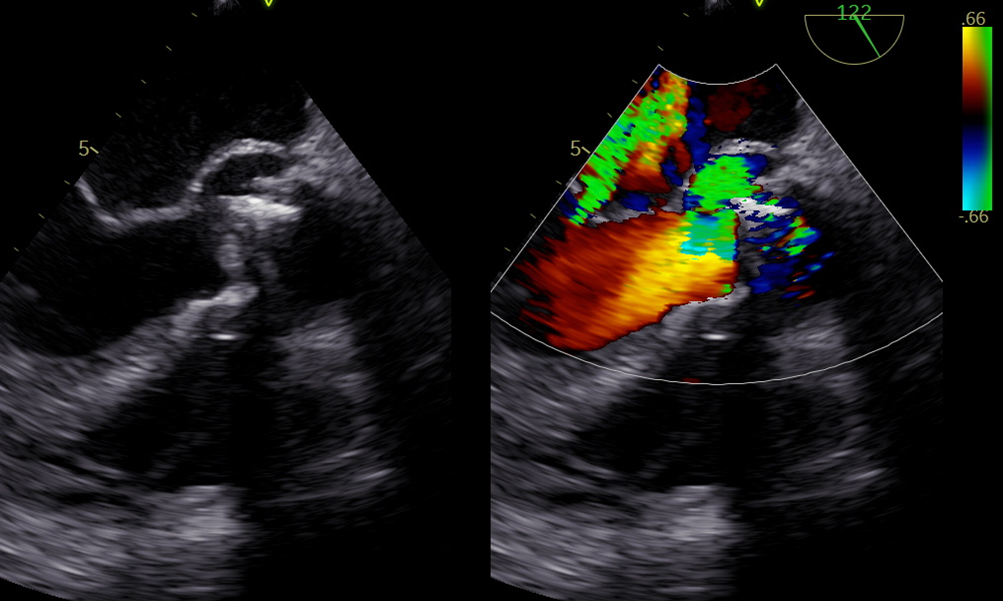
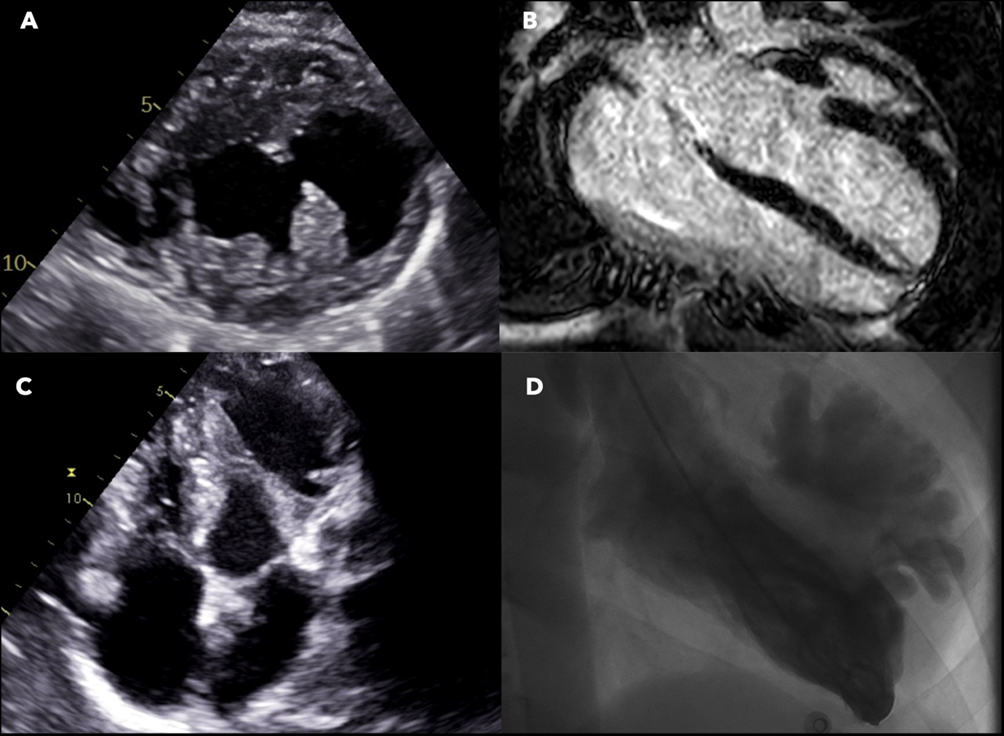
Alla visita il paziente era sintomatico per dispnea ai minimi sforzi e dolore toracico e presentava edemi declivi e turgore giugulare. L’elettrocardiogramma (ECG) mostrava tachicardia sinusale, assente progressione dell’onda R nelle derivazioni precordiali e onde T negative in sede inferolaterale. I primi test di laboratorio hanno mostrato aumento dei livelli di BNP (766 ng/L), troponina (hsTnT 19 ng/L) e ALT (94 U/L). L’ecocardiogramma transtoracico (TTE) ha rivelato un’ipertrofia concentrica significativa del ventricolo sinistro (massimo spessore del setto interventricolare 20 mm, spessore relativo della parete 0,74, massa LV 177 g/m 2) con aspetto del miocardio a ‘’granular-sparkling’’ e FEVS lievemente ridotta. La deformazione miocardica longitudinale del ventricolo sinistro era gravemente compromessa (GLS = -9,5%), con aumento del rapporto di deformazione apice-base (4,4) indicativo di pattern “apical sparing “. Per quanto riguarda la funzione diastolica si registrava un pattern transmitralico di tipo restrittivo (E/A = 2,1, E/e’ = 20), dilatazione bi-atriale con reservoir strain atriale ridotto, setto interatriale ispessito e valvole atrio-ventricolari anch’esse ispessite senza rigurgiti significativi (Figura 1). Infine, anche il ventricolo destro aveva pareti ispessite e segni di disfunzione sistolica (deformazione della parete libera del RV, RVFWS = -15,2%; EF 3D = 40,9%; TAPSE = 11 mm). Il 3DTTe ha mostrato anche una valvola tricuspide con morfologia quadricuspide (tipo IIIb – due lembi posteriori) (Figura 2).
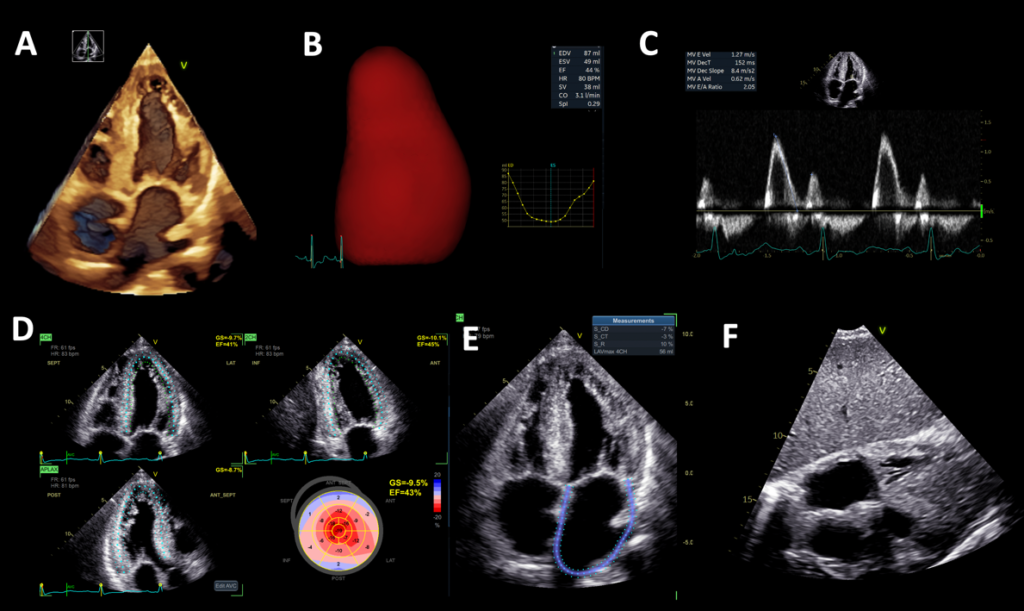
Figura 1. Panel A, 3DTTE sezione apicale 4 camere che mostra aumento diffuso dello spessore del ventricolo sinistro, ingrandimento biatriale e aumentato spessore dei lembi mitralici.
Panel B, TTE quantificazione volumetrica 3D del ventricolo sinistro, che mostra una piccola cavità ventricolare con ridotto stroke volume e LVEF lievemente ridotta (44%).
Panel C, Pattern di flusso transmitralico restrittivo.
Panel D, GLS ridotto (-9,5%) con pattern di risparmio apicale.
Panel E, Atrio sinistro dilatato con marcata riduzione dei parametri di deformazione longitudinale (reservoir strain serbatoio 10%).
Panel F, TTE sezione sottocostale, ispessimento del setto interatriale.
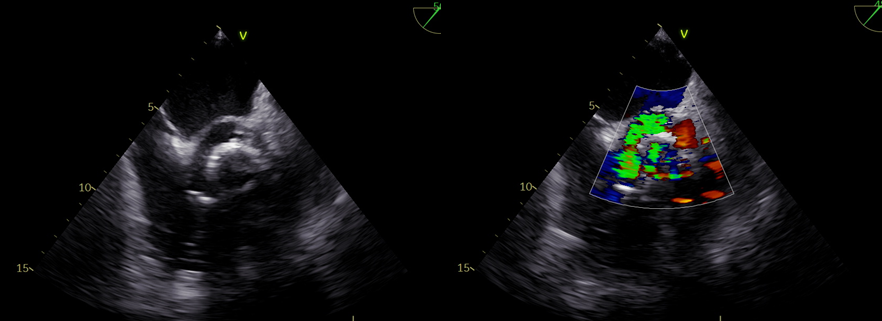
L’ecocardiogramma transesofageo (TEE) ha confermato la presenza di una massa mobile rotondeggiante di 14 x 12 mm in RAA compatibile con formazione trombotica (Figura 2). L’appendice atriale sinistra invece era priva di trombi, con contrazione ritmica e ridotta velocità di svuotamento (37 cm/s).
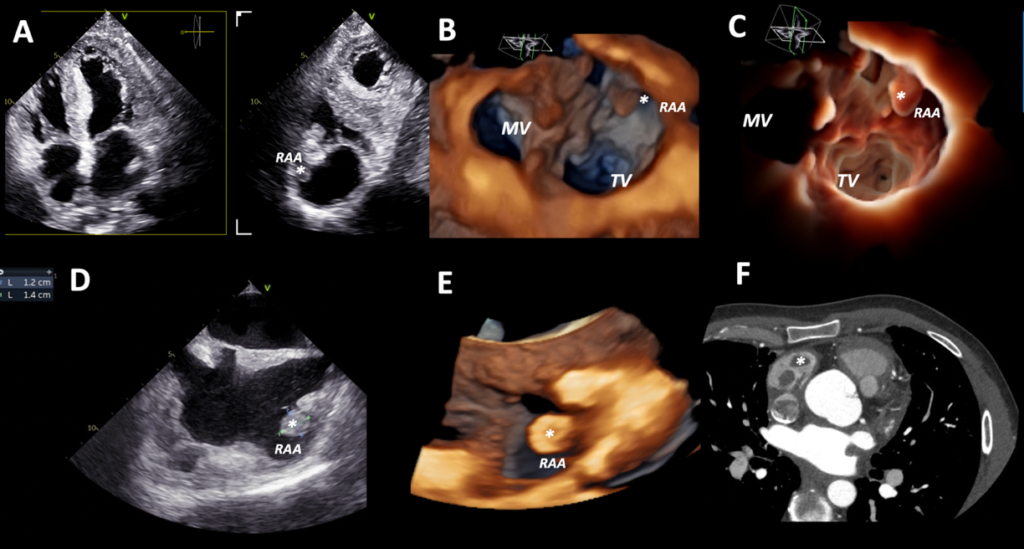
Figura 2. Panel A, 2DTTE (sezioni apicale 4-camere e 2-camere ortogonale) che mostra una massa suggestiva per trombo (asterisco) al livello di RAA nella sezione 2-camere.
Panel B, 3DTTE visione chirurgica dell’atrio destro che mostra una massa sporgente nella cavità atriale destra proveniente dall’auricola destra (asterisco).
Panel C, 3DTTE visione chirurgica atrio destro ottenuta con nuovo filtro ‘transillumination’ in flexi-light focalizzato su atrio destro, che mostra in modo più netto la morfologia della massa e la sua localizzazione spaziele in RAA (asterisco).
Panel D, massa in RAA visualizzata in TEE sezione bicavale; si nota il marcato ispessimento del setto interatriale che risparmia la fossa ovale.
Panel E, trombo visualizzato in 3DTEE.
Panel F, trombo visualizzato alla CCT.
DIAGNOSI E GESTIONE
Dato l’alto sospetto di malattia infiltrativa, è stata eseguita la Risonanza Magnetica Cardiaca (CMR) per la caratterizzazione tissutale, come raccomandato dal Position Statement del 2021 dell’ESC Working Group sulle malattie del Miocardio e del Pericardio (1). L’esame ha confermato lo spessore diffusamente aumentato di entrambi i ventricoli e una lieve disfunzione biventricolare (LVEF per CMR 48%, RVEF per CMR 46%). Inoltre, l’indagine ha mostrato un diffuso LGE, un marcato aumento del volume extracellulare (49%) e dei valori di T1 mapping (valori globali 1110 ± 76 ms) (Figura 3). Inoltre, si riscontravano versamento pleurico bilaterale e minimo versamento pericardico. Questi reperti sono altamente indicativi di CA, per cui, al fine di determinarne il fenotipo, abbiamo deciso di eseguire la scintigrafia con bifosfonati, che ha mostrato una captazione miocardica di radiotracciante di grado inferiore rispetto a quello osseo (Perugini Grado 1): pattern non specifico per l’amiloidosi ATTR ma che non ha escluso un’amiloidosi AL. Ulteriori test di laboratorio hanno mostrato catene leggere tipo lambda (FLC) aumentate con rapporto FLC kappa-lambda ridotto. A questo punto la biopsia extracardiaca si è rivelata decisiva per la diagnosi di amiloidosi AL, risultando positiva per sostanza amiloide. Per concludere, la biopsia del midollo osseo ha riscontrato un sottostante mieloma multiplo. Data l’evidenza di trombo RAA, è stata intrepresa la terapia anticoagulante con eparina a basso peso molecolare embricata con warfarin ed è stata impostata terapia medica con diuretici e beta-bloccante. Il paziente si è mantenuto in ritmo sinusale durante tutto il ricovero.
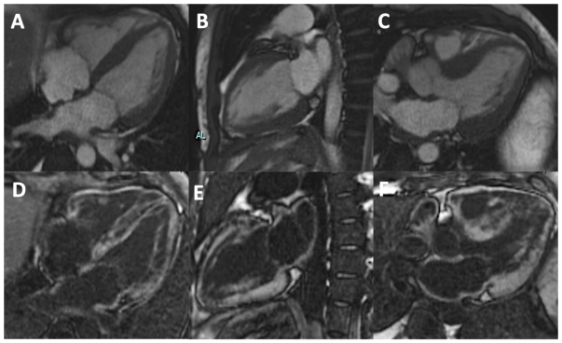
Figura 3. Cine CMR 4-camere, 2-camere, 3-camere (Panels A-C) e immagini PSIR MOCO LGE (Panels D-F) che mostrano segni caratteristici di CA: diffuso aumento dello spessore biventricolare, atri dilatati, esteso delayed enhancement (LGE) che coinvolge tutte le camere cardiache e minimo versamento pericardico.
FOLLOW UP
Il paziente è stato trasferito presso un centro specializzato in amiloidosi, in cui ha intrapreso trattamento chemioterapico dedicato.
CONCLUSIONI
La CA è una malattia infiltrative caratterizzata dalla deposizione di aggregate di fibrille amiloidi nel miocardio. É chiamata ‘il grande mimo’ per per le somiglianze con la cardiomiopatia ipertrofica geneticamente determinate e le malattie da accumulo (2). La diagnosi di CA richiede un alto indice di sospetto e, in quell caso, è relativamente semplice diagnosticarla grazie alla disponibilità di indagini diagnostiche di imaging multimodale.
La CA è associata ad aumentato rischio tromboembolico, anche in pazienti con ritmo sinusale. I fattori di rischio per trombi intracardiaci sono: il sottotipo AL, la disfunzione biventricolare, fibrillazione atriale, miopatia atriale, elevato volume extracellulare alla CMR (3).
Attualmente, le principali indicazioni per una terapia anticoagulante a lungo termine in questi pazienti sono la fibrillazione atriale (indipendentemente dal CHADS2-VaSC score), trombosi venosa profonda e/o embolia polmonare, sindrome nefrosica e trombi intracardiaci riscontrati accidentalmente durante un esame strumentale (4).
In ogni caso, bisogna considerare anche il rischio emorragico, che è aumentato nei pazienti con sottotipo AL con coinvolgimento epatico o gastrointestinale, disordini della coagulazione, insufficienza renale e in trattamento chemioterapico.
BIBLIOGRAFIA
- Garcia-Pavia P., Rapezzi C., Adler Y., Arad M., Basso C., Brucato A., et al. Diagnosis and treatment of cardiac amyloidosis. A position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur J Heart Fail. 2021 Apr; 23(4):512-526.
- Rapezzi, C., Lorenzini, M., Longhi, S., et al. Cardiac amyloidosis: the great pretender. Heart Failure Reviews 20, 117-124 (2015).
- Nicol M., Siguret V., Vergaro G., et al. Thromboembolism and bleeding in systemic amyloidosis: a review. ESC Heart Failure. 2022 Feb; 9(1): 11-20.
- Nicol M, Siguret V, Vergaro G, Aimo A, Emdin M, Dillinger JG, et al. Thromboembolism and bleeding in systemic amyloidosis: a review. ESC Heart Fail. 2022 Feb;9(1):11-20.
HETEROGENEOUS ARRHYTHMIC PHENOTYPE IN A CASE OF LVNCC
N. Ferrara, S. Bonanno, P. Crea, G.Dattilo, F. Luzza, S. Carerj, A. Micari, G. Di Bella
Dipartimento di Medicina Clinica e Sperimentale, Cardiologia con UTIC
Università di Messina
ABSTRACT
Le manifestazioni sincopali, talvolta di natura aritmica, sottendono spesso forme parossistiche di bradiaritmie, come i disturbi della conduzione, sebbene possano anche essere causate da eventi tachiaritmici, tra cui tachicardie ventricolari rapide life-threatening. In alcuni casi, tuttavia, nascondono fenotipi aritmici eterogenei e del tutto inattesi, che richiedono un adeguato approfondimento diagnostico, così come osservato nel seguente caso di cardiomiopatia da ventricolo sinistro non-compatto.
CASO CLINICO
Presentiamo il caso di una giovane donna di 47 anni, ricoverata presso il nostro dipartimento per essere sottoposta ad Head Up Tilt Test ed a studio elettrofisiologico (SEF), indicati per approfondimento diagnostico a seguito di ricorrenti episodi sincopali traumatici. Tale indicazione era stata posta sia in virtù della storia familiare, positiva per la morte improvvisa della madre in giovane età, che per un esame Holter ECG, che documentava un breve run di tachicardia ventricolare polimorfa.
L’ECG a 12 derivazioni, così come l’ETT, non mostravano alterazioni patologiche. Inoltre, l’Head-up Tilt Test è risultato negativo per l’induzione di sincope. Tuttavia, durante la degenza, la paziente ha improvvisamente lamentato uno stato di malessere a riposo, rapidamente evoluto in sincope: la valutazione della traccia elettrocardiografica al monitor mostrava la presenza di due pause rispettivamente di 3,8 e 5,1 sec. (figura 1) causate da blocco atrio-ventricolare di III grado parossistico.
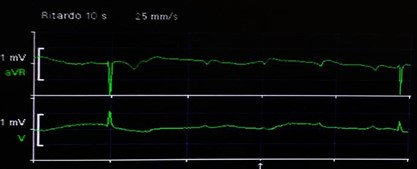
Il giorno dopo, la paziente è stata quindi sottoposta a studio elettrofisiologico. Durante stimolazione programmata dall’apice del ventricolo destro con doppio extrastimolo si è indotta una fibrillazione ventricolare sincopale (figura 2), prontamente trattata con DC shock.
In considerazione della storia di sincopi traumatiche, la paziente è stata quindi sottoposta ad impianto di ICD endocavitario bicamerale; nei sei mesi di follow-up seguenti non sono stati segnalati nuovi eventi clinici.
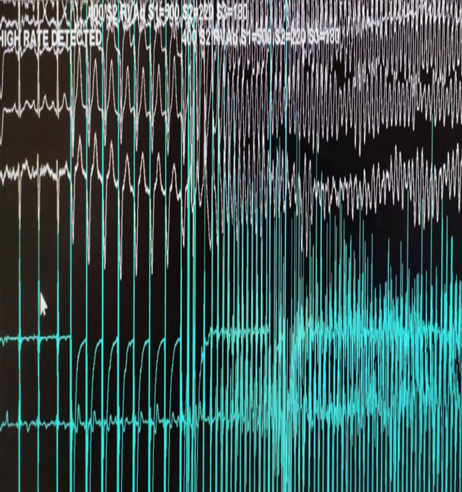
DISCUSSIONE
Quale poteva essere la causa di tale fenotipo clinico aritmico eterogeneo con associazione di blocco AV e aritmie ventricolari in una paziente giovane? A darci una risposta è stata la risonanza magnetica cardiaca (figura 3),
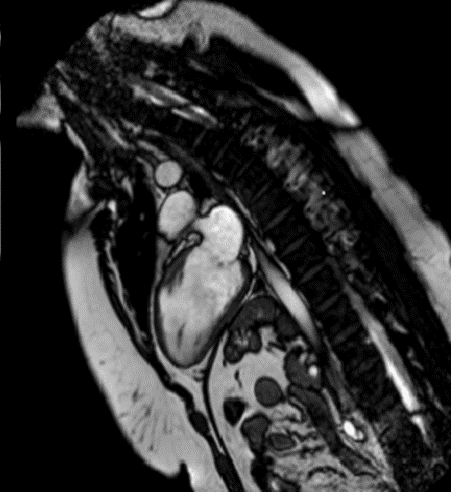
che ha mostrato segni diagnostici di Left Ventricular non-Compaction Cardiomyopathy (LVNCC). Con il termine di Left Ventricular Non-Compaction si identifica una cardiomiopatia che da un punto di vista fisiopatologico è caratterizzata dall’arresto intrauterino del processo di compattazione del miocardio ventricolare, portando allo sviluppo di trabecole prominenti del ventricolo sinistro e recessi intertrabecolari, tali da suddividere la parete ventricolare in due diversi strati di miocardio, quello compatto e quello non compatto. La LVNCC è stata associata alla mutazione di più di 40 geni e a vari difetti cromosomiali, sebbene una relazione causale debba ancora essere stabilita. In particolare, le mutazioni descritte includono geni mitocondriali, proteine del citoscheletrico e proteine sarcomeriche con trasmissione autosomica dominante, recessiva o X-linked. Questa entità nosologica è di difficile interpretazione soprattutto da un punto di vista delle implicazioni cliniche, spesso imprevedibili. Esistono, infatti, forme del tutto asintomatiche, che secondo alcuni autori vanno considerate come varianti normali e totalmente benigne, e forme in cui la mancanza di compattazione rappresenta un tratto morfologico condiviso con altri fenotipi, come l’ipertrofico, il dilatativo o il restrittivo. Clinicamente, le principali manifestazioni in caso di LVNCC sono la disfunzione ventricolare (in tal senso rappresenta una delle più frequenti cause di scompenso cardiaco in età pediatrica), gli eventi tromboembolici e le aritmie, spesso ventricolari e life-threatening. Un largo spettro aritmico è associato a questa cardiomiopatia. Si segnalano infatti: tachicardie sopraventricolari e ventricolari, sindrome di Wolff-Parkinson-White, ma anche bradiaritmie, come bradicardia sinusale, sick sinus syndrome e vari gradi di blocco atrio-ventricolari, fino al blocco completo. Le tachicardie ventricolari, includendo quelle che progrediscono in fibrillazione ventricolare, si verificano nel 38–47% dei pazienti adulti con LVNCC, per cui la morte improvvisa è spesso la prima manifestazione. Viste le caratteristiche della patologia, aspetti importanti nella gestione del paziente includono il raggiungimento di una diagnosi precoce, attraverso metodiche di imaging come la RMN cardiaca (tutt’ora il Gold Standard) e l’Ecocardiogramma Transtoracico (spesso con l’ausilio del mezzo di contrasto), e lo screening familiare associato a adeguato counselling genetico, per la prevenzione della morte improvvisa.
BIBLIOGRAFIA
1. Corrado D, Basso C, Thiene G, McKenna WJ, Davies MJ, Fontaliran F, et al. Spettro delle manifestazioni clinicopatologiche della cardiomiopatia/displasia ventricolare destra aritmogena: uno studio multicentrico. J Am Coll Cardiol. 1997; 30: 1512-20.
2. McKenna WJ, Thiene G, Nava A, Fontaliran F. Blomstrom-Lundqvist C, Fontaine G, et al. per conto del Working Group Myocardial and Pericardial Disease of the European Society of Cardiology e del Scientific Council on Cardiomyopathies of the International Società e Federazione di Cardiologia, sostenuta dall’Associazione Schoepfer. Diagnosi di displasia/cardiomiopatia aritmogena del ventricolo destro. Br Cuore J 1994; 71: 215-218.
3. Arbustini E, Favalli V, Narula N, Serio A, Grasso M. Left Ventricular Noncompaction: A Distinct Genetic Cardiomyopathy? J Am Coll Cardiol. 2016 Aug 30;68(9):949-66. doi: 10.1016/j.jacc.2016.05.096. Erratum in: J Am Coll Cardiol. 2016 Oct 18;68(16):1821. PMID: 27561770.