Il ritorno venoso anomalo parziale delle vene polmonari: gestione di una serendipity
Enrico Maggioa, Jean Pierre Jabboura, Gianmarco Scocciaa, Roberto Badagliaccaa
aDipartimento di Scienze Cliniche Internistiche, Anestesiologiche e Cardiovascolari, Università La Sapienza di Roma
BACKGROUND
Le connessioni venose polmonari anomale totali (TAPVC) e parziali (PAPVC) rappresentano anomalie rare caratterizzate da una connessione anomala di alcune (PAPVC) o di tutte (TAPVC) le vene polmonari che, anziché drenare nell’atrio sinistro, drenano direttamente o meno nell’atrio destro. [1, 2] La PAPVC può essere distinta in tipo unilaterale a ramo singolo, tipo unilaterale a 2 rami e tipo bilaterale a ramo singolo, [3] ed il tipo più comune è rappresentato da una vena polmonare anomala del lobo superiore destro che drena nella vena cava superiore o nell’atrio destro, [4] con uno shunt da sinistra a destra.
CASO CLINICO
Paziente di 75 anni ricoverato presso il nostro centro di riferimento per l’ipertensione arteriosa polmonare (IAP), per sospetta IAP all’ecocardiogramma eseguito presso un’altra sede. All’ecocardiogramma transtoracico (ETT) veniva riscontrata una dilatazione delle sezioni cardiache destre e una insufficienza tricuspidalica di grado moderato-severo da dilatazione dell’annulus valvolare (gradiente trans-tricuspidalico 41 mmHg, vena cava inferiore dilatata ed ipocollassabile, PAPs 61mmHg) con buona la funzione sistolica del ventricolo destro (VD) (TAPSE 30mm, S’ 13cm/s). Veniva pertanto programmato un cateterismo cardiaco destro ed il work up diagnostico dell’ipertensione polmonare.
Nell’anamnesi del paziente risultavano salienti una cardiopatia ischemico-ipertensiva cronica trattata mediante angioplastica percutanea e impianto di uno stent a livello dell’arteria discendente anteriore e uno a livello del primo ramo diagonale nel 2017, gammopatia monoclonale di significato incerto, pregressa infezione da HBV ed un disturbo dell’eloquio in follow-up neurologico. All’esame obiettivo l’unico riscontro degno di nota era rappresentato da un soffio III/VI Levine meglio udibile sul focolaio tricuspidalico. L’ECG mostrava un blocco di branca destro incompleto.
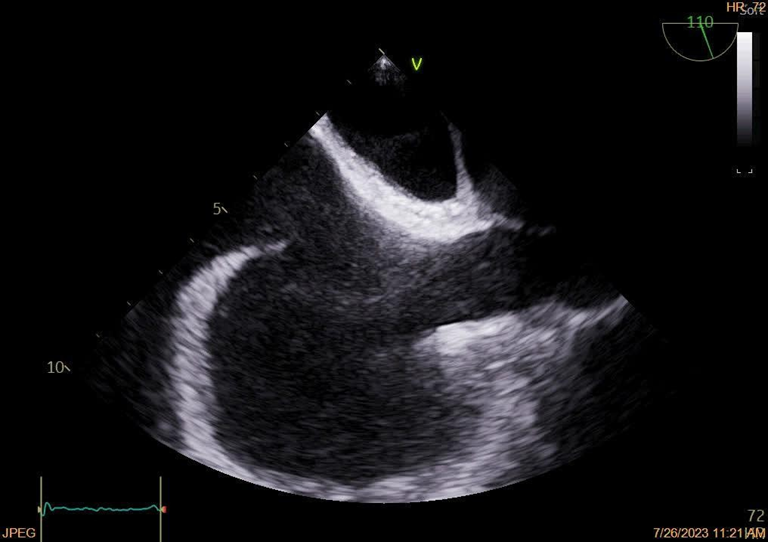
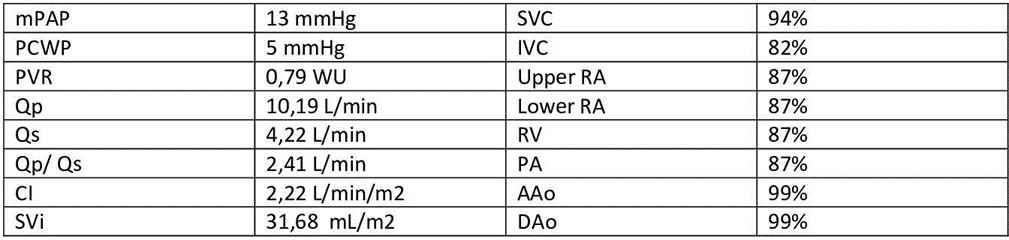
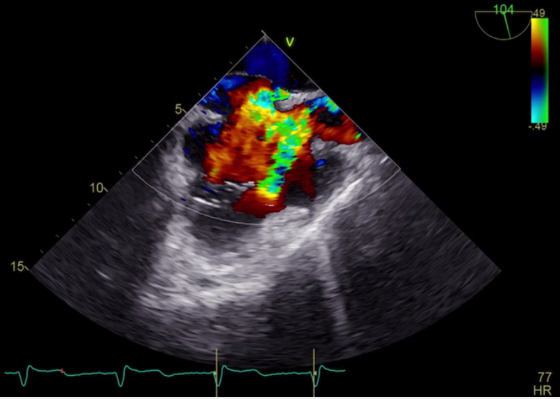
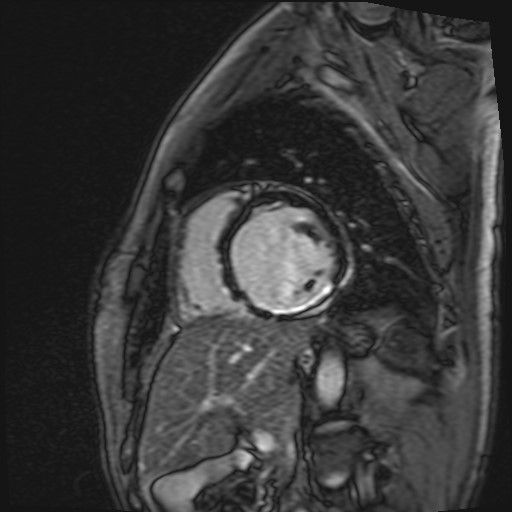
Il cateterismo del cuore destro escludeva un quadro d’ipertensione polmonare (PAPm 13mmHg, PAPs 26mmHg, PVR <2WU) ma alla valutazione ossimetrica metteva in evidenza un sospetto di shunt sinistro-destro (Fig. 1). In considerazione di tale riscontro, l’iter diagnostico proseguiva con l’esecuzione di un ecocardiogramma trans-esofageo (ETE) che escludeva la presenza di difetti intracardiaci del setto interatriale (SIA) e del setto interventricolare (SIV) (Fig. 2), ma in cui non risultava visibile lo sbocco della vena polmonare superiore sinistra e della vena polmonare superiore destra nell’atrio sinistro. In considerazione di tale quadro ecocardiografico non era possibile escludere la presenza di un ritorno venoso anomalo delle vene polmonari. Gli elevati livelli ossimetrici riscontrati in vena cava superiore (VCS) ponevano l’ipotesi di uno shunt localizzato a monte dell’atrio destro, in virtù del quale si decideva di proseguire l’iter con l’esecuzione di un’angioTC del torace.
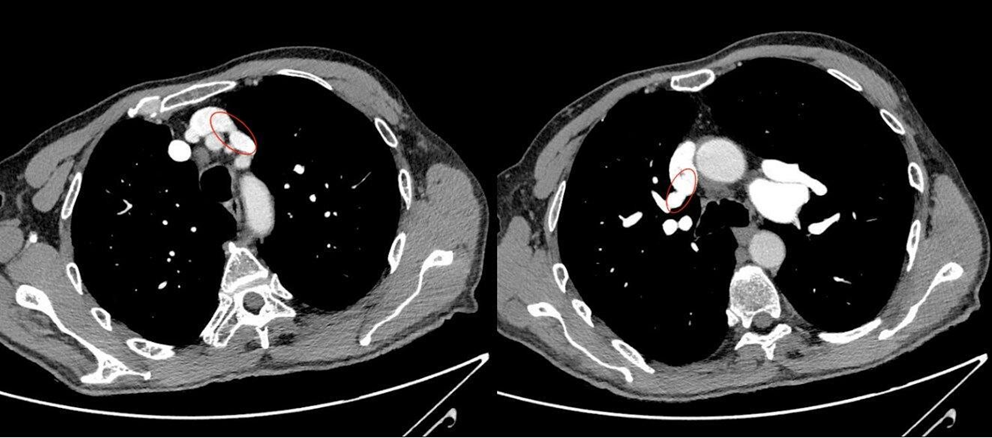
Tale indagine strumentale documentava un anomalo drenaggio della vena polmonare superiore di sinistra nella vena brachiocefalica sinistra, e della vena polmonare superiore destra nella vena cava superiore (Fig. 3). Inoltre, una scintigrafia polmonare perfusionale svolta per escludere possibili forme di pregresse embolie polmonari (e valutare quindi il carico di morbidità) evidenziava un’ ipoperfusione a carico dei versanti mediali dei segmenti antero-basale e postero-basale del lobo inferiore destro ed un’ ipoperfusione del segmento apicale del lobo superiore sinistro con presenza di deficit a carattere cuneiforme localizzato a livello del segmento anteriore. Per una corretta valutazione dell’impatto emodinamico di tale shunt sulla capacità funzionale e per escludere un’ipertensione polmonare indotta da sforzo, si sottoponeva il paziente a test cardiopolmonare. A tale prova, il paziente mostrava un’ottima capacità d’esercizio (VO2 picco pari al 100% del predetto 24 ml/min/kg per un quoziente respiratorio pari a 1,12) una normale soglia anaerobica raggiunta al 50% del VO2 max predetto, un polso dell’ossigeno sempre crescente pari al 117% del predetto, una normale efficienza di lavoro aerobico (VO2/WR pari a 10 ml/min/Watt) e l’assenza di segni di barrage polmonare (VE/VCO2 slope pari a 29). Nonostante il Qp/Qs > 1,5 e le PVR < 5 WU, in considerazione dell’età del paziente e dell’ottima capacità funzionale mostrata al test cardiopolmonare l’Heart Team del nostro ospedale decideva di non procedere con la correzione chirurgica del difetto, anche in virtù dell’elevata complessità tecnica e dei rischi perioperatori.
CONCLUSIONE
In conclusione, è importante ricordare che anche in presenza di segni ecocardiografici d’ ipertensione polmonare, essa può non essere presente, e che non sempre il valore di PAPs riscontrato all’ecocardiogramma risulta concordante con quello registrato dalle metodiche invasive (per possibile sotto-/sovrastima sia all’ecografia, in virtù dell’allineamento al flusso e delle caratteristiche del rigurgito e dell’anatomia, sia al cateterismo destro, in virtù di possibili errori di calibrazione). È infine importante tenere a mente che i difetti congeniti non sempre vengono diagnosticati in età giovanile (specialmente se asintomatici) e, quindi, non è da escludere a priori la loro presenza nel paziente geriatrico. Un’ attenta interpretazione dei valori ossimetrici riscontrati durante il cateterismo destro può rilevare una cardiopatia congenita non identificabile mediante le metodiche diagnostiche di I livello.
BIBLIOGRAFIA
- Tarniceriu, C.C., et al., The Pulmonary Venous Return from Normal to Pathological-Clinical Correlations and Review of Literature. Medicina (Kaunas), 2021. 57(3).
- Paladini, D., et al., Prenatal diagnosis of total and partial anomalous pulmonary venous connection: multicenter cohort study and meta-analysis. Ultrasound Obstet Gynecol, 2018. 52(1): p. 24-34.
- Abdel Razek, A.A.K., et al., Computed Tomography Angiography and Magnetic Resonance Angiography of Congenital Anomalies of Pulmonary Veins. J Comput Assist Tomogr, 2019. 43(3): p. 399-405.
- Türkvatan, A., et al., Multidetector Computed Tomographic Angiography Imaging of Congenital Pulmonary Venous Anomalies: A Pictorial Review. Can Assoc Radiol J, 2017. 68(1): p. 66-76.
- Fragata, J., et al., Partial anomalous pulmonary venous connections: surgical management. World J Pediatr Congenit Heart Surg, 2013. 4(1): p. 44-9.
Cardiomiopatia infiammatoria cronica: dalla presentazione clinica all’interpretazione della risonanza magnetica e della biopsia cardiaca
Elisa Cesarano, Maria Luisa Carbone, Emanuela Frau, Edoardo Carugi, Bianca Noli, Luca Fazzini, Enrico Mulargia, Roberta Montisci
Clinical Cardiology Unit, University Hospital of Cagliari, Italy
ABSTRACT
La cardiomiopatia infiammatoria cronica è una condizione di persistente infiammazione miocardica che esita in una disfunzione ventricolare. La diagnosi definitiva rappresenta ancora oggi una sfida, considerate l’assenza di segni e sintomi patognomonici.
La risonanza magnetica cardiaca e la biopsia endomiocardica sono esami diagnostici essenziali per giungere ad una diagnosi corretta. Talora l’interpretazione non è univoca, soprattutto nei casi di presentazione clinica tardiva. È questo il caso della nostra paziente, presentatasi in Pronto Soccorso con un quadro di shock cardiogeno conclamato.
CASO CLINICO
Una paziente di 57 anni affetta da sindrome di Kartagener, situs viscerum inversus, ipertensione arteriosa e storia di tachicardia parossistica sopraventricolare, accedeva in Pronto Soccorso per dispnea e plurimi episodi presincopali nelle ultime ore. Lamentava da circa due mesi febbricola, sintomi simil-influenzali, ortopnea, dispnea parossistica notturna e comparsa di edemi declivi.
All’ingresso si presentava marcatamente ipotesa (PA 60/40 mmHg), tachipnoica, lievemente tachicardica e anurica; all’elettrocardiogramma non evidenza di alterazioni suggestive di ischemia. Agli esami ematochimici, modesto rialzo degli indici di flogosi e degli enzimi di miocardiocitolisi ad andamento non fasico, pro-BNP marcatamente elevato (13882 pg/mL) e danno epato-renale. All’emogasanalisi acidosi metabolica con iperlattacidemia (12 mmol/L).
All’ecocardiogramma riscontro di atrio e ventricolo sinistri dilatati con grave disfunzione biventricolare da ipocinesia diffusa (frazione d’eiezione ventricolo sinistro 15%) e insufficienza mitralica funzionale di grado severo. In considerazione del sospetto di miocardite presentatasi con un quadro di shock cardiogeno veniva avviato sostegno al circolo con inotropi (dobutamina 10 mcg/kg/min) e successivo supporto meccanico con posizionamento di contropulsatore aortico (IABP).
La paziente veniva quindi ricoverata presso l’UTIC, vigile, in respiro spontaneo (ossigenoterapia FiO2 40%), con terapia diuretica endovenosa in infusione continua e sostegno al circolo mediante dobutamina ridotta a 7.5 mcg/kg/min e IABP 1:1. Al monitoraggio pressorio PA 125/70 mmHg, SpO2 99%, progressiva ripresa della diuresi. Dopo circa 36 ore veniva svezzata dalla terapia inotropa e da IABP e, una volta superata la fase acuta, si assisteva a miglioramento clinico-laboratoristico con sospensione dell’ossigenoterapia e progressiva titolazione della terapia per lo scompenso, con progressivo miglioramento della funzione sistolica biventricolare.
A completamento diagnostico, veniva eseguita risonanza magnetica cardiaca (CMR) che evidenziava frazione d’eiezione ventricolo sinistro (FEVS) 17% e ventricolo destro 25%; nelle sequenze STIR e per il T2 mapping area di alterato segnale nei segmenti infero-laterale basale e medio da riferire a edema miocardico e, nelle sequenze acquisite tardivamente dopo somministrazione di mezzo di contrasto, area di late gadolinium enhancement (LGE) subepicardico, compatibili con un quadro di miocardite. Si decideva inoltre di indagare il quadro coronarico mediante angio-TC, risultata negativa per lesioni stenosanti.
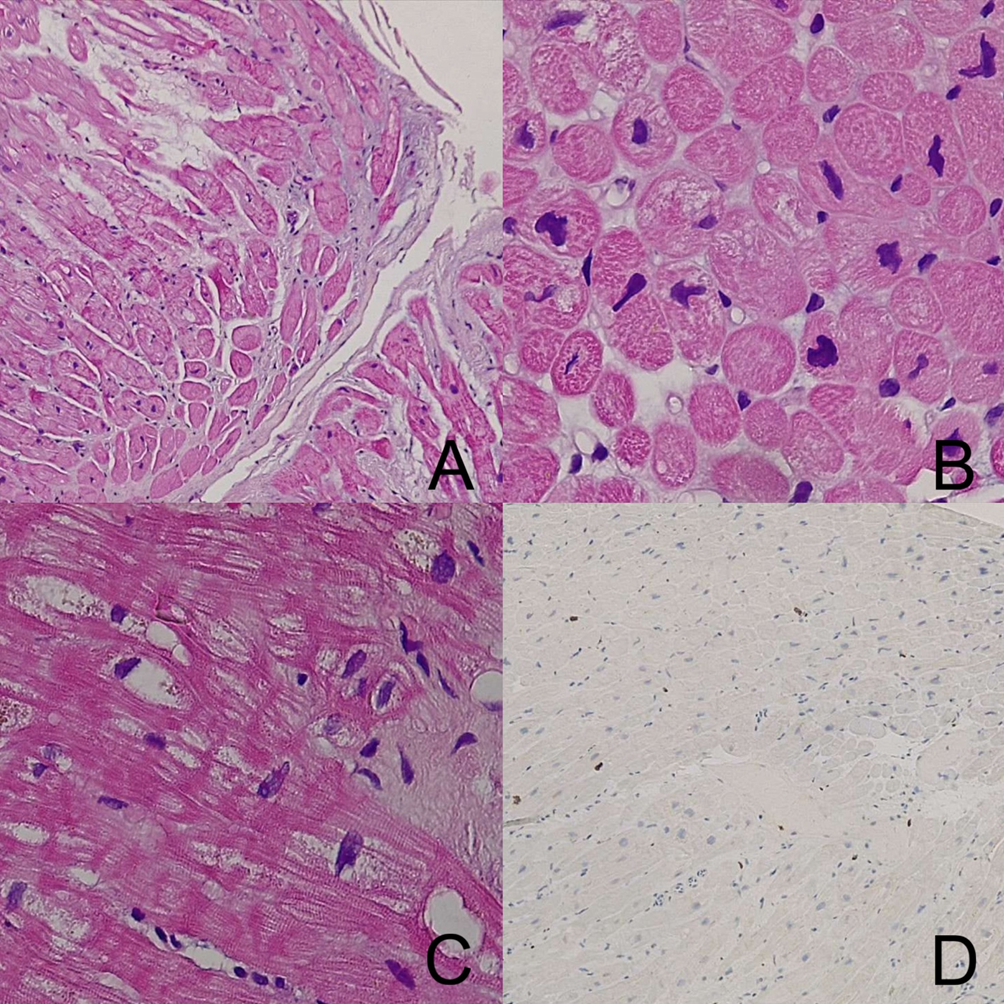
Sette giorni dopo la paziente veniva trasferita presso un altro Presidio per eseguire biopsia endomiocardica: venivano prelevati quattro frammenti caratterizzati da focale edema, lieve ipertrofia nucleare dei cardiomiociti e aspetti di degenerazione sarcoplasmatica con aloni perinucleari e tralci di sostituzione fibrosa, ma solo modesta presenza di infiltrati infiammatori aspecifici per miocardite (Figura 1).
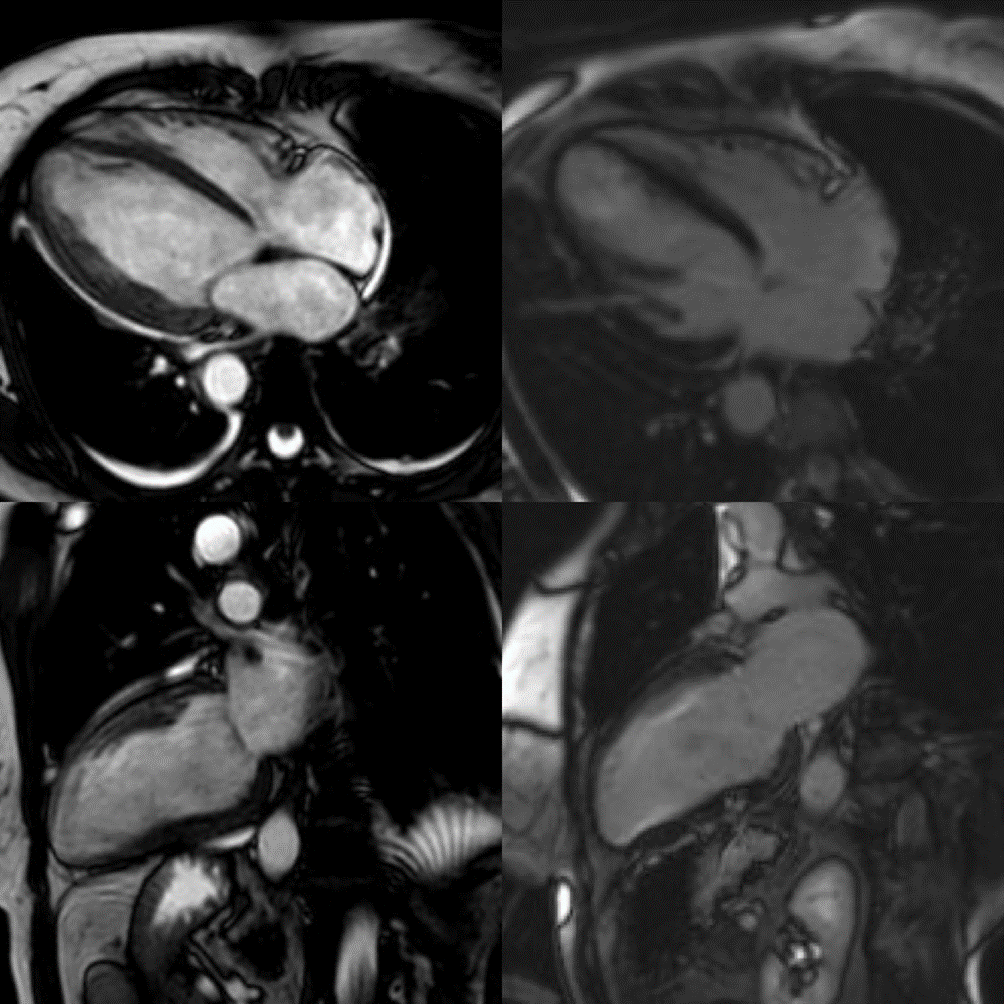
Alla CMR eseguita a un mese dalla dimissione, parziale recupero della funzione biventricolare (FEVS 36%) con risoluzione dell’edema miocardico senza aree di LGE (Figura 2).
DISCUSSIONE
La cardiomiopatia infiammatoria cronica è causata da un persistente stimolo infiammatorio, generalmente associato a un substrato genetico, e può rappresentare l’evoluzione di una miocardite clinicamente diagnosticata o silente. Presenta tipicamente segni e sintomi dell’insufficienza cardiaca fino allo shock cardiogeno, sindrome caratterizzata da una grave compromissione della contrattilità miocardica con riduzione della portata cardiaca, che si può manifestare con diversi fenotipi clinici, la cui diagnosi si basa sul riscontro di ipotensione associata a segni di ipoperfusione periferica.
Il caso presentato è suggestivo di una miocardite subacuta evoluta in cardiomiopatia infiammatoria cronica presentatasi all’esordio come uno shock cardiogeno in bassa portata (SCAI C). A supporto della nostra ipotesi diagnostica vi sono la storia clinica di durata superiore a 30 giorni, la dilatazione delle sezioni sinistre, il minimo incremento della troponina discordante rispetto alla severa disfunzione ventricolare e l’aspecifico infiltrato infiammatorio alla biopsia. Nonostante la presenza di modesta fibrosi all’esame istologico, è peculiare il riscontro di cambiamenti dinamici del LGE alla CMR. Al follow-up, la risoluzione dell’edema è di frequente riscontro, mentre l’estensione del LGE è un processo dinamico principalmente relato all’edema tissutale nella fase acuta che progressivamente si risolve nel tempo, contrariamente al riscontro di LGE al controllo che riflette la sostituzione fibrosa post-infiammatoria [1,2].
Se la miocardite acuta si presenta maggiormente con dolore toracico (“infarct-like”) [3], la cardiomiopatia infiammatoria cronica rientra nello spettro dell’insufficienza cardiaca (“cardiomyopathic”) fino allo shock cardiogeno fenotipicamente sovrapponibile ad uno scenario di “acute decompensated heart failure”. Il repentino ricorso a dispositivi di assistenza meccanica al circolo come il IABP può risultare vincente per interrompere la spirale dello shock cardiogeno migliorando l’accoppiamento ventricolo-arterioso e conseguentemente la performance cardiaca e la perfusione d’organo.
La caratterizzazione eziologica del nostro quadro non può prescindere da una definizione istologica. La biopsia endomiocardica risulta comunque gravata da bassa sensibilità e non si può escludere la difficoltà della metodica di fronte a una destrocardia per cui la sua aspecificità non esclude una malattia infiammatoria del miocardio, soprattutto a distanza di due settimane rispetto all’esordio dei sintomi [4]. Inoltre, nella cardiomiopatia infiammatoria cronica, sia la CMR che la biopsia endomiocardica possono repertare un’infiammazione meno florida rispetto alla gravità della presentazione clinica [1].
Il nostro caso clinico ci ricorda come la prima presentazione di una cardiomiopatia infiammatoria cronica può essere un’urgenza e richiedere immediata assistenza farmacologica e meccanica al circolo. Certamente la CMR e la biopsia endomiocardica rappresentano gli esami diagnostici principali seppur necessitino di una notevole esperienza nell’interpretazione dei risultati, talora non univoci. La determinazione dei fattori responsabili della transizione da miocardite acuta a cardiomiopatia infiammatoria cronica rimane oggetto di studio [1].
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405
- Aquaro GD, Ghebru Habtemicael Y, Camastra G, Monti L, Dellegrottaglie S, Moro C, Lanzillo C, Scatteia A, Di Roma M, Pontone G, Perazzolo Marra M, Barison A, Di Bella G; “Cardiac Magnetic Resonance” Working Group of the Italian Society of Cardiology. Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J Am Coll Cardiol. 2019 Nov 19;74(20):2439-2448. doi: 10.1016/j.jacc.2019.08.1061.
- Francone M, Chimenti C, Galea N, Scopelliti F, Verardo R, Galea R, Carbone I, Catalano C, Fedele F, Frustaci A. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis. JACC Cardiovasc Imaging. 2014 Mar;7(3):254-63. doi: 10.1016/j.jcmg.2013.10.011.
- Basso C. Myocarditis. N Engl J Med. 2022 Oct 20;387(16):1488-1500. doi: 10.1056/NEJMra2114478. PMID: 36260793.
Un fortuito riscontro di forame ovale pervio
Simone Pasquale Crispino1, Andrea Segreti1,2, Ylenia La Porta1, Paola Liporace1, Myriam Carpenito1, Valeria Cammalleri1, Gian Paolo Ussia1, Francesco Grigioni1
1 Dipartimento di Scienze Cardiovascolari, Fondazione Policlinico Universitario Campus Bio-Medico, Roma.
2 Dipartimento di Scienze Motorie, Umane e della Salute, Università degli studi di Roma “Foro Italico”, Roma.
ABSTRACT
Un uomo di 55 anni affetto da scompenso cardiaco a frazione di eiezione ridotta e con storia di TIA è stato ricoverato per dispnea ed intolleranza all’esercizio fisico. Dopo ottimizzazione della terapia medica, è stato effettuato un test da sforzo cardiopolmonare che ha mostrato un repentino aumento della VE/VCO2 slope, della PETO2 e del RER, con concomitante diminuzione della PETCO2 e della SpO2. Questi reperti hanno posto il sospetto di un’ipertensione indotta dall’esercizio fisico e della presenza di uno shunt destro-sinistro dinamico. Esami strumentali successivi hanno rivelato la presenza di un forame ovale pervio misconosciuto.
PRESENTAZIONE DEL CASO
Un uomo di 55 anni affetto da scompenso cardiaco a frazione di eiezione ridotta (HFrEF) noto è stato ricoverato in Cardiologia per dispnea ingravescente. L’anamnesi patologica remota metteva in evidenza un pregresso riscontro di vasi coronarici indenni da lesioni angiograficamente significative, successivo impianto di defibrillatore transvenoso (ICD) in prevenzione primaria ed un pregresso attacco ischemico transitorio (TIA). Il paziente è stato indirizzato presso il nostro Centro per la caratterizzazione della dispnea e l’approfondimento diagnostico dell’ulteriore peggioramento della funzione sistolica ventricolare sinistra. È stato sottoposto a nuova coronarografia che ha confermato l’assenza di malattia coronarica ostruttiva, e a cateterismo cardiaco destro che non ha rilevato ipertensione polmonare a riposo. L’ecocardiogramma transtoracico (TTE) ha mostrato un ventricolo sinistro dilatato con ipocinesia globale (FEVS 35%), in assenza di ulteriori reperti di rilievo. Il controllo dell’ICD ha evidenziato alcuni episodi di tachicardia ventricolare interrotta con pacing antitachicardico (ATP). Durante la degenza, è stata ulteriormente ottimizzata la terapia medica secondo le linee guida ESC 2021 sullo scompenso cardiaco.
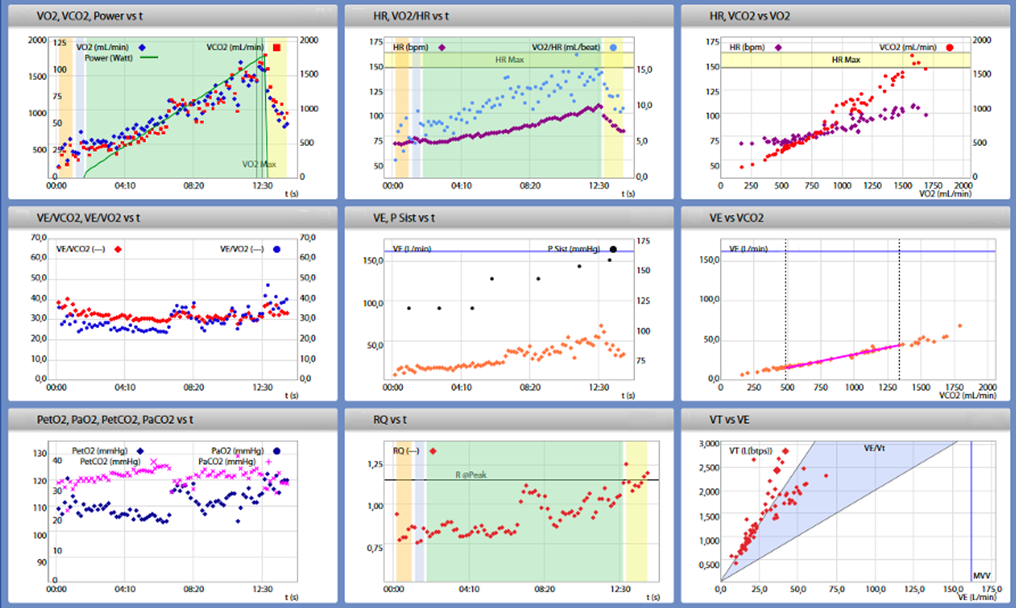
Prima della dimissione, è stato infine eseguito un test da sforzo cardiopolmonare (CPET) per valutare la dispnea e la limitata tolleranza all’esercizio fisico.
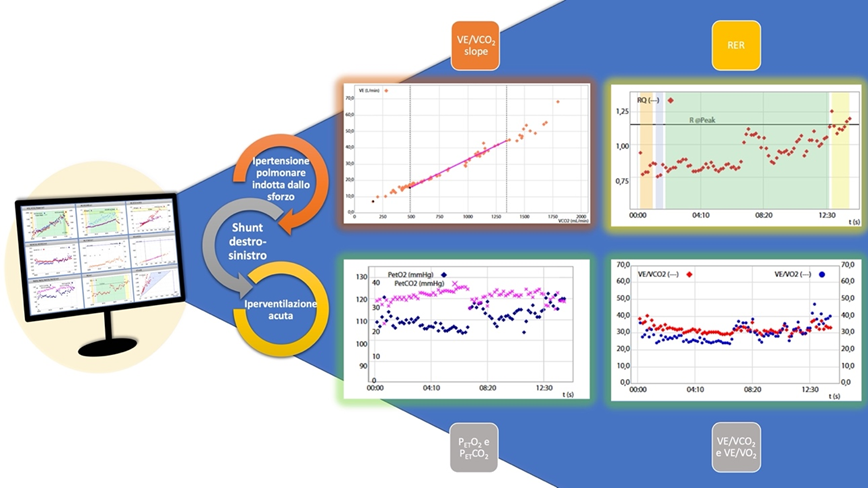
Il test è stato eseguito con un protocollo di rampa da 10 Watt ed è risultato massimale. La VO2 di picco ottenuta è risultata fortemente ridotta (16,8 ml/kg/min, 51% del predetto). Durante l’esercizio, a circa 60 W, è stato osservato un notevole aumento della PETO2 e del quoziente respiratorio (RER) con una concomitante diminuzione della PETCO2 e della SpO2. Contestualmente, è stato osservato un aumento della VE/VCO2, a sottolineare la presenza di ipertensione polmonare indotta dall’esercizio.
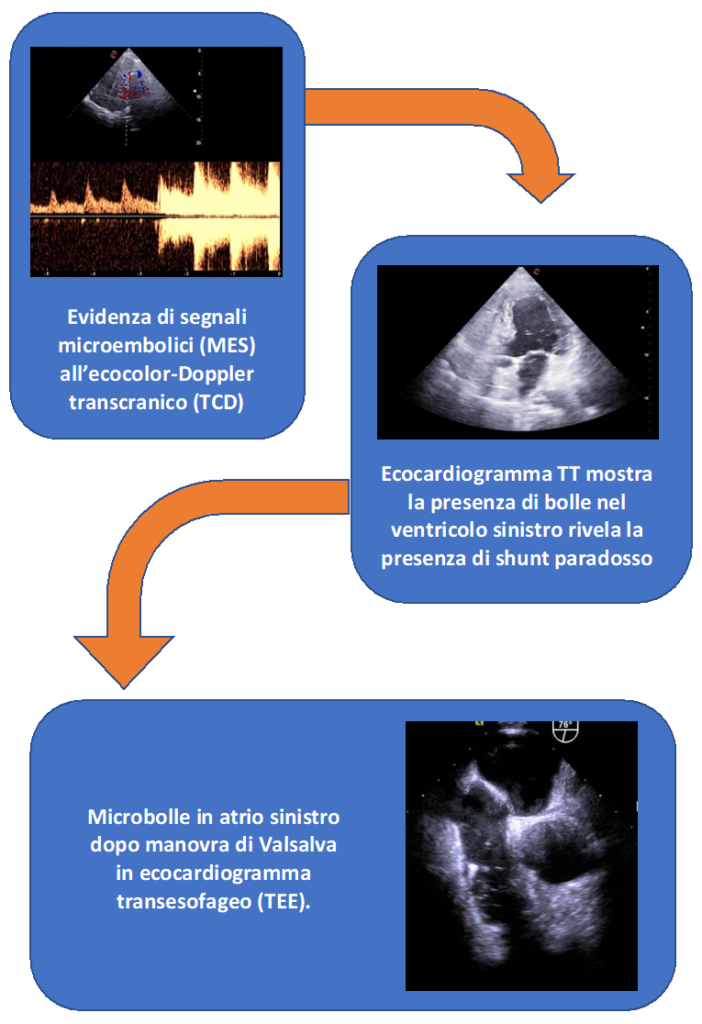
Nel sospetto di uno shunt interatriale, è stato successivamente eseguito un ecocardiogramma transtoracico e Doppler transcranico con bubble test che hanno evidenziato la presenza di un PFO misconosciuto. Inoltre, è stato eseguito un ecocardiogramma transesofageo (TEE) per fornire una valutazione dettagliata del PFO. Secondo la classificazione di Rana1, il TEE ha mostrato un PFO con una morfologia “semplice”, caratterizzato da un “tunnel length” di 6,5 mm e da un unico orifizio che si immette nell’atrio sinistro delle dimensioni di 4,5 mm.
DISCUSSIONE
Il forame ovale è una comunicazione vestigiale tra gli atri che funziona come un bypass della circolazione polmonare durante la vita fetale e che nella maggior parte delle persone, successivamente alla nascita, va incontro a chiusura dopo l’inizio della respirazione. Ad ogni modo, in circa il 25% degli adulti persiste una pervietà del forame ovale. Tramite questa pervietà può instaurarsi uno shunt destro-sinistro, in particolar modo nei pazienti con scompenso cardiaco, che possono presentare ipertensione polmonare a riposo o durante l’esercizio.
Da un punto di vista fisiopatologico, in presenza di un PFO e di un concomitante aumento delle resistenze vascolari polmonari, il ritorno venoso indotto dall’esercizio aumenta e determina un aumento della pressione atriale destra. Quando quest’ultima supera la pressione atriale sinistra, il ritorno venoso può deviare attraverso il PFO, portando il sangue deossigenato, acido e ricco di CO2 verso la circolazione sistemica.2 Pertanto i chemocettori vengono attivati ed inducono, così, l’iperventilazione per compensare adeguatamente l’elevata quantità di CO2 presente nel sangue proveniente dalle sezioni destre del cuore. Questi aspetti fisiopatologici vengono evidenziati al CPET da un improvviso aumento di PETO2 e una diminuzione della PETCO2, che riflettono PaO2 e PaCO2.
Nel caso presentato, il concomitante aumento della pendenza VE/VCO2 sottolinea un’ipertensione polmonare indotta dall’esercizio, condizione frequentemente associata allo scompenso cardiaco, e che contribuisce ulteriormente alla dispnea e all’intolleranza allo sforzo fisico. In questo caso, infatti, l’ipertensione polmonare si è sviluppata durante l’esercizio, determinando l’inversione dello shunt in un paziente con PFO misconosciuto.
I risultati presentati concordano con i criteri postulati nel 2002 da Sun3 per indentificare mediante il CPET uno shunt destro-sinistro indotto dall’esercizio.
CONCLUSIONI
Nel caso presentato, il CPET ha contribuito a diagnosticare un PFO misconosciuto con uno shunt destro-sinistro indotto dallo sforzo in un paziente con un precedente TIA inspiegato. Inoltre, ha smascherato l’ipertensione polmonare indotta dallo sforzo come causa di dispnea ingravescente in un paziente affetto da scompenso cardiaco. Per la valutazione di un sospetto PFO le attuali linee guida non prevedono l’uso del CPET o del cateterismo cardiaco destro sotto sforzo, bensì esclusivamente l’esecuzione di esami in condizioni di riposo.4 Una valutazione durante l’esercizio potrebbe, tuttavia, rivelarsi particolarmente utile per la diagnosi di PFO, come dimostrato nel presente caso.
BIBLIOGRAFIA
1. Rana BS, Shapiro LM, McCarthy KP, Ho SY. Three-dimensional imaging of the atrial septum and patent foramen ovale anatomy: defining the morphological phenotypes of patent foramen ovale. Eur J Echocardiogr. 2010;11(10):i19-25.
2. Lovering AT, Stickland MK, Amann M, O’Brien MJ, Hokanson JS, Eldridge MW. Effect of a patent foramen ovale on pulmonary gas exchange efficiency at rest and during exercise. J Appl Physiol (1985). 2011;110(5):1354-1361.
3. Sun X-G, Hansen JE, Oudiz RJ, Wasserman K. Gas Exchange Detection of Exercise-Induced Right-to-Left Shunt in Patients With Primary Pulmonary Hypertension. Circulation. 2002;105(1):54-60.
4. Pristipino C, Sievert H, D’Ascenzo F, et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. European Heart Journal. 2018;40(38):3182-3195.
Tachicardia ventricolare da RVOT: il mappaggio elettroanatomico tridimensionale come chiave per la diagnosi differenziale tra forma idiopatica e cardiomiopatia aritmogena del ventricolo destro.
Linda Piras1, Raffaella Mistrulli1, Armando Ferrera1, Erika Pagannone1, Giuliano Tocci1, Roberta Falcetti1, Francesco Raffaele Spera1, Emanuele Barbato1
1U.O.C Cardiologia, Azienda Ospedaliero-Universitaria Sant’Andrea, Roma.
ABSTRACT
La cardiomiopatia aritmogena (ACM) è una cardiomiopatia ereditaria caratterizzata da una progressiva sostituzione fibroadiposa del miocardio che può colpire il ventricolo destro, quello sinistro o entrambi i ventricoli.
La ACM presenta un ampio spettro di manifestazioni cliniche, tra cui aritmie ventricolari, scompenso cardiaco e miocardite. Nonostante siano stati validati una serie di criteri elettrocardiografici, morfologici, istologici e genetici, la diagnosi di ACM rimane una sfida clinica, soprattutto nelle fasi precoci o forme lievi in cui le alterazioni strutturali sono minime, ma si associano ugualmente ad instabilità elettrica e rischio aritmico. In questo contesto, il mappaggio elettroanatomico tridimensionale (EAM) potrebbe offrire la possibilità di individuare le cicatrici elettroanatomiche che nella maggior parte dei casi si trovano nel tratto di efflusso ventricolare destro (RVOT) e sono predittive della sostituzione fibroadiposa, anche quando le alterazioni sono poco evidenti con altre tecniche.
CASO CLINICO
Presentiamo il caso di un uomo di 37 anni fumatore, privo di familiarità per cardiomiopatie o morte improvvisa ed altri fattori di rischio. Da circa un anno, aveva presentato saltuari episodi di cardiopalmo.
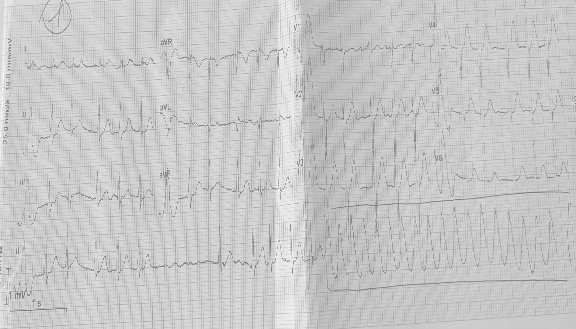
Per la comparsa di un episodio più intenso e di maggior durata, accedeva in Pronto Soccorso. L’elettrocardiogramma (Figura 1) mostrava fibrillazione atriale con FC media di 120 bpm con comparsa di una tachicardia a complessi larghi e FC di 200 bpm, emodinamicamente ben tollerata. Al secondo elettrocardiogramma, si evidenziava ripristino del ritmo sinusale e ritardo di conduzione intraventricolare destro. Gli esami ematici e l’ecocardiogramma non mostravano anomalie di rilievo. Il paziente veniva ricoverato e sottoposto a studio elettrofisiologico, che non mostrava presenza di vie accessorie, di doppia fisiologia nodale o pattern di Brugada al test all’ajmalina.
Si decideva dunque di procedere ad isolamento delle vene polmonari con crioablazione. Nel postoperatorio, si documentavano al monitoraggio telemetrico frequenti extrasistoli ventricolari e brevi run di tachicardia ventricolare non sostenuta (TVNS) monomorfa, ad apparente origine dal RVOT. Il paziente veniva sottoposto a cardio-TC, risultata nella norma, e risonanza magnetica cardiaca, che evidenziava una sottile stria di late gadolinium enhancement subepicardico a carico del segmento basale della parete laterale e inferiore del ventricolo sinistro, in assenza di segni di sostituzione fibroadiposa. Si decideva di ripetere lo studio elettrofisiologico, inducendo, dopo singolo extrastimolo (drive 600/210 msec), di una TV monomorfa alla FC di 240 bpm emodinamicamente ben tollerata e a verosimile partenza dal RVOT.
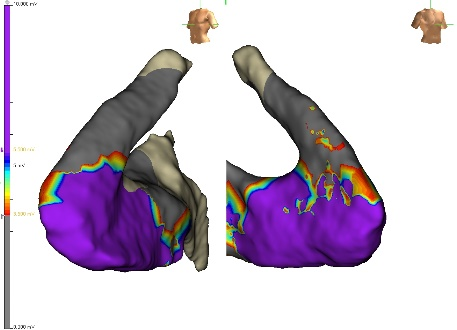
In considerazione del mismtach tra il risultato della risonanza e l’origine della TV, si decideva di eseguire un EAM di substrato del ventricolo destro e mappa di attivazione dell’extrasistolia ventricolare, con evidenza di origine dalla porzione anterolaterale del RVOT. Si procedeva dunque ad ablazione del focus mediante radiofrequenza con scomparsa dell’extrasistolia dopo sei secondi.
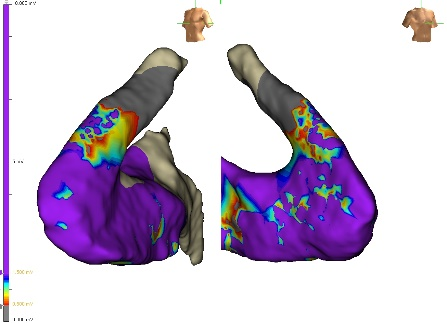
Mediante catetere multipolare ad alta definizione (HD Grid, Abbott) si evidenziavano aree di bassi voltaggi bipolari a livello della parete anterolaterale e un’ampia zona di bassi voltaggi unipolari a livello di tutto il RVOT (Figure 2 e 3) confermati con il catetere ablatore con sensore di contatto. Veniva eseguita infusione di isoprotenerolo senza induzione di aritmie.
In considerazione del buon risultato dell’ablazione e della necessità di uno stretto follow-up, veniva impiantato un loop recorder (Biomonitor III m, Biotronik) e il paziente veniva dimesso in terapia betabloccante ed anticoagulante. All’ultimo follow-up, si è mostrato asintomatico, con assenza di anomalie significative all’elettrocardiogramma ed ecocardiogramma. Il loop recorder non ha evidenziato aritmie significative. È stato inoltre eseguito un prelievo per l’analisi genetica, tuttora in corso.
DISCUSSIONE
La TV ad origine dal RVOT costituisce un’aritmia comune, attribuibile a due principali cause: 1) forma idiopatica; 2) secondaria alla ACM, con coinvolgimento del ventricolo destro.
La forma idiopatica è generalmente benigna, non ereditaria, che si manifesta tipicamente in giovani senza alcuna cardiopatia strutturale. Al contrario, la forma legata alla ACM predispone all’insorgenza di morte improvvisa [1][2]. Sebbene sia cruciale distinguere queste due condizioni, spesso la diagnosi differenziale può essere complessa, specialmente nel caso di forme precoci o lievi di ACM, difficilmente rilevabili dalle tecniche di imaging convenzionali [2][3][4]. In questo contesto, la dimostrazione istopatologica della sostituzione fibroadiposa tramite biopsia rappresenterebbe l’unico metodo per una diagnosi certa [5]. Tuttavia, tale tecnica è limitata dalla sua invasività, dalla natura segmentale della patologia e incapacità di valutare le variazioni transmurali della parete del ventricolo destro, dalla difficoltà nel distinguere il tessuto adiposo patologico dal tessuto subepicardico o da altre cardiomiopatie [5][6]. Recentemente, l’utilizzo dell’EAM è emerso come un metodo affidabile per identificare e caratterizzare le regioni a basso voltaggio, note come “cicatrici elettroanatomiche”, che nei pazienti con ACM corrispondono a zone di deplezione miocardica e correlano con l’aspetto istopatologico di atrofia e sostituzione fibroadiposa [5][7][8][9]. Questa tecnica è dunque utile per la diagnosi differenziale della TV da RVOT, dove nel caso di forme idiopatiche si hanno voltaggi normali mentre nel caso della ACM si osservano aree di basso voltaggio [1][5][7].
La presentazione iniziale del nostro paziente, con la fibrillazione atriale, non è rara nei pazienti con ACM. Una recente meta-analisi comprendente 16 studi con 1986 pazienti affetti da ACM ha riportato una prevalenza complessiva del 12,9% [10]. Dai dati attualmente a disposizione, la fibrillazione atriale si verifica prevalentemente nella fase iniziale di malattia in assenza di alterazioni strutturali conclamate e riflette la presenza di instabilità elettrica [11].
CONCLUSIONI
Nonostante l’elevato sospetto clinico, in assenza dei risultati dell’analisi genetica non possiamo porre una diagnosi definitiva di ACM [12]. Tuttavia, le caratteristiche cliniche sembrerebbe confermare l’esistenza di una fase precoce “occulta”, caratterizzata da sottili modificazioni strutturali, che possono limitarsi a una specifica zona del cosiddetto “triangolo di displasia” e manifestarsi esclusivamente con TV da RVOT. Inoltre, la descrizione di tale caso fornisce un contributo alla validazione dell’EAM come strumento diagnostico in questo contesto. Questo approccio, focalizzato sugli effetti elettrici – piuttosto che meccanici – della sostituzione fibroadiposa, potrebbe infatti superare alcune delle limitazioni dell’analisi istologica.
BIBLIOGRAFIA
[1] D. Corrado et al., “Three-Dimensional Electroanatomical Voltage Mapping and Histologic Evaluation of Myocardial Substrate in Right Ventricular Outflow Tract Tachycardia,” J. Am. Coll. Cardiol., vol. 51, no. 7, pp. 731–739, 2008, doi: 10.1016/j.jacc.2007.11.027.
[2] A. E. Buxton, H. L. Waxman, F. E. Marchlinski, M. B. Simson, D. Cassidy, and M. E. Josephson, “Right ventricular tachycardia: Clinical and electrophysiologic characteristics,” Circulation, vol. 68, no. 5, pp. 917–927, 1983, doi: 10.1161/01.CIR.68.5.917.
[3] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: an update,” Heart, 2009.
[4] D. Corrado et al., “Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: A multicenter study,” J. Am. Coll. Cardiol., vol. 30, no. 6, pp. 1512–1520, 1997, doi: 10.1016/S0735-1097(97)00332-X.
[5] D. Corrado et al., “Three-dimensional electroanatomic voltage mapping increases accuracy of diagnosing arrhythmogenic right ventricular cardiomyopathy/dysplasia,” Circulation, vol. 111, no. 23, pp. 3042–3050, 2005, doi: 10.1161/CIRCULATIONAHA.104.486977.
[6] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: diagnosis, prognosis, and treatment,” Heart, 2000.
[7] M. Boulos, I. Lashevsky, S. Reisner, and L. Gepstein, “Electroanatomic mapping of arrhythmogenic right ventricular dysplasia,” J. Am. Coll. Cardiol., vol. 38, no. 7, pp. 2020–2027, 2001, doi: 10.1016/S0735-1097(01)01625-4.
[8] F. E. Marchlinski et al., “Electroanatomic substrate and outcome of catheter ablative therapy for ventricular tachycardia in setting of right ventricular cardiomyopathy,” Circulation, vol. 110, no. 16, pp. 2293–2298, 2004, doi: 10.1161/01.CIR.0000145154.02436.90.
[9] A. Verma et al., “Short- and long-term success of substrate-based mapping and ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia,” Circulation, vol. 111, no. 24, pp. 3209–3216, 2005, doi: 10.1161/CIRCULATIONAHA.104.510503.
[10] Rujirachun P, Wattanachayakul P, Charoenngam N, Winijkul A, Ungprasert P. Prevalence of atrial arrhythmia in patients with arrhythmogenic right ventricular cardiomyopathy: a systematic review and meta-analysis. J Cardiovasc Med (Hagerstown). 2020 May;21(5):368-376
[11] Peters S. Atrial arrhythmias in arrhythmogenic cardiomyopathy: at the beginning or at the end of the disease story? Circ J. 2015;79(2):446
[12] Corrado D, Perazzolo Marra M, Zorzi A, Beffagna G, Cipriani A, Lazzari M, Migliore F, Pilichou K, Rampazzo A, Rigato I, Rizzo S, Thiene G, Anastasakis A, Asimaki A, Bucciarelli-Ducci C, Haugaa KH, Marchlinski FE, Mazzanti A, McKenna WJ, Pantazis A, Pelliccia A, Schmied C, Sharma S, Wichter T, Bauce B, Basso C. Diagnosis of arrhythmogenic cardiomyopathy: The Padua criteria. Int J Cardiol. 2020 Nov 15;319:106-114.
Ventricular ectopy unmasked: ectopia ventricolare maligna da sistema del Purkinje in paziente con Wolff-Parkinson-White
Silvia Grimaldi,1 Mattia Alberti,1 Francesco Gentile1,2
1 Department of Pathology, Cardiology Division, University of Pisa, Pisa, Italy
2 Health Science Interdisciplinary Center, Scuola Superiore Sant’Anna, Pisa, Italy
ABSTRACT
La flecainide è un farmaco antiaritmico di largo impiego nella pratica clinica, nel trattamento e prevenzione delle tachicardie sopraventricolari, come la fibrillazione atriale (FA). Riportiamo il caso di un uomo di 53 anni, sottoposto ad ablazione di fascio accessorio postero-settale destro a seguito di episodio di FA pre-eccitata, candidato a terapia profilattica con flecainide. A distanza di qualche ora dall’assunzione del farmaco, al monitoraggio elettrocardiografico si documentavano extrasistoli ventricolari polimorfe a QRS stretto, precoci e ripetitive. Con la sospensione della flecainide, queste si riducevano fino a scomparire. Nel sospetto di extrasistolia maligna da sistema del Purkinje, veniva eseguito studio elettrofisiologico e test provocativo, con conferma del sospetto clinico. Il paziente veniva quindi sottoposto ad ablazione transcatetere del substrato aritmico e impianto di defibrillatore.
ABBREVIAZIONI
FA: fibrillazione atriale
EV: extrasistoli ventricolari
SEF: studio elettrofisiologico
INTRODUZIONE
La flecainide è impiegata nel trattamento della fibrillazione atriale (FA) in quanto rapida ed efficace nel ripristino del ritmo sinusale in acuto1 e ben tollerata in cronico.2-3 Le controindicazioni al suo utilizzo sono: disturbi della conduzione,4 cardiopatia strutturale5 e sindrome di Brugada. In quest’ultimo scenario, l’utilizzo dei farmaci di classe IC è limitato al test provocativo.6
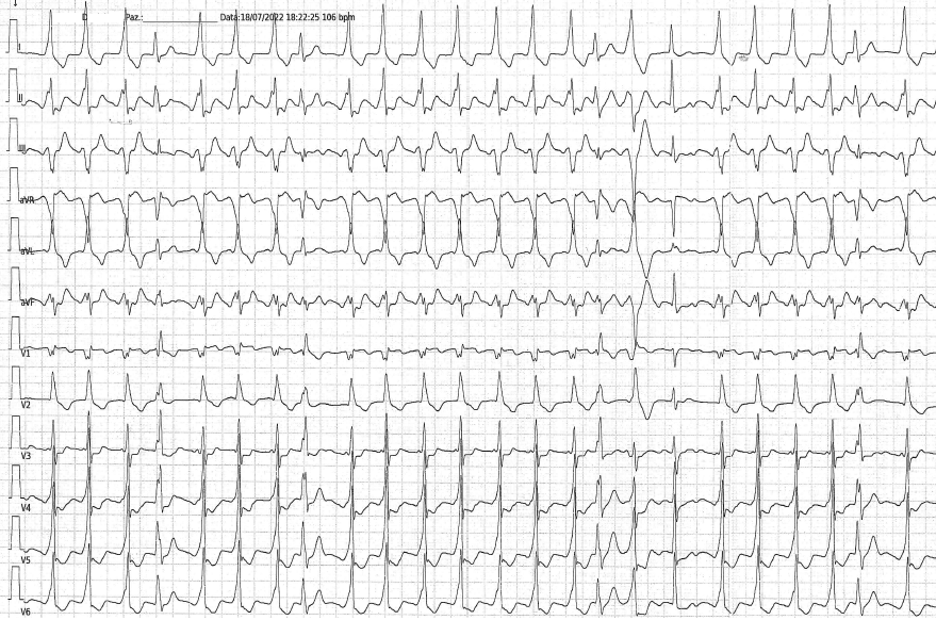
CASO CLINICO
Presentiamo il caso di un paziente di 53 anni senza storia cardiologica, fattori di rischio cardiovascolari e familiarità per morte improvvisa.
Il paziente giungeva alla nostra attenzione per cardiopalmo, discomfort toracico e dispnea. L’elettrocardiogramma mostrava tachicardia a QRS largo e ciclo irregolare (Figura 1). L’ecocardiogramma e gli esami ematochimici risultavano nella norma. Si decideva pertanto di eseguite una con cardioversione elettrica e ricoverare il paziente.
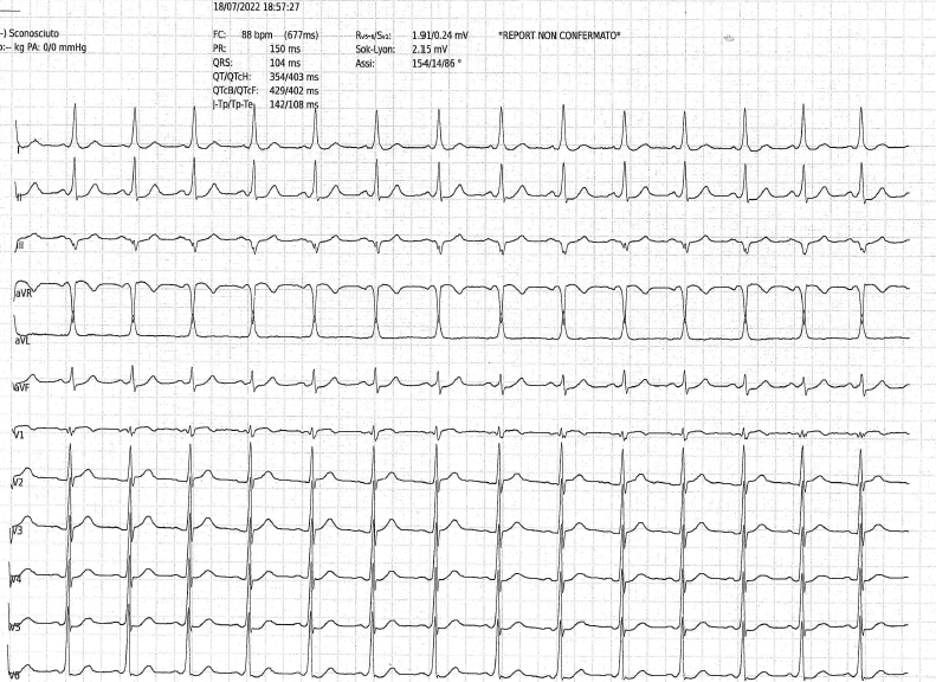
Al ripristino del ritmo sinusale, si osservavano segni elettrocardiografici di pre-eccitazione (Figura 2). Si eseguiva dunque uno studio elettrofisiologico (SEF), con identificazione di un fascio accessorio postero-settale destro con caratteristiche di esclusiva conduzione anterograda, sottoposto ad ablazione transcatetere. Si introduceva dunque la flecainide per la prevenzione di recidive aritmiche.
In seguito alla prima assunzione del farmaco, si osservava la comparsa di extrasistolia ventricolare (EV) polimorfa precoce e ripetitiva, con QRS relativamente stretto. La morfologia prevalente risultava compatibile con un’origine dal sistema di Purkinje del ventricolo sinistro. Si sospendeva la flecainide e si introduceva verapamil, parzialmente efficace nel sopprimere le EV, ma mal tollerata per spiccata bradicardia.
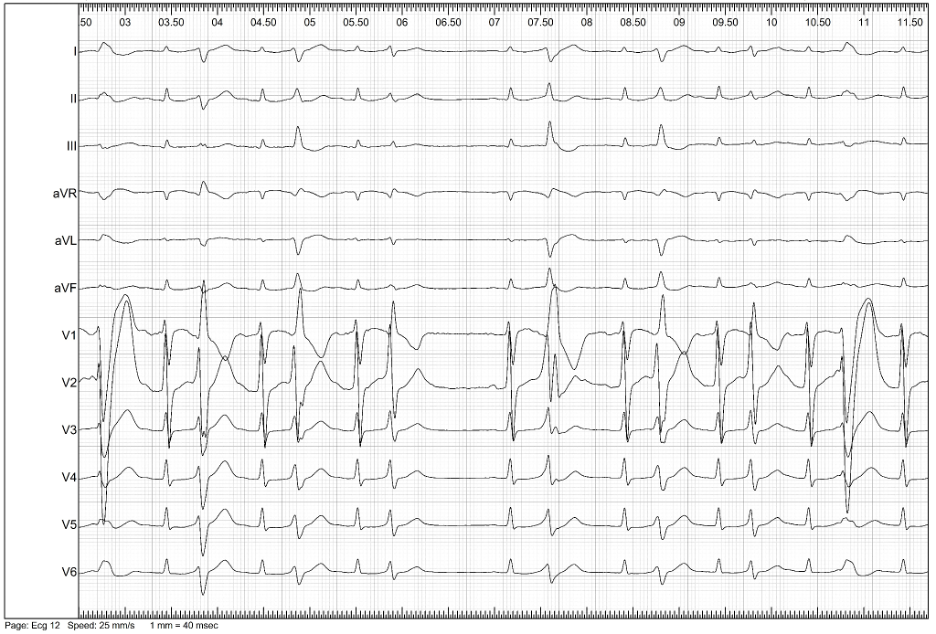
Per una migliore caratterizzazione dell’EV, si decideva di sottoporre il paziente a nuovo SEF. Al mappaggio elettroanatomico basale non si evidenziavano aree di attivazione ventricolare precoce. Si procedeva all’infusione di ajmalina (1 mg/kg in 10 minuti) con comparsa di EV multifocale precoce e ripetitiva, ad origine dal fascicolo posteriore e anteriore del sistema di conduzione (Figura 3-4).
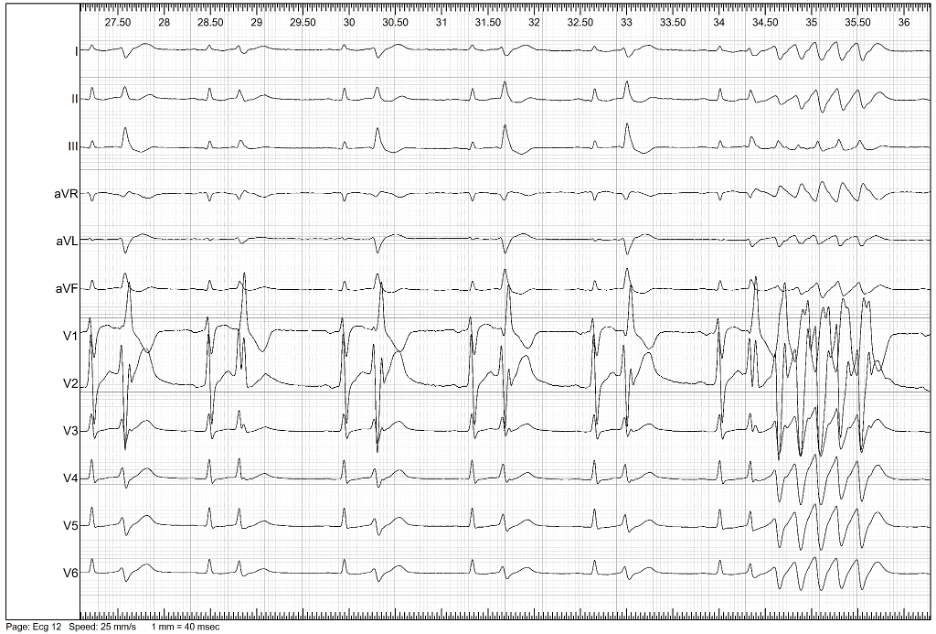
In assenza di cardiopatia strutturale e della riproducibilità del fenomeno ectopico con infusione di antiaritmico di classe I, si poneva il sospetto di EV maligna del sistema del Purkinje. Tenendo conto dell’elevato rischio aritmico associato a questo tipo di EV, si procedeva ad ablazione del focus aritmico.
Tuttavia, nei giorni successivi, nonostante la procedura ablativa e la sospensione della flecainide, si assisteva alla recidiva di EV precoce polimorfa. In considerazione dell’associazione tra tale fenomeno ed il rischio di aritmie maligne, nonostante la difficoltà nella stratificazione del rischio nel caso di riscontro occasionale in paziente asintomatico, si decideva di procedere ad impianto di defibrillatore sottocutaneo, dopo colloquio esaustivo col paziente e sua partecipazione attiva alla decisione. Il paziente veniva dimesso con indicazione ad eseguire test genetico, risultato negativo per i geni testati (compreso SCN5A), e risonanza magnetica cardiaca, che ha confermato l’assenza di cardiopatia strutturale. Veniva data indicazione all’esecuzione di elettrocardiogramma basale nei familiari di primo grado, risultati nei limiti. Il paziente veniva seguito in follow-up nell’anno successivo, senza evidenza di recidive aritmiche.
DISCUSSIONE
Osservando come l’infusione di farmaci bloccanti i canali del sodio possa indurre EV in pazienti senza pattern di Brugada, Haissaguerre et al. hanno descritto per la prima volta l’extrasistolia maligna del Purkinje.7L’accezione “maligna” deriva dal breve intervallo di accoppiamento delle EV (<300 msec), con il rischio di “R-on-T”, fibrillazione ventricolare e morte improvvisa.8 In soggetti di età <45 anni sopravvissuti ad arresto cardiaco, dopo aver escluso cardiopatia ischemica e strutturale e le comuni canalopatie, è possibile porre diagnosi di fibrillazione ventricolare idiopatica. Questa è classificabile in due fenotipi 1) il substrato è rappresentato da alterazioni miocardiche subcliniche, identificabili al SEF come piccole aree in cui si registrano elettrogrammi anomali; 2) il trigger è rappresentato da EV precoci che originano dal sistema del Purkinje, più frequente in termini assoluti e con efficacia del trattamento ablativo.
In quest’ultima classe di pazienti, se la somministrazione di ajmalina è in grado di indurre EV precoci (>10/min) e/o forme ripetitive senza comparsa di pattern di Brugada, è possibile porre diagnosi di ectopia maligna del Purkinje. L’eziologia di questa condizione non è nota. I pazienti inclusi nello studio di Haissaguerre et al. sono stati sottoposti a test genetico per 63 geni implicati nella genesi di cardiomiopatie o canalopatie,7 ma non sono state identificate mutazioni patogenetiche. Alla risonanza magnetica, in nessuno dei pazienti sono state identificate anomalie strutturali. Inoltre, nessuno dei pazienti dello studio era precedentemente in terapia con farmaci di classe IC, per cui è possibile sospettare che esistano altri trigger, attualmente non noti, in grado di slatentizzare queste aritmie.
Al momento è impossibile produrre raccomandazioni circa la gestione di un paziente asintomatico con riscontro di EV maligna del Purkinje. Infatti, i casi di riscontro occasionali si collocano in una gray zone, senza evidenze cliniche. Considerando il modello del triangolo di Coumel,9 si può supporre che, in assenza di un substrato, l’identificazione e il trattamento del trigger (le EV) possa essere utile per prevenire aritmie maligne.10 Tuttavia, nel caso da noi riportato, la persistenza di EV precoci ha suggerito un risultato subottimale dell’ablazione. In assenza di evidenze riguardo al rischio di aritmie maligne nel contesto della prevenzione primaria, dopo discussione del caso con coinvolgimento attivo del paziente, è stato deciso di procedere all’impianto di un defibrillatore sottocutaneo.
CONCLUSIONI
L’extrasistolia maligna da fibre del Purkinje è una condizione rara e poco esplorata in letteratura. Nonostante incidenza e impatto clinico non siano chiari, è fondamentale riconoscere questa condizione, che può essere smascherata dall’utilizzo di antiaritmici di classe IC. Futuri studi dovranno chiarire l’impatto clinico di tale condizione, definendo dei percorsi diagnostici e strategie terapeutiche ottimali.
BIBLIOGRAFIA
- Donovan KD, Power BM, Hockings BE, Dobb GJ, Lee KY. Intravenous flecainide versus amiodarone for recent-onset atrial fibrillation. Am J Cardiol. 1995;75:693–697.
- Gulizia M, Mangiameli S, Orazi S, et al. A randomized comparison of amiodarone and class IC antiarrhythmic drugs to treat atrial fibrillation in patients paced for sinus node disease: the Prevention Investigation and Treatment: A Group for Observation and Research on Atrial arrhythmias (PITAGORA) trial. Am Heart J. 2008;155:100-107.e1.
- Aliot E, Denjoy I. Comparison of the safety and efficacy of flecainide versus propafenone in hospital out-patients with symptomatic paroxysmal atrial fibrillation/flutter. The flecainide AF French Study Group. Am J Cardiol. 1996;77:66A–71A.
- Hellestrand KJ, Bexton RS, Nathan AW, Spurrell RA, Camm AJ. Acute electrophysiological effects of flecainide acetate on cardiac conduction and refractoriness in man. Br Heart J. 1982;48:140-148.
- Greene HL, Roden DM, Katz RJ, Woosley RL, Salerno DM, Henthorn RW. The Cardiac Arrhythmia Suppression Trial: first CAST … then CAST-II. J Am Coll Cardiol. 1992;19:894-898.
- Wolpert C, Echternach C, Veltmann C, et al. Intravenous drug challenge using flecainide and ajmaline in patients with Brugada syndrome. Heart Rhythm. 2005;2:254-260.
- Escande W, Gourraud JB, Haissaguerre M, et al. Malignant Purkinje ectopy induced by sodium channel blockers. Heart Rhythm. 2022;19:1595-1603.
- Engel TR, Meister SG, Frankl WS. The “R-on-T” phenomenon: an update and critical review. Ann Intern Med. 1978;88:221-225.
- Jordaens L. A clinical approach to arrhythmias revisited in 2018 : From ECG over noninvasive and invasive electrophysiology to advanced imaging. Neth Heart J. 2018;26:182-189.
- Marcus GM. Evaluation and Management of Premature Ventricular Complexes. Circulation. 2020;141:1404-1418.
Uno strano caso di dispnea dopo incidente stradale
Eliana Colucci1, Cristian Mattei2, Rocco Sclafani3, Salvatore Notaristefano3, Elisabetta Bordoni3, Andrea Santucci3, Alessandro Aimi3, Claudio Cavallini3
1. Department of Cardiology, University of Perugia School of Medicine, Perugia, Italia
2. Unità Operativa di Cardiologia, Azienda Ospedaliero Universitaria “Ospedali Riuniti”, Ancona, Italia
3. Unità Operativa di Cardiologia, Azienda Ospedaliero Universitaria “Santa Maria della Misericordia”, Perugia, Italia
ABSTRACT
La sindrome platipnea-ortodeossia (POS) è una condizione rara associata a uno shunt intracardiaco destro-sinistro, che va sospettata nei casi in cui la presentazione clinica si caratterizzi per la presenza di ipossiemia e desaturazione correlate ai cambiamenti di posizione. Il fattore che predispone più di frequente alla POS è la pervietà del forame ovale, che da solo in genere non è sufficiente a determinare la manifestazione clinica sindromica e necessita di un altro fattore “trigger” a cui si associa nel causare la POS.
La ricercare di uno shunt intracardiaco attraverso una metodica di imaging non invasiva come l’ecocardiografia può permettere di arrivare a una diagnosi precoce di POS e a un trattamento mirato.
CASO CLINICO
Un uomo di 42 anni si è recato presso il Pronto Soccorso dell’Ospedale Santa Maria della Misericordia per dispnea progressivamente ingravescente esordita dopo incidente stradale con trauma toracico da airbag.
A luglio 2020 il paziente, con storia di tossicodipendenza, era stato sottoposto ad un intervento di sostituzione valvolare aortica con protesi Perimount Magna Ease 23 mm per endocardite batterica su valvola aortica da Stafilococco Aureus Meticillino Resistente, complicata da insufficienza aortica severa con instabilità emodinamica ed embolizzazione settica multiorgano. A febbraio 2022, per recidiva di endocardite su protesi valvolare aortica, è stato sottoposto a reintervento cardiochirurgico con impianto di bioprotesi Medtronic Freestyle 23 mm, complicato da blocco atrio-ventricolare completo per cui si è reso necessario l’impianto di pacemaker definitivo.

La valutazione clinica, ecografica e la radiografia del torace in Pronto Soccorso non hanno mostrato segni di congestione polmonare.
L’ecocardiogramma mostrava una disfunzione ventricolare sinistra con frazione d’eiezione pari al 40% per acinesia apicale e insufficienza tricuspidalica (IT) severa.
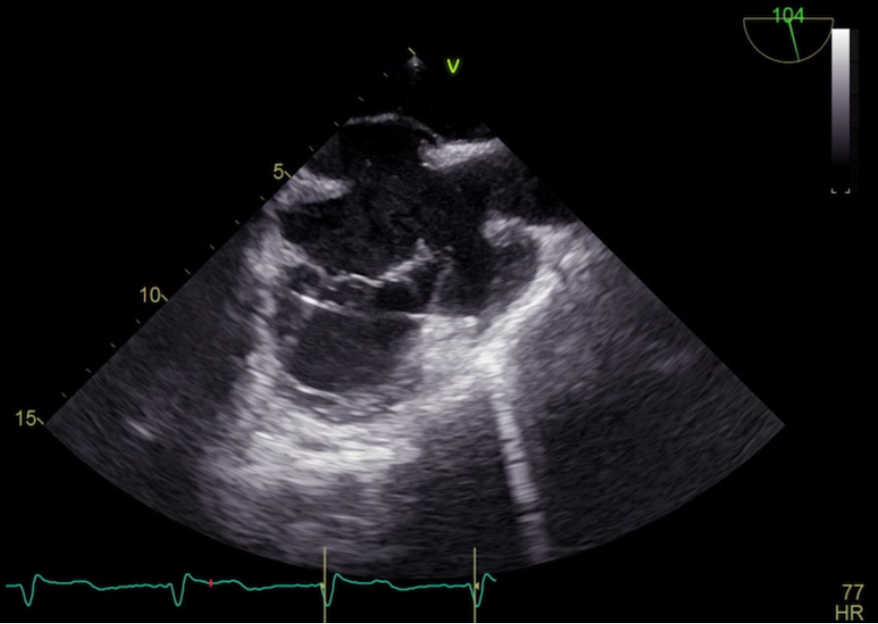
Per l’ipotesi di contusione cardiaca con lesione dell’arteria discendente anteriore, veniva eseguita una coronarografia che non ha riscontrato reperti patologici. Nonostante un lieve miglioramento della funzione contrattile ventricolare sinistra, il paziente ha continuato ad essere dispnoico in posizione ortostatica (saturazione periferica di ossigeno in ortostatismo 85%) con completo benessere in posizione supina. Nel sospetto di sindrome platipnea-ortodeossia (POS) è stato sottoposto ad ecocardiogramma transesofageo con microbolle1 che dimostrava pervietà del forame ovale (FOP) con evidenza di shunt destro-sinistro al color-Doppler e passaggio di microbolle di severa entità in condizioni basali.
Contestualmente si è evidenziata la presenza di flail del lembo tricuspidalico posteriore da rottura di corda tendinea, condizionante IT severa con jet di rigurgito diretto verso il setto interatriale e il forame ovale (Figura 1 e 2), e una formazione trombotica a livello dello sbocco della vena cava inferiore.
Alla luce dei dati ecocardiografici e della presentazione clinica, è stata confermata la diagnosi di POS secondaria a IT severa da rottura di corda tendinea e flail del lembo tricuspidalico posteriore verosimilmente causata dall’incidente stradale.
Data l’alta probabilità di un futuro reintervento sulla bioprotesi aortica, l’elevato rischio chirurgico correlato ad un terzo reintervento e l’assenza di sintomi e/o segni di scompenso cardiaco destro, la decisione collegiale in Heart Team è stata di procedere con la chiusura percutanea del FOP e di attuare uno stretto follow-up clinico ed ecocardiografico per l’IT.
In seguito alla chiusura percutanea del FOP con dispositivo Amplatzer Cribriform Multifenestrated Septal Occluder 25, il paziente ha avuto un immediato beneficio sintomatologico e ha mantenuto buoni valori di saturazione periferica di ossigeno sia in clinostatismo, sia in ortostatismo.
DISCUSSIONE
La POS è una condizione rara caratterizzata da ipossiemia e dispnea in ortostatismo ma saturazione periferica normale in posizione supina, più frequentemente dovuta a shunt destro-sinistro favorito dalla presenza di FOP2.
Tuttavia, considerando che in circa il 25% della popolazione3 il forame ovale risulta pervio dopo la nascita, va ipotizzata una causa scatenante che accentui lo shunt destro-sinistro e favorisca la comparsa di POS. La particolarità4-6 del caso clinico risiede nel trigger anatomico che ha determinato lo sviluppo della POS, ovvero la rottura di corda tendinea conseguente a trauma toracico chiuso e la presenza di un severo jet di IT diretto verso un FOP pre-esistente condizionante lo shunt destro-sinistro in ortostatismo.
CONCLUSIONI
La POS è una condizione rara specialmente dopo trauma toracico. In presenza di dispnea e ipossiemia persistente associata a cambiamenti di posizione, ricercare uno shunt intracardiaco attraverso una metodica di imaging non invasiva come l’ecocardiografia1 può permettere di arrivare a una diagnosi precoce e ad un trattamento mirato, che sia esso chirurgico o percutaneo.
BIBLIOGRAFIA
1. Somers C, Slabbynck H, Paelinck BP. Echocardiographic diagnosis of platypnoea-orthodeoxia syndrome after blunt chest trauma. Acta Cardiol. 2000 Jun;55(3):199-201. doi: 10.2143/AC.55.3.2005741. PMID: 10902047.
2. Akin E, Krüger U, Braun P, Stroh E, Janicke I, Rezwanian R, Akin I, Schöls WH. The platypnea-orthodeoxia syndrome. Eur Rev Med Pharmacol Sci. 2014;18(18):2599-604. PMID: 25317791.
3. Hagen PT, Scholz DG, Edwards WD: Incidence and size of patent foramen ovale during the first 10 decades of life: an autopsy study of 965 normal hearts. Mayo Clin Proc 1984;59:17–20.
4. Ribichini F, Conte R, Lioi A, Dellavalle A, Ugliengo G. Subacute tricuspid regurgitation with severe hypoxemia complicating blunt chest trauma. Chest. 1996 Jan;109(1):289-91. doi: 10.1378/chest.109.1.289. PMID: 8549204.
5. Hsu PF, Leu HB, Lu TM, Yu WC, Hsu TL. Platypnea-orthodeoxia syndrome occurring after a blunt chest trauma with acute tricuspid regurgitation. Am J Med. 2004 Dec 1;117(11):890-1. doi: 10.1016/j.amjmed.2004.09.010. PMID: 15589503.
6. Hatani Y, Tanaka H, Kajiura A, Tsuda D, Matsuoka Y, Kawamori H, Soga F, Matsumoto K, Inoue T, Okita Y, Hirata KI. Sudden Onset of Platypnea-Orthodeoxia Syndrome Caused by Traumatic Tricuspid Regurgitation With Ruptured Chordae Tendineae After Blunt Chest Trauma. Can J Cardiol. 2018 Aug;34(8):1088.e11-1088.e13. doi: 10.1016/j.cjca.2018.03.022. Epub 2018 Apr 27. PMID: 29980469.
“Two is better than one”: chiusura percutanea dell’auricola sinistra in paziente portatore di dispositivo occlusore di difetto interatriale.
Simone Fodraa-b, Luca Cumitinia-b, Roberta Rossob, Anna Degiovannib, Giuseppe Pattia-b
a Department of Translational Medicine, University of Eastern Piedmont, Via Solaroli 17, 28100 Novara, Italy;
b Department of Thoracic and Cardiovascular Diseases, Maggiore della Carità Hospital, Corso Mazzini 18, 28100 Novara, Italy.
ABSTRACT
La chiusura percutanea di auricola sinistra è un’opzione sicura per la prevenzione del cardioembolismo nei pazienti con fibrillazione atriale nei quali la terapia anticoagulante non può essere attuata. Tuttavia, la presenza di un dispositivo precedentemente impiantato sul setto interatriale la può rendere una procedura tecnicamente impegnativa in quanto riduce la manovrabilità di accesso dell’operatore ed il rilascio sicuro del dispositivo.
Vi presentiamo un interessante caso di un paziente portatore di un dispositivo occlusore di un difetto interatriale sottoposto con successo alla chiusura percutanea di auricola sinistra attraverso una soluzione di continuità dello stesso.
CASO CLINICO
Si presentava alla nostra attenzione un paziente di 77 anni con fibrillazione atriale (FA) permanente con storia di plurimi episodi di rettorragia ed anemizzazione in corso di terapia anticoagulante orale.
Riferiva inoltre dispnea ingravescente da alcuni mesi. Aveva eseguito 13 anni prima la chiusura percutanea di un difetto interatriale (DIA) tipo ostium secundum presso un altro Centro, il quale non era stato in grado di fornirci alcuna documentazione riguardo il tipo di dispositivo utilizzato. La colonscopia rivelava una voluminosa lesione polipoide di origine neoplastica a livello della giunzione sigma-retto altamente sanguinante. Dopo discussione con i colleghi oncologi, dato l’elevato rischio di sanguinamento della lesione intestinale, si proponeva al paziente la chiusura percutanea dell’auricola sinistra (LAAC). L’ecocardiogramma transesofageo (ETE) mostrava un’auricola sinistra con morfologia “a cactus” libera da formazioni trombotiche.
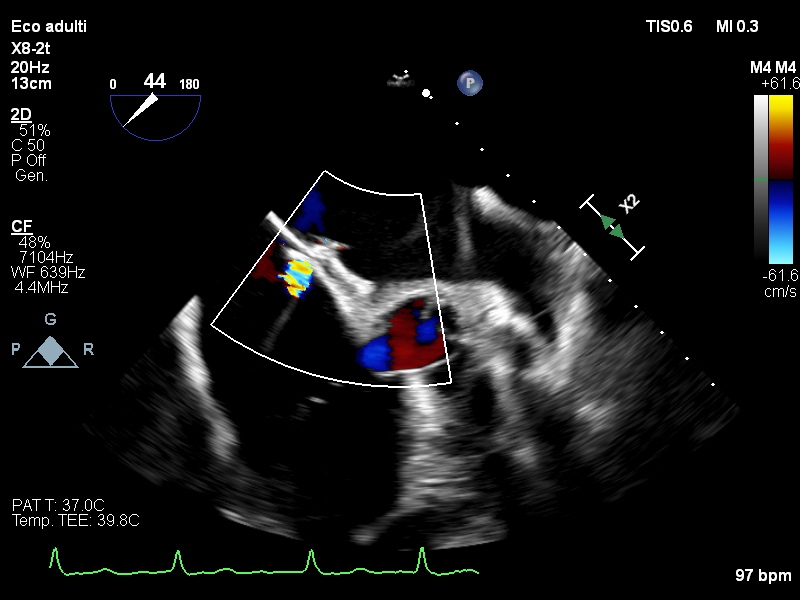
Il setto interatriale presentava esiti di chiusura di DIA tipo ostium secundum con evidenza di uno shunt residuo a livello centrale, da verosimile perforazione degenerativa (Figura 1).
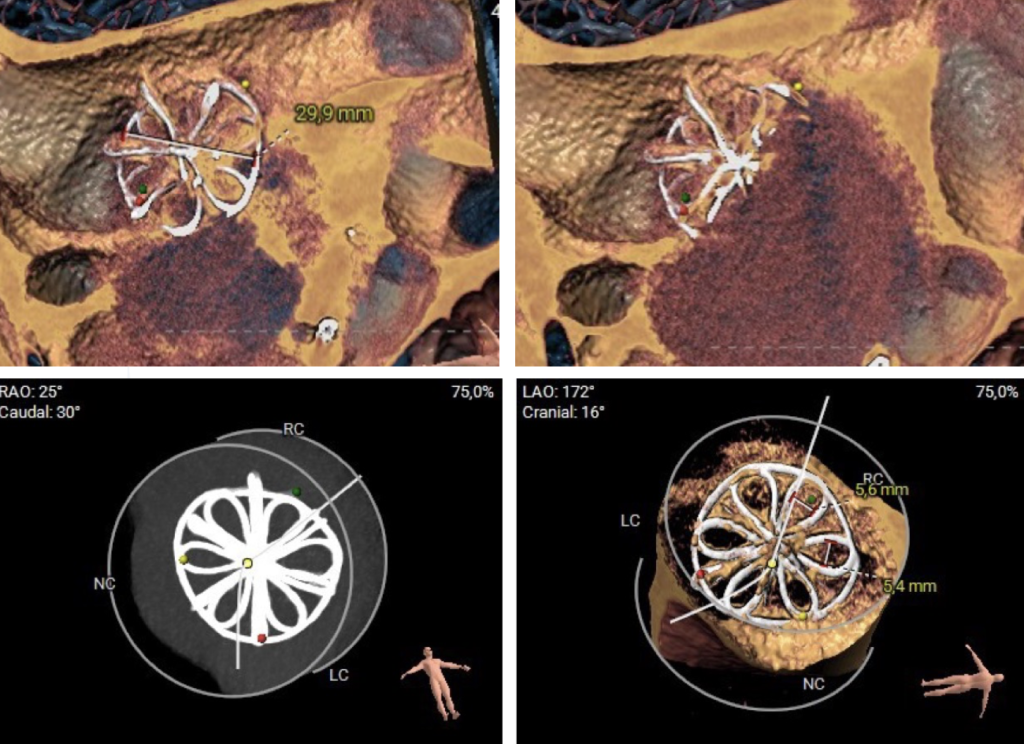
Ai fini dell’appropriata pianificazione dell’intervento, e per la sicurezza della puntura transettale, veniva effettuata una tomografia computerizzata (TC) cardiaca con successive ricostruzioni 3D, che mostrava un occlusore nel setto interatriale con membrana in alcol polivinilico che ricopriva un telaio in nitinol su dischi arrotondati, confermando la possibilità di far procedere con sicurezza il device per la LAAC attraverso la perforazione degenerativa a livello centrale (Figura 2). Veniva eseguito inoltre un cateterismo cardiaco destro, che mostrava pressioni polmonari ai limiti superiori, normale portata cardiaca e un Qp/Qs di 1,54 con basse resistenze vascolari polmonari (1,5 unità wood). Dati i risultati del cateterismo cardiaco e la dilatazione delle sezioni destre all’ecocardiogramma, in paziente sintomatico per dispnea da sforzi moderati, veniva posta anche indicazione a chiusura percutanea della soluzione di continuità del device degenerato.
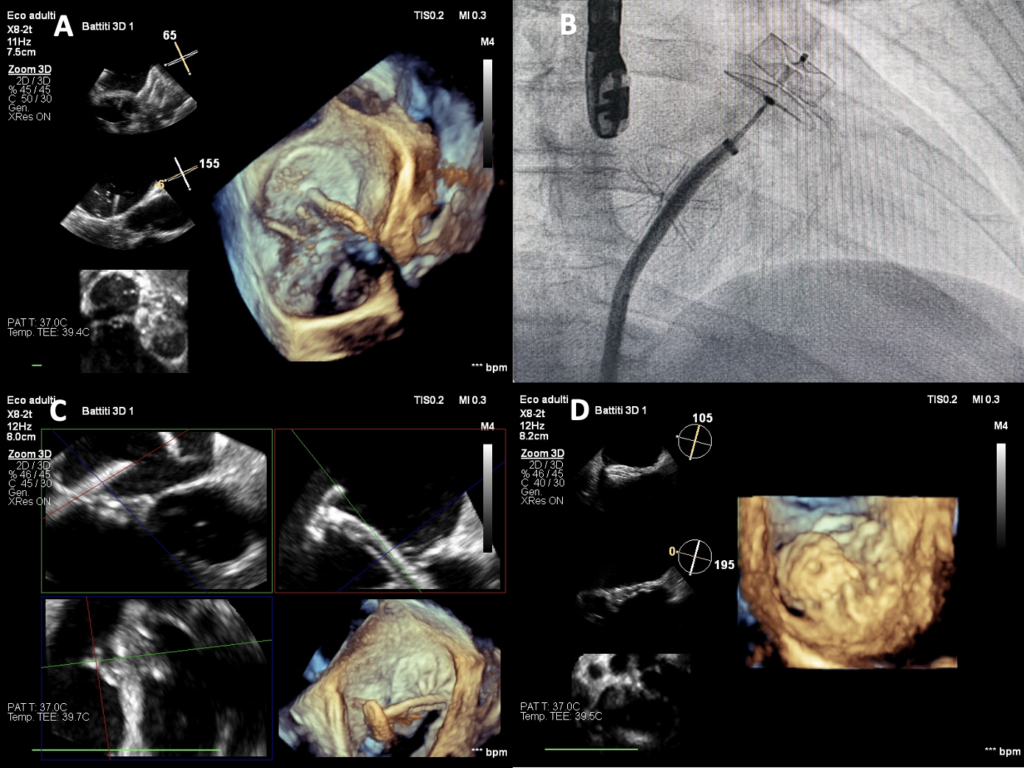
(C e D) Ecocardiografia transesofagea con ricostruzione 3D che mostra chiusura della soluzione di continuità dell’occlusore sul setto interatriale con dispositivo Amplatzer® Septal Occluder 8 mm.
Veniva quindi posizionato in auricola sinistra un dispositivo Amplatzer® Amulet 25 mm mediante accesso venoso femorale destro e procedendo a puntura transettale ecoguidata nella soluzione di continuità dell’occlusore del DIA (Figura 3, A-B). Durante la stessa procedura veniva successivamente eseguita anche la chiusura della soluzione di continuo del DIA con protesi Amplatzer® Septal Occluder 8 mm (Figura 3, C-D). Non essendosi verificate complicanze, due giorni dopo, il paziente veniva dimesso al domicilio in duplice terapia antiaggregante, avendo sospeso quella anticoagulante orale.
Tre mesi dopo veniva effettuata una rivalutazione completa del paziente, che riferiva riduzione degli episodi di rettorragia con livelli ematici di emoglobina stabili e miglioramento della dispnea. All’ETE il device sul DIA era normoposizionato e con infusione di soluzione fisiologica sonicata non vi era passaggio di microbolle dopo la manovra di Valsalva. Anche il device in auricola sinistra risultava ben posizionato.
DISCUSSIONE
La terapia anticoagulante orale è una pratica ormai consolidata per la prevenzione di eventi tromboembolici nei pazienti con FA, seppur gravata da un aumentato rischio di complicanze emorragiche. Fino al 90% delle formazioni trombotiche del cuore si formano in auricola sinistra1 e la LAAC si è dimostrata non inferiore rispetto alla terapia anticoagulante orale nella prevenzione del tromboembolismo da FA nei pazienti ad alto rischio di sanguinamento2, come quelli con patologia neoplastica3-4. La puntura transettale rappresenta uno step critico di tale procedura e la presenza in tale sede di un dispositivo occlusore nel setto interatriale potrebbe presentare un ostacolo importante per il successo della LAAC, sia per la ridotta area anatomica del setto disponibile per la puntura sia per la sua potenziale limitazione alla manovrabilità del device. Nonostante queste difficoltà tecniche, in letteratura sono disponibili alcuni esempi di esiti favorevoli di LAAC dopo chiusura del setto interatriale5. Una simile manovra viene per la prima volta descritta da Zaker-Shahrak et al6, durante puntura transettale eseguita per ablazione transcatetere di FA. In tutti questi casi però la zona utilizzata per la puntura transettale era quella adiacente all’occlusore del DIA o del forame ovale pervio. Allo stato attuale delle nostre conoscenze, questo è il primo caso descritto in letteratura in cui la puntura transettale per la LAAC viene effettuata attraverso una soluzione di continuo già presente in un device precedentemente posizionato sul setto interatriale. Nel caso clinico presentato una forte limitazione potenziale alla procedura era rappresentata dalla scarsità della documentazione disponibile sulle caratteristiche del dispositivo occlusore: grazie all’ETE e alla TC è stato possibile tuttavia risalire alle caratteristiche specifiche in modo da pianificare un intervento che riducesse al minimo le possibili complicanze (in particolare la sua dislocazione).
CONCLUSIONE
La LAAC è una valida alternativa nei pazienti con FA che presentano controindicazioni alla terapia anticoagulante. La presenza di un dispositivo precedentemente impiantato sul setto interatriale non preclude a priori la fattibilità ed il successo di tale procedura. L’utilizzo di tecniche di imaging appropriate per la pianificazione dell’intervento, come l’ETE e la TC, può consentire di effettuare la puntura transettale in sicurezza in modo da garantire il successo della LAAC.
BIGLIOGRAFIA
- Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg (1996); 61:755–9.
- Hindricks G, Potpara T, Dagres N et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS), Eur Heart J (2020) 42, 373-498.
- Prandoni P, Falanga A, Piccioli A. Cancer and venous thromboembolism. Lancet Oncol (2005); 6(6): 401-410.
- Prandoni P, Lensing AW, Piccioli A, et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis, Blood (2002); 100(10): 3484-3488.
- Koermendy D, Nietlispach F, Shakir S et al. Amplatzer left atrial appendage occlusion through a patent foramen ovale. Catheter Cardiovasc Interv (2014); 84:1190-1196.
- Zaker-Shahrak R, Fuhrer J, Meier B. Transseptal puncture for catheter ablation of atrial fibrillation after device closure of patent foramen ovale. Catheter Cardiovasc Interv (2008); 71:551-552.
Neuromodulazione in acuto e in cronico nella gestione di un complesso caso di storm aritmico refrattario: il blocco percutaneo del ganglio stellato di sinistra continuo come bridge alla denervazione simpatica cardiaca bilaterale
Sara Compagnoni1,2, Enrico Baldi2, Simone Savastano2
1 Scuola di Specializzazione in Malattie dell’Apparato Cardiovascolare, Università degli Studi di Pavia
2 Unità di Aritmologia ed Elettrofisiologia, Divisione di Cardiologia, Fondazione IRCCS Policlinico San Matteo, Pavia
ABSTRACT
Il trattamento dello storm aritmico rappresenta una delle maggiori sfide che i cardiologi o gli intensivisti si trovano ad affrontare, specialmente quando il quadro è caratterizzato da aritmie ventricolari ricorrenti e refrattarie al trattamento convenzionale. In questo contesto, il blocco percutaneo del ganglio stellato di sinistra (PLSGB) e la denervazione simpatica cardiaca bilaterale (BCSD) rappresentano degli approcci antiaritmici promettenti. In questo caso clinico presentiamo la prima evidenza dell’efficacia e della sicurezza di un PLSGB con infusione continua di anestetico come bridge alla BCSD.
INTRODUZIONE
Lo storm aritmico viene definito come la presenza di almeno tre episodi di aritmie ventricolari sostenute o trattate in 24 ore: si tratta di una situazione critica, ad elevata mortalità e dal difficile trattamento, in cui il fattore tempo è fondamentale. Perciò, una volta identificate le possibili cause reversibili ed iniziati tutti i trattamenti disponibili, bisogna mettere in atto una strategia rapida e agevole, che, sebbene temporanea, consenta la stabilizzazione del paziente affinché possa essere sottoposto ad un trattamento definitivo (denervazione cardiaca sinistra, ablazione transcatetere).
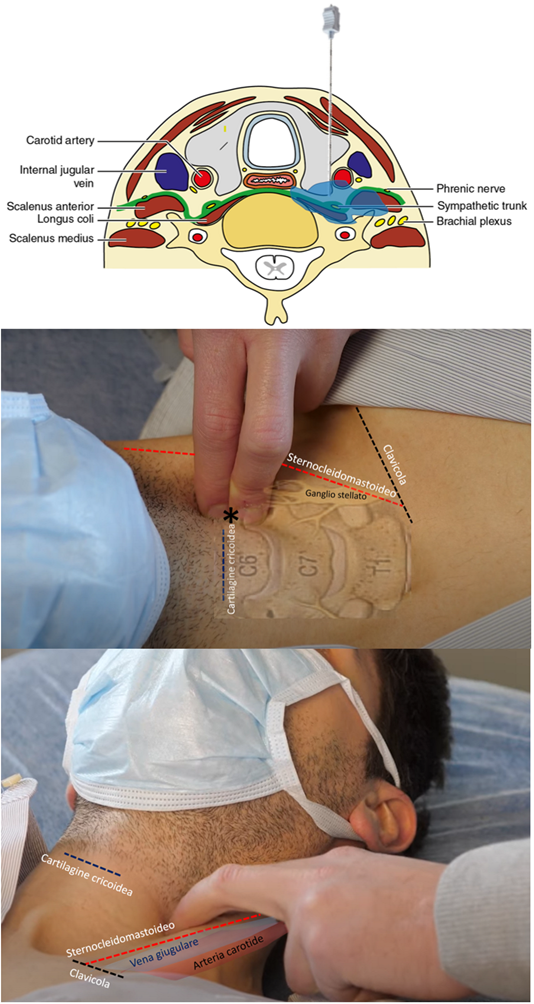
Il sistema nervoso simpatico gioca un ruolo centrale sia nell’induzione che nel mantenimento delle aritmie ventricolari: il blocco della catena simpatica mediante il PLSGB può interrompere in loco il circolo vizioso alla base dello storm aritmico.
Il PLSGB può essere eseguito con due tecniche: l’approccio anteriore anatomico consiste nell’inserimento di un ago fino al processo trasverso di C6 e l’iniezione di anestetico a livello del tubercolo di Chassaignac a sinistra (Figura 1);
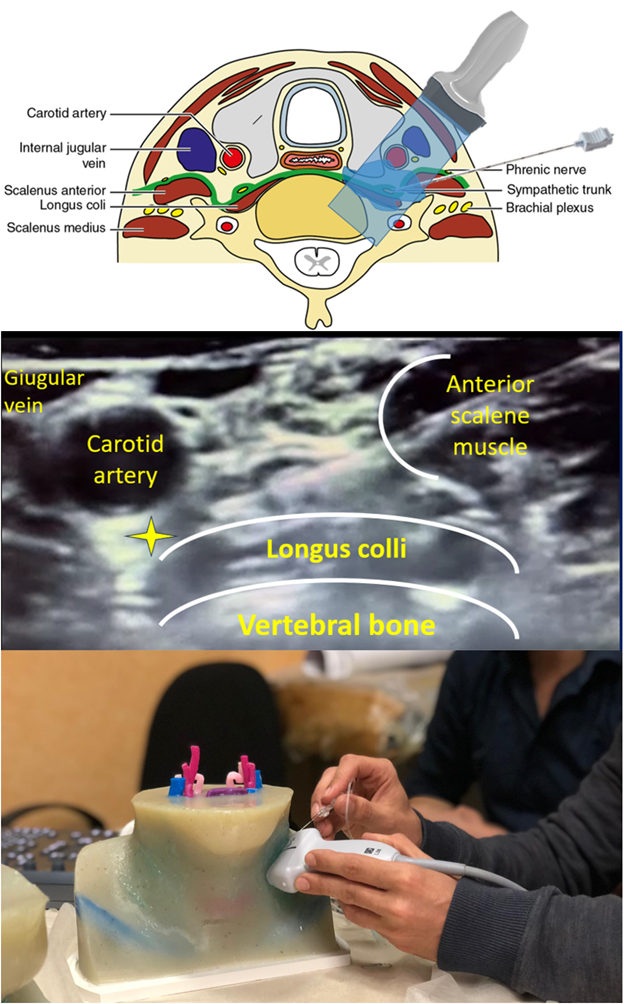
l’approccio laterale eco-guidato consiste nell’inserimento dell’ago attraverso lo scaleno anteriore e l’iniezione di anestetico sopra il muscolo lungo del collo e sotto la carotide sinistra (Figura 2).
CASO CLINICO
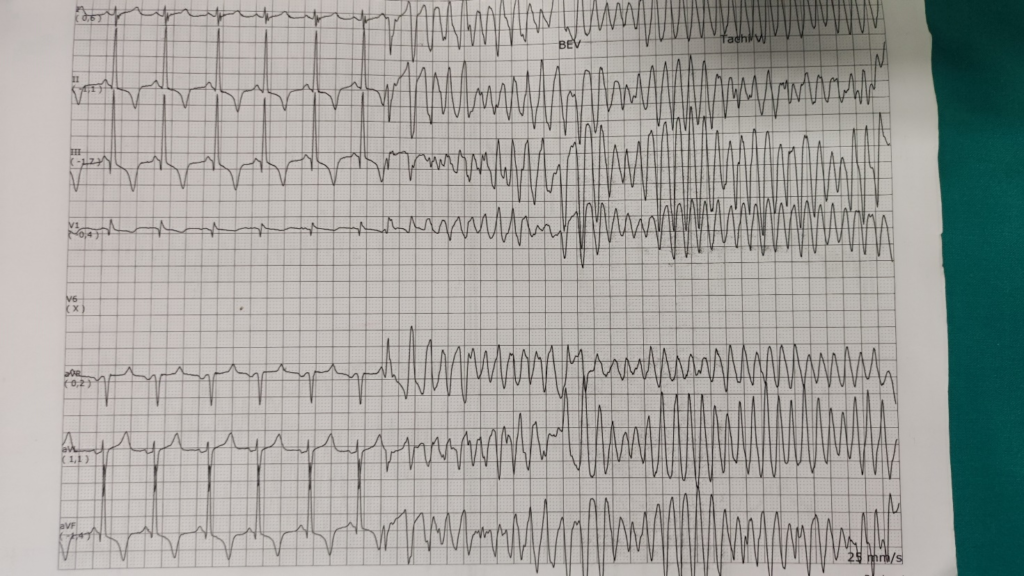
Un uomo di 62 anni con un pregresso infarto miocardico anteriore, avvenuto tre mesi prima, e complicatosi con rottura del setto interventricolare riparato chirurgicamente, veniva ricoverato presso la Fondazione IRCCS Policlinico San Matteo di Pavia per un arresto cardiaco extra-ospedaliero, il cui ritmo di presentazione era una fibrillazione ventricolare, trattata con uno shock efficace nell’ottenere il ROSC.
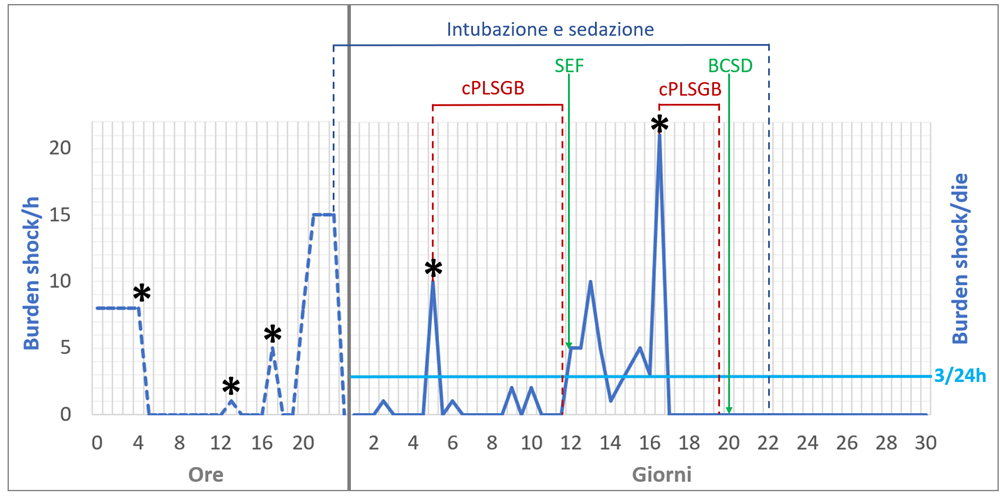
Alla coronarografia non venivano riscontrate lesioni coronariche acute, oltre alla nota ostruzione cronica dell’arteria interventricolare anteriore. All’ecocardiogramma, la frazione di eiezione del ventricolo sinistro era pari al 40% in presenza di un’acinesia dell’apice e del setto interventricolare distale. Gli esami ematochimici non mettevano in evidenza alterazioni degli elettroliti. Veniva disposto il ricovero in Unità di Terapia Intensiva Coronarica, dove, dopo poche ore, si verificava uno storm aritmico, con aritmie ventricolari polimorfe sostenute, provocate da extrasistoli ventricolari polimorfe con intervallo di accoppiamento breve, e necessitanti numerosi shock del defibrillatore. Le aritmie ventricolari risultavano refrattarie all’amiodarone, alla lidocaina e al solfato di magnesio somministrati per via endovenosa. Sebbene il paziente fosse in terapia antiaggregante e anticoagulante, dopo l’ottavo DC-shock veniva eseguito il PLSGB mediante l’approccio anteriore anatomico, iniettando un bolo di 100 mg di lidocaina e 50 mg di bupivacaina. Dopo sette ore senza aritmie, si ripresentavano nuovamente aritmie ventricolari polimorfe sostenute, nonostante la terapia massimale con antiaritmici, esmololo, sedazione ed intubazione. La ripetizione dei PLSGB costituiva l’unico modo per ridurre il burden aritmico, con un netto peggioramento delle aritmie ventricolari al termine dell’emivita dell’anestetico. Pertanto, dopo il quarto PLSGB mediante bolo di anestetico, veniva lasciato in sede un catetere epidurale (Perifix® di Braun Germany) per l’infusione continua di lidocaina al 2% a 7 mL/h e il paziente veniva trasferito in Rianimazione. Dopo sette giorni di stabilità dal punto di vista aritmico, con evidenza esclusivamente di extrasistolia ventricolare isolata, si decideva di rimuovere il catetere epidurale e di interrompere il PLSGB con infusione continua. Tuttavia, dopo poche ore si ripresentava un ulteriore storm aritmico, pertanto veniva eseguito un tentativo urgente di ablazione transcatetere delle extrasistoli ventricolari precoci mediante radiofrequenza, fallito a causa dell’instabilità emodinamica del paziente e dell’origine polimorfica dell’extrasistolia ventricolare. Veniva quindi programmato un intervento di BCSD, tuttavia posticipato a causa di uno shock settico da Klebsiella Aerogenes, responsabile di un ulteriore storm aritmico severo, necessitante circa 20 DC-shock. Come terapia ponte alla BSCD, veniva eseguito un secondo PLSGB continuo, in seguito al quale non si sono più ripresentate aritmie ventricolari sostenute. Dopo la risoluzione della sepsi, veniva eseguita con successo la BCSD per via toracoscopica e successivamente veniva impiantato un ICD sottocutaneo: di particolare interesse era il fatto che, durante il test d’induzione al termine dell’impianto, la fibrillazione ventricolare risultava difficilmente inducibile. Durante un follow-up di oltre quattro anni, non sono state più registrate aritmie né ai controlli ambulatoriali né al monitoraggio remoto del defibrillatore, e la frazione d’eiezione del ventricolo sinistro è tornata ai valori antecedenti il ricovero (FEVS 40%).
DISCUSSIONE
In letteratura, il PLSGB1,2 e la BCSD3 sono stati descritti come armi efficaci e sicure rispettivamente per il trattamento acuto e la prevenzione delle aritmie ventricolari. Questo rappresenta il primo caso segnalato di PLSGB con infusione continua eseguito come ponte alla BCSD. Mancano studi prospettivi a riguardo, ma è ipotizzabile che l’effetto acuto possa predire il risultato a lungo termine della BCSD. Una strategia alternativa in acuto avrebbe potuto essere l’anestesia epidurale toracica (TEA)4 associata ad un blocco adrenergico più esteso, ma gravata da un rischio infettivo ed emorragico non trascurabile, oltre a richiedere una posizione laterale e una competenza anestesiologica. Il PLSGB continuo, invece, ha un minore potenziale infettivo atteso, non richiede la sospensione della terapia antiaggregante e anticoagulante e può essere eseguito anche da un cardiologo al letto del paziente.
BIBLIOGRAFIA
- Savastano S, Schwartz PJ. Blocking nerves and saving lives: Left stellate ganglion block for electrical storms. Hear Rhythm. 2023;20(7):1039-1047. doi:10.1016/J.HRTHM.2022.11.025
- Savastano S, Dusi V, Baldi E, et al. Anatomical-based percutaneous left stellate ganglion block in patients with drug-refractory electrical storm and structural heart disease: a single-centre case series. EP Eur. 2021;23(4):581-586. doi:10.1093/EUROPACE/EUAA319
- Vaseghi M, Gima J, Kanaan C, et al. Cardiac sympathetic denervation in patients with refractory ventricular arrhythmias or electrical storm: Intermediate and long-term follow-up. Hear Rhythm. 2014;11(3):360-366. doi:10.1016/J.HRTHM.2013.11.028
- Do DH, Bradfield J, Ajijola OA, et al. Thoracic epidural anesthesia can be effective for the short-term management of ventricular tachycardia storm. J Am Heart Assoc. 2017;6(11). doi:10.1161/JAHA.117.007080
Un caso di miocardite trombofilica: come destreggiarsi tra diagnosi e terapia
Navacchi Rebecca, Signoretta Gianluca, Grassi Francesca, Paoli Giorgia, Notarangelo Maria Francesca
1 Unità operativa di Cardiologia, Dipartimento cardio-toraco-vascolare, Azienda Ospedaliera Universitaria di Parma, Parma
ABSTRACT
Diversi sono ancora i punti insoluti in ambito di miocardite e variano dall’eziopatogenesi agli strumenti diagnostici fino alle strategie terapeutiche. Le infezioni virali ne sono generalmente la causa principale, ma sono state descritte anche forme su base autoimmune o tossica.
La risonanza magnetica nucleare (RMN) costituisce sicuramente l’esame diagnostico fondamentale, sufficiente di solito ad un corretto inquadramento clinico. In una minoranza di casi però essa non basta e occorre ricorrere a una procedura invasiva come la biopsia endomiocardica per giungere a una diagnosi definitiva e di conseguenza alla migliore terapia possibile.
Presentiamo il caso di un giovane paziente con un quadro di miocardite subacuta condizionante una severa disfunzione ventricolare, presentatasi clinicamente in associazione a trombosi cardiaca e a multiple embolizzazioni polmonari, risultata responsiva esclusivamente a terapia immunosoppressiva.
INTRODUZIONE
La miocardite riconosce diversi possibili meccanismi eziopatogenetici (infettivi, autoimmuni, farmacologici, reazioni da ipersensibilità, disordini sistemici, altre forme rare), ma predominano indubbiamente le infezioni virali, il più delle volte clinicamente misconosciute [1].
Una variante meno comune è la miocardite eosinofila. Questo sottotipo, che rimane ampiamente sottodiagnosticato probabilmente anche in relazione allo scarso impiego della biopsia endomiocardica, si riscontra maggiormente nei pazienti affetti da mielodisplasia, tumori solidi o parassitosi. L’infiltrato eosinofilico può mediare direttamente il danno cellulare, ma si verifica anche un’iperattivazione del sistema immunitario e della cascata della coagulazione, con esponenziale aumento del rischio trombotico. [1].
Nel complesso gli esperti concordano infine nel considerare due possibili scenari clinici d’esordio:
- Miocardite acuta (entro 30 giorni dall’insorgenza): senza dilatazione o disfunzione ventricolare sinistra, ma con un esordio clinico improvviso, talvolta necessitante di supporto emodinamico. E’ caratterizzata istologicamente da abbondante infiltrato infiammatorio.
- Cardiomiopatia infiammatoria cronica (> 30 giorni): contraddistinta da grave disfunzione ventricolare e da una sintomatologia clinica da scompenso cardiaco. Si caratterizza dal punto di vista istologico per la relativa scarsità dell’infiltrato infiammatorio [1].
CASO CLINICO
Presentiamo il caso di un ragazzo di 27 anni originario della Costa d’Avorio, in Italia da circa 4/5 anni, con anamnesi patologica e familiare muta per patologie di rilievo.
Nell’ambito di una visita cardiologica effettuata in previsione di un intervento urologico venivano riscontrate all’elettrocardiogramma (ECG) alterazioni della ripolarizzazione di tipo sovraccarico-ischemico. Il paziente inoltre riferiva dispnea da sforzo da circa un mese con associata tosse secca scarsamente responsiva alla terapia antibiotica impostata in precedenza dal Curante. L’iter diagnostico ambulatoriale proseguiva pertanto con esecuzione di ecocardiogramma che evidenziava un ventricolo sinistro severamente dilatato e globoso, con grave disfunzione sistolica (FEVSn 20%) ed aumentate pressioni polmonari stimate. Gli ECG successivi mostravano un’evoluzione con sviluppo di onde T negative nelle derivazioni precordiali. Il dosaggio delle troponine risultava significativamente aumentato (TnI Hs 8750 ng/dl). Alla luce del quadro di scompenso cardiaco in severa cardiopatia ipocinetica-dilatativa di nuovo riscontro il paziente veniva centralizzato presso il nostro centro per il proseguimento del dépistage diagnostico.
All’ingresso in reparto il paziente si presentava profusamente astenico, con dispnea da minimi sforzi (Classe NYHA III-IV), epigastralgia sfumata pressochè costante, disfagia e tosse secca esacerbata al momento dei pasti. Agli esami di laboratorio all’ingresso si riscontrava: TnI Hs 4800 ng/l, BNP 1188 pg/ml e PCR 4,9 mg/dl.
Una volta ottimizzato il quadro emodinamico si è proceduto a titolare la terapia anti-scompenso.
Nei giorni seguenti sono state effettuate ulteriori indagini, quali:
- Esami ematochimici di secondo livello, con pannelli infettivologici, di autoimmunità e trombofilia, risultati tutti sostanzialmente negativi ma con rialzo marcato delle IgE (2110 IU/mL, 5 volte la norma)
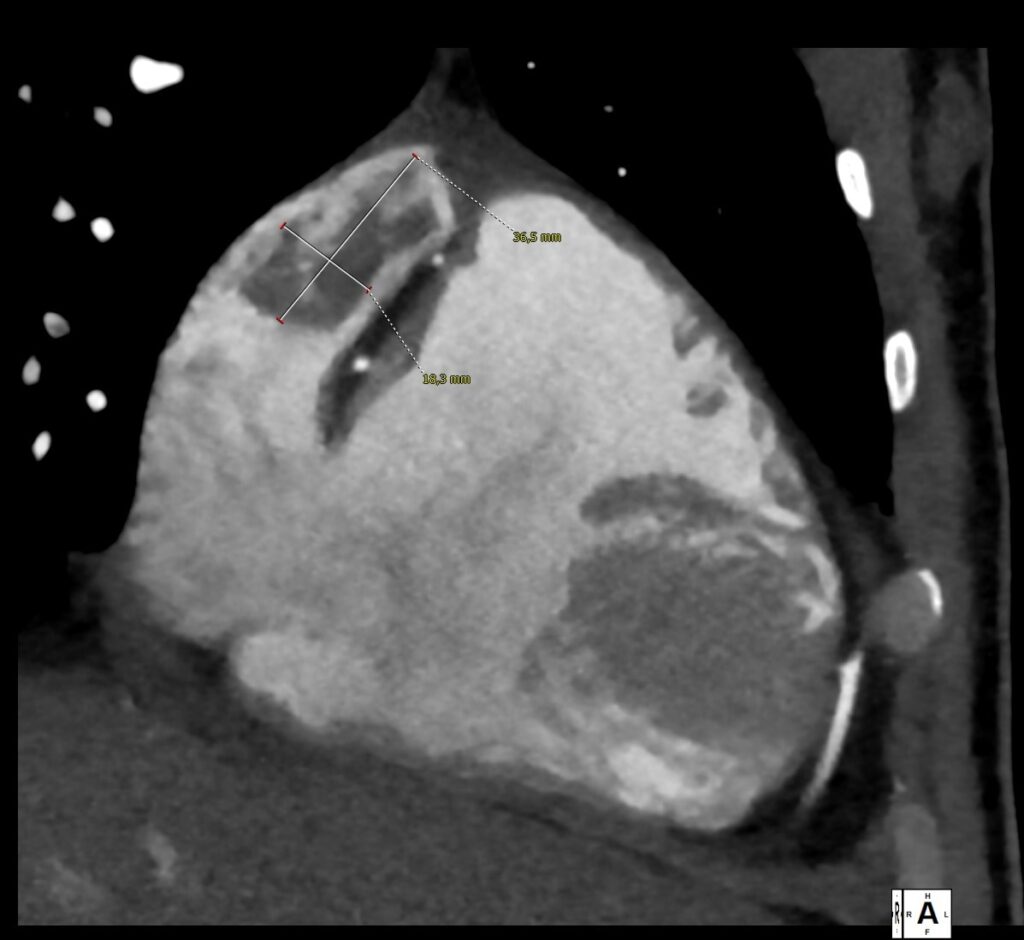
- TC torace e coronaro-TC che escludevano coronaropatie ma rilevavano un quadro di TEP con una piccola consolidazione a livello del parenchima basale-posteriore destro, con cercine a densità ground-glass, compatibile con infarto polmonare. Venivano segnalate inoltre trombosi intracavitarie in auricola destra e a livello apicale del ventricolo sinistro (immagine 1).Si avviava pertanto terapia anticoagulante con eparina a basso peso molecolare (EBPM).
- RM cuore, che confermava una severa dilatazione ed ipocinesia biventricolare (FEVSn 21% e FEVDx 31%) evidenziando positività al LGE oltre che alle sequenze T2 pesate con edema a carico della parete antero-laterale, a distribuzione subepicardica, compatibile con miocardite.
Sebbene in tale contesto la biopsia cardiaca sarebbe risultata di estrema utilità, la presenza di multiple formazioni trombotiche ha rappresentato in questa fase una controindicazione assoluta a qualunque procedura invasiva.
Ci siamo pertanto interrogati sulle varie possibili alternative diagnostiche: data la negatività degli esami microbiologici ma alla luce della spiccata tendenza alla trombosi e all’aumentato valore di IgE, pur in presenza di una normale conta eosinofilica, il nostro primo sospetto è stata la miocardite eosinofila.
Dopo una progressiva normalizzazione degli indici di flogosi e in assenza di elementi clinici suggestivi di infezione, si è avviata una terapia corticosteroidea a dosaggio immunosoppressivo, con metilprednisolone come da protocollo: 1gr per 3 giorni, 70 gr per 7 giorni, 50 gr per 6 giorni, 45 gr per 4 giorni e in seguito a scalare 5 gr ogni 4 giorni fino a sospensione [2].
Nel sospetto di esofagite eosinofila che potesse giustificare il quadro di disfagia e contemporaneamente confermare il nostro sospetto di miocardite eosinofila, è stata inoltre eseguita un’EGDS con biopsia, risultata però negativa per la presenza di inclusi eosinofili.
In corso di ricovero si è osservato un episodio di dolore toracico urente con tosse incessante, associato a un aumento degli indici di flogosi (PCR fino a 141 mg/dl) e significativo rialzo troponinico (TnI Hs 17655 ng/dl). Alla TC torace eseguita in urgenza si è evidenziato l’espansione dell’area di consolidamento polmonare e la formazione di una nuova trombosi a livello della parete inferiore ventricolare sinistra, con regressione delle trombosi precedentemente evidenziate.
Si proseguiva pertanto la terapia anticoagulante embricando Coumadin con EBPM. fino a raggiungimento del target INR 2-3.
Una volta ottenuta la regressione completa della trombosi endoventricolare si è potuto eseguire una biopsia endomiocardica, avvenuta a livello del setto interventricolare destro. Sul campione bioptico è stato identificato il Parvovirus B19, con aree di fibrosi perivascolare in assenza di florido infiltrato infiammatorio.
Tale dato purtroppo non è risultato clinicamente diagnostico: la presenza di Parvovirus alla biopsia infatti non è significativa se non è associata alla positività della sierologia e ad un infiltrato infiammatorio alla biopsia, visto che la presenza di tale virus è stata descritta in casi di miocardite in cui però non ha alcun ruolo causale [3].
Non ci è stato possibile escludere che il mancato isolamento nel siero del virus e l’assenza di infiltrazione infiammatoria siano in realtà dei falsi negativi, dovuti alla terapia immunosoppressiva intrapresa: quest’ultima però si era d’altro canto resa necessaria alla luce della scarsa risposta del paziente alla terapia convenzionale.
Durante la successiva degenza, dopo circa tre mesi di terapia antirimodellamento, il paziente ha eseguito una RMN cuore di rivalutazione, con evidenza di mancato recupero della contrattilità sinistra (FEVSn 27%) con un discreto miglioramento della contrattilità destra (FEVDx 45%). All’LGE veniva descritta nuova area di edema con lesione a livello subepicardio/transmurale a carico della parete inferiore medio-basale sinistra. Permaneva invariato il focolaio di edema e LGE della parete antero-laterale (immagine 2).
Si procedeva pertanto a impianto di ICD in prevenzione primaria, anche alla luce delle frequenti TVNS scarsamente responsive al betabloccante evidenziate al monitoraggio telemetrico.
In considerazione della stabilità clinica il paziente veniva trasferito presso altra struttura per un breve ciclo riabilitativo. Si rendeva necessaria però dopo qualche settimana nuova centralizzazione per scarica del device su FV (immagine 3), verosimilmente innescata da una subottimale titolazione della terapia antiaritmica.
Previa stabilizzazione clinica il paziente veniva dimesso con la seguente prescrizione terapeutica: ARNI a basso dosaggio, SGLT2i, MRA, betabloccante a basso dosaggio, AVK e amiodarone.
Attualmente il paziente è in follow up presso il centro di III livello di Bologna per esecuzione di ulteriori accertamenti, inclusi screening trapiantologico e studi genetici per cardiomiopatie (ancora in corso). E’ stata inoltre eseguita una nuova biopsia endomiocardica, risultata anch’essa negativa per miocardite attiva e con lieve/moderata fibrosi interstiziale.
DISCUSSIONE
Una diffusa trombosi può essere riscontrata in corso di miocardite, più tipicamente nel caso della miocardite eosinofila, ma anche in caso di infezione mediata da Parvovirus B19 [4, 5, 6]. Per quanto riguarda la gestione farmacologica della complicanza trombotica, iniziano a comparire studi sul ruolo della terapia anticoagulante nelle miocarditi eosinofile, oltre che proposte di protocolli immunosoppressivi [2, 4, 5]. Per quanto riguarda la diagnostica invece, per questo sottotipo di patologia, in letteratura sono stati riportati casi in cui la miocardite eosinofila può presentarsi senza eosinofilia periferica, mentre il quadro istologico caratteristico è di infiltrato eosinofilo con presenza di cellule giganti multinucleate [7]. Importante resta la diagnosi differenziale con le altre varianti, tra cui quella descritta nel nostro caso; in corso di miocardite da Parvovirus B19 infatti l’infiammazione tende piuttosto a concentrarsi in sede perivascolare [3].
Questo caso clinico ci ha posto davanti a un bivio: da un lato avevamo una condizione clinica precaria, con episodi recidivanti di embolia polmonare e il contemporaneo rischio di embolizzazione sistemica massiva, e la necessità di ricorrere a una terapia immunosoppressiva ad alti dosaggi; dall’altro vi era la consapevolezza che quest’ultima avrebbe però potuto influenzare negativamente ulteriori importanti accertamenti, tra cui la biopsia endomiocardica, che non si sarebbe potuta comunque eseguire senza risoluzione del quadro trombotico.
Alla fine ha prevalso la necessità di curare al meglio nell’immediato il paziente, anche a costo di rinunciare ad arrivare a una diagnosi definitiva.
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405. Epub 2020 Nov 12. PMID: 33176455; PMCID: PMC7673642.
- Frustaci A, Chimenti C. Immunosuppressive therapy in myocarditis. Circ J. 2015;79(1):4-7. doi: 10.1253/circj.CJ-14-1192. Epub 2014 Dec 2. PMID: 25452202.
- Gun E, Bugra A. Eosinophilic myocarditis from a forensic histopathological perspective. J Forensic Sci. 2023 Mar;68(2):500-508. doi: 10.1111/1556-4029.15197. Epub 2023 Jan 12. PMID: 36633063.
- Pagura L, Imazio M, Merlo M, Sinagra G. Dieci quesiti in tema di miocardite eosinofila [Ten questions about eosinophilic myocarditis]. G Ital Cardiol (Rome). 2022 Apr;23(4):259-267. Italian. doi: 10.1714/3766.37535. PMID: 35343477.
- Bondue A, Carpentier C, Roufosse F. Hypereosinophilic syndrome: considerations for the cardiologist. Heart. 2022 Feb;108(3):164-171. doi: 10.1136/heartjnl-2020-317202. Epub 2021 Jun 25. PMID: 34172539.
- Whitehead NJ, Murch S, Leitch JW, Hackworthy RA. Acute myocarditis with thrombus near left ventricular outflow tract. Echocardiography. 2018 Apr;35(4):575-577. doi: 10.1111/echo.13840. Epub 2018 Feb 19. PMID: 29457263.
- Sugiyama E, Takenaka T, Kato M, Minoshima A, Muto H, Fujita M, Sato M, Inoue H, Nakamura H, Hasebe N. Eosinophilic myocarditis without hypereosinophilia accompanied by giant cell infiltration. J Cardiol Cases. 2015 Aug 4;12(5):169-171. doi: 10.1016/j.jccase.2015.07.004. PMID: 30546587; PMCID: PMC6281835.
Cardiotossicità da immune checkpoint inhibitors: non solo miocardite.
Daniela Di Lisi1,2, Francesca Castro2, Domenico Scelfo2, Luca Ganci2, Vincenzo Sucato1,2, Egle Corrado1,2, Giuseppina Novo1,2, Alfredo Ruggero Galassi1,2
1 Dipartimento di Cardiologia, Ospedale Universitario Paolo Giaccone, Palermo
2 Dipartimento ProMISE, Università di Palermo
ABSTRACT
Gli inibitori dei checkpoint immunitari (ICI) possono provocare effetti tossici cardiovascolari: miocardite, pericardite, vasculite, aterosclerosi accelerata, aritmie, ictus, blocchi atrio-ventricolare. La miocardite rappresenta la complicanza più frequente e temibile e, talora, può associarsi a sintomi neurologici e miosite. La diagnosi e il trattamento delle tossicità da ICI non sempre sono facili. Una diagnosi precoce e un trattamento tempestivo sono dunque essenziali per prevenire lo sviluppo di complicanze cardiovascolari severe. Descriviamo il caso di una paziente di 76 anni trattata con Pembrolizumab/Nivolumab, complicata dallo sviluppo di miocardite associata a miosite/miastenia.
INTRODUZIONE
La miocardite correlata alla terapia con inibitori dei checkpoint immunitari (ICI) è un evento avverso immuno-correlato poco comune (incidenza 0.04-1.14%), ma gravato da un alto tasso di mortalità (25-50%). Sia l’incidenza che la mortalità raddoppiano nel caso di terapia di combinazione con ICI (1). Frequentemente, la miocardite si associa a forme di miastenia-gravis e miosite. Lo spettro clinico di presentazione è assai variabile, da forme lievi con sole alterazioni ECG e laboratoristiche, a forme severe con scompenso cardiaco e danno d’organo, fino a forme fulminanti, con un quadro di instabilità emodinamica e/o aritmie fatali (1).
Descriviamo dunque il caso di una forma severa di miocardite ICI-correlata associata a miastenia gravis/miosite, paradigma di quanto la diagnosi e il trattamento di queste forme rappresenti una sfida per il cardiologo clinico.
CASO CLINICO
Una donna di 76 anni affetta da melanoma ulcerato al I dito del piede sinistro metastatico è stata ricoverata presso la nostra U.O di Cardiologia, a seguito dell’insorgenza di severa astenia, dispnea, edemi declivi e periorbitario con ptosi palpebrale bilaterale venti giorni dopo la somministrazione del primo ciclo di Pembrolizumab-Nivolumab. All’ECG si documentava fibrillazione atriale, emiblocco posteriore sinistro e blocco di branca destra (Figura 1). Agli esami ematochimici: aumento significativo degli indici di citolisi epatica, LDH, CPK, Troponina T ad alta sensibilità, mioglobina ed NT-proBNP. All’ecocardiogramma color-Doppler: ventricolo sinistro di dimensioni endocavitarie ai limiti superiori di norma, ipocinesia della parete inferiore basale e media; funzione sistolica ventricolare sinistra lievemente ridotta (FE biplana 44%); riduzione degli indici di deformazione miocardica del ventricolo sinistro (GLS -17,2% con picco sistolico di strain maggiormente ridotto a livello dei segmenti inferiori) (Figura 2). Al monitoraggio ECG-grafico si osservavano episodi di tachicardia ventricolare non sostenuta. La paziente lamentava inoltre diffuse algie muscolari per cui veniva eseguito dosaggio degli anticorpi anti-AchR e anti-Musk, risultati negativi. Nel sospetto clinico-strumentale di miocardite e miosite periferica da ICI, la paziente veniva trattata con metilprednisolone ad alte dosi (1000 mg/die) con scarso beneficio. Infatti, durante la degenza si assisteva a progressivo deterioramento delle condizioni cliniche (ipotensione, oligo-anuria, insufficienza respiratoria) con conseguente necessità di supporto inotropo e ,ventilazione non invasiva. Il quadro di instabilità emodinamica non consentiva, pertanto, il ricorso a test diagnostici di conferma, quali la risonanza magnetica cardiaca, e rendeva necessario il trasferimento in terapia intensiva, dove veniva eseguita terapia immunosoppressiva di II linea in associazione a plasmaferesi. Tuttavia, la paziente andava incontro ad exitus.
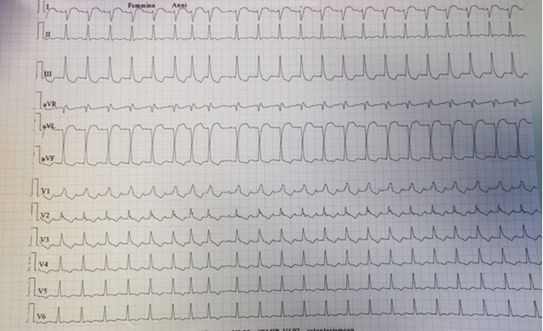
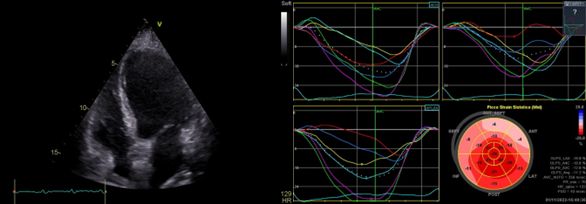
DISCUSSIONE
La miocardite ICI-correlata insorge frequentemente nelle prime 12 settimane dalla somministrazione del farmaco. Il sospetto iniziale è basato sulla valutazione dei sintomi (dispnea, astenia, dolore toracico), sull’incremento dei valori di troponina e sulla comparsa di alterazioni ECG (per es. sotto-slivellamento del segmento ST, inversione diffusa delle onde T, frequenti extrasistoli e aritmie ventricolari, disturbi di conduzione di nuova insorgenza, etc.), ecocardiografiche (riduzione della frazione d’eiezione e anomalie della cinesi segmentaria) e presenza alla risonanza magnetica cuore dei criteri di Lake Louise modificati. (1) (2) (3) Spesso tale forma di miocardite si associa a concomitante presenza di miosite/miastenia gravis, con sieronegatività anticorpale (4). In letteratura casi similari di sovrapposizione della miocardite da ICI con miosite/miastenia sono stati documentati. Il trattamento della tossicità neurologica non sempre è facile. Il nostro caso sottolinea l’importanza di una valutazione globale (cardiologica e neurologica) e di una diagnosi e trattamento tempestivi. L’ecocardiogramma e la risonanza magnetica cardiaca rappresentano il gold standard nella diagnosi non invasiva di miocardite. Il global longitudinal strain (GLS) del ventricolo sinistro può fornire importanti dati prognostici nei pazienti con miocardite (5). Il trattamento si basa sull’uso tempestivo di immunosoppressori. Le recenti linee guida europee (6) raccomandano di iniziare quanto prima il trattamento con alte dosi di metilpredinisolone per almeno 3-5 giorni e di valutare la risposta clinica. In caso di mancato miglioramento (miocardite refrattaria) viene suggerito di intraprendere un trattamento con immunosoppressori di II linea (micofenolato mofetitile, abatacept, alemtuzumab, etc.) o con altre metodiche quali la plasmaferesi. Il nostro caso evidenzia quanto sia necessario durante terapia con ICI il monitoraggio ECG e dei livelli di troponina per poter diagnosticare precocemente l’eventuale insorgenza di effetti tossici cardiovascolari, in quanto anche una singola dose di tali farmaci può avere conseguenze severe.
In conclusione, sebbene la terapia con ICI stia rivoluzionando la storia naturale di molti tumori, la coesistenza di effetti benefici e cardiotossici anche fulminanti, pone ogni cardiologo nelle condizioni di dover risolvere “il mistero diagnostico” legato a tali farmaci, soprattutto nei casi di overlap miocardite/miosite periferica e/o altri sintomi neurologici.
BIBLIOGRAFIA
- Palaskas N, Lopez-Mattei J, Durand JB, et al. Immune Checkpoint Inhibitor Myocarditis: Pathophysiological Characteristics, Diagnosis, and Treatment. J Am Heart Assoc. 2020;9(2): e013757.
- Ferreira VM, Schulz-Menger J, Holmvang G, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018;72(24):3158-3176.
- Luetkens JA, Faron A, Isaak A, et al. Comparison of original and 2018 Lake Louise criteria for diagnosis of acute myocarditis: results of a validation cohort. Radiology: Cardiothoracic Imaging. 2019;1: e190010.
- Huang YT, Chen YP, Lin WC, et al. Immune Checkpoint Inhibitor-Induced Myasthenia Gravis. Front Neurol. 2020 Jul 16; 11:634.
- Awadalla M, Mahmood SS, Groarke JD, et al. Global Longitudinal Strain and Cardiac Events in Patients with Immune Checkpoint Inhibitor-Related Myocarditis. J Am Coll Cardiol. 2020; 75:467-478
- Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-4361.