Pacing del Sistema di Conduzione per re sincronizzare il cuore trapiantato: un case-report
Amato Santoro MD2; Claudia Baiocchi MD2; Simone Taddeucci MD1; Giacomo Merello MD1; Federico Landra MD1; Carmine Marallo MD1; Matteo Cameli MD-PhD1
1Dipartimento Biotecnologie Mediche, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia
2Dipartimento Cardio-toraco-vascolare, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia
ABSTRACT
Abbiamo conseguito l’impianto di un device di resincronizzazione cardiaca (CRT) tramite stimolazione del sistema di conduzione (PSC) in un paziente sottoposto a trapianto cardiaco affetto da scompenso cardiaco con frazione d’eiezione severamente ridotta e fibrillazione atriale con disturbi del sistema di conduzione (blocco bifascicolare e QRS > 160 ms). Al monitoraggio elettrocardiografico veniva evidenziato un blocco atrioventricolare parossistico completo. La vasculopatia dell’allotrapianto cardiaco (CAV) è stata esclusa mentre non si evidenziava rigetto alla biopsia endomiocardica. Il pacing biventricolare standard non è stato realizzabile a causa dell’assenza di un ramo del seno coronarico consono all’impianto. Abbiamo pertanto effettuato l’impianto a livello del fascio di His, optando inoltre per l’apposizione di un defibillatore (ICD) data la severa disfunzione sinistra. Durante il follow-up si è verificato un miglioramento della funzione cardiaca sinistra e della qualità della vita (QoL) con un’alta percentuale di stimolazione e resincronizzazione.
INTRODUZIONE
Il blocco atrioventricolare (BAV) è una causa comune di impianto permanente di pacemaker (PM) nei pazienti sottoposti a trapianto cardiaco (Htx). Le cause di BAV permanente o completo non sono completamente chiare, ma l’età avanzata e un tempo operatorio maggiore (incluso il tempo totale di ischemia e il tempo di riperfusione) sono stati associati con un maggior rischio di sviluppare BAV [1].
I pazienti che presentano sia BAV che una frazione d’eiezione ridotta possono beneficiare della terapia di resincronizzazione cardiaca e, nei casi in cui la venografia del seno venoso riveli un’anatomia venosa non idonea all’impianto dell’elettrocatetere sinistro, l’uso del PSC andrebbe considerato come alternativa per la stimolazione [2]. A nostra conoscenza, non sono mai stati descritti impianti di CRT usando PSC nei riceventi Htx con disfunzione cardiaca ventricolare sinistra. In questo report presentiamo una stimolazione del sistema hissiano in un paziente sottoposto a trapianto cardiaco 20 anni orsono con patologia del sistema di conduzione, fibrillazione atriale e disfunzione severa del ventricolo sinistro senza segni di vasculopatia significativa delle arterie coronariche epicardiche e anatomia inadeguata per il pacing biventricolare classico.
CASO CLINICO
Un uomo di 65 anni, sottoposto a trapianto cardiaco 20 anni orsono, veniva ricoverato in terapia intensiva cardiologica (UTIC) per un quadro di scompenso cardiaco acuto congestizio durante episodio di fibrillazione atriale (FA), non nota in precedenza, ad alta risposta ventricolare media. L’analisi ecocardiografica mostrava una severa disfunzione ventricolare sinistra (FE 25%) data da ipocinesia diffusa dei segmenti parietali. Il paziente presentava inoltre insufficienza renale acuta (IRA) su patologia cronica renale.
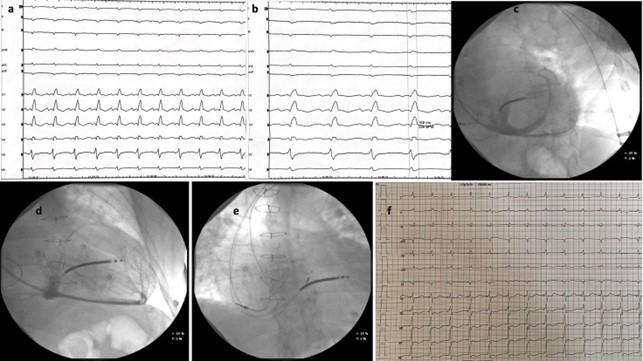
A: ECG basale; B: ECG a 100 mm/s e durata del QRS (168 ms); C: venografia del seno coronarico in RAO 40°; D: fluoroscopia in LAO che mostra una vena posteriore apicale e una piccola vena laterale; E: poisizione a livello del fascio di His dell’elettrocatetere 3830 in visione atero-posteriore; F: ECG finale.
Inizialmente l’aritmia veniva trattata con cardioversione farmacologica a seguito di conferma dell’assenza di trombosi endo-auricolare, dopo la quale l’ECG mostrava blocco di branca destro (BBDx) completo e concomitante emiblocco fascicolare anteriore sinistro (EAsn) con intervallo PR nei limiti (Fig 1A). La durata del QRS misurava 168 ms, come mostrato nella figura 1B. Durante il successivo decorso, nonostante il ripristino del ritmo sinusale, il paziente permaneva in classe funzionale ridotta NYHA III con sintomi per sforzi lievi e disfunzione ventricolare severa. Al monitoraggio telemetrico continuo si evidenziava un BAV completo parossistico. Ai fini dell’esclusione della vasculopatia di allotrapianto cardiaco il paziente veniva sottoposto ad angiografia coronarica che non mostrava sviluppo di tale condizione. Inoltre, la biopsia endomiocardica condotta per investigare le cause di disfunzione ventricolare sinistra nel cuore trapiantato non rivelava uno stato di rigetto cellulare o umorale.
Considerando la bassa frazione d’eiezione con QRS allungato e la necessità di stimolazione in BAV completo, il caso veniva discusso e si poneva indicazione a terapia di resincronizzazione con ICD, seguendo le evidenze delle ultime linee guida europee [2]. In considerazione della pregressa chirurgia cardiaca, previa procedura si eseguiva venografia del sistema venoso sinistro, confermando la pervietà della vena succlavia sinistra. Le guide e i cateteri sono stati avanzati attraverso l’accesso venoso ascellare ottenuto a seguito di tre differenti punture. Due cateteri a fissazione attiva sono stati usati per l’atrio e il ventricolo destro. Il mezzo di contrasto somministrato a livello del seno coronarico non rivelava rami venosi di adeguato calibro ai fini della stimolazione biventricolare classica (Figura 1C e 1D) motivo per il quale si optava per il proseguimento con stimolazione del sistema di conduzione, iniziando con tentativo di pacing del fascio di His (HBP).
L’HBP veniva realizzato usando l’elettrocatetere Select Secure (Model 3830, 69 cm, Medtronic) veicolato tramite un delivery a curva fissa (Modello C315 HIS, Medtronic). La regione hissiana è stata identificata tramite mapping endocardico fino al raggiungimento di un segnale del fascio di His distale. Il tempo HV risultava normale: 45 ms.
Durante il test di stimolazione si osservava cattura del fascio di His con risultante restringimento del QRS e correzione del disturbo di conduzione, dato che permaneva anche a seguito dell’avvitamento dell’elettrocatetere. Dopo il fissaggio, con uno stimolo ad alta soglia l’ECG mostrava cattura non-selettiva del fascio di His (larghezza QRS 110 ms), e cattura miocardica (150 ms) durante stimolo a bassi voltaggi. Durante la procedura è stato eseguito il mappaggio dell’area della branca sinistra ma, nonostante il raggiungimento di QRS stretto (120 ms), le soglie di cattura risultavano essere troppo elevate, probabilmente a causa del substrato tissutale miocardico danneggiato del cuore trapiantato (di cui dettagli verranno discussi nel paragrafo successivo).
In considerazione della durata ottimale del QRS abbiamo preferito impiantare una CRT con stimolazione del fascio di His. Utilizzando la fluoroscopia in LAO 40° abbiamo avanzato il catetere con contemporanea rapida rotazione, ottenendo un QRS finale di 105 ms (Figura 1F). Il posizionamento finale a livello dell’His distale è visualizzabile tramite la fluoroscopia in Figura 1E. Successivamente sono state controllate le soglie, ottenendo una soglia di cattura non-selettiva a 2V x 1ms, con una durata QRS di 105 ms (Figura 1F), mentre con soglia inferiori si otteneva cattura miocardica con QRS più largo. L’ampiezza della soglia è stata quindi programmata a 3V x 1ms con un calcolo della durata della batteria di 4 anni. In ultimo, dopo aver confermato la stabilità del catetere a livello settale è stato retratto il delivery avanzando contemporaneamente il catetere riducendone la tensione ed evitando lo sposizionamento. Durante la seguente degenza non si sono sviluppate complicanze post-procedurali. Dopo monitoraggio dello stato emodinamico utile alla titolazione della terapia medica ottimale, il paziente è stato dimesso con buon compenso e valida decongestione sistemica.
Alla visita di follow-up dopo 6 mesi il paziente ho mostrato un miglioramento della frazione d’eiezione da 25 a 40% con riduzione della classe funzionale NYHA da III a I. La stimolazione biventricolare risultava > del 92%.
DISCUSSIONE
L’aumento dei tassi di sopravvivenza per i riceventi cuori trapiantati nel tempo fa sì che i clinici debbano interfacciarsi con nuove sfide, includendo la gestione di nuove complicanze legate al rigetto cronico, alla CAV, alla disfunzione del graft e alle aritmie. I disturbi del sistema di conduzione sono comuni tra i pazienti sottoposti a Htx [3] e sono legati al danno intrinseco del tessuto miocardico del graft. I fattori che contribuiscono alle alterazioni istologiche del miocardio e del tessuto di conduzione devono essere considerati quando si pone indicazione ad impianto di PM in questa tipologia di pazienti, in quanto possono contribuire alla necessità di alte soglie di cattura, peggiori parametri di sensing e di impedenza. I fattori prima citati, in congiunta con l’infiammazione cronica, porta a fibrosi del tessuto e alla generazione di cicatrici intramiocardiche, assieme ad alterazioni batmotrope legate alla denervazione atriale [4].
Gli attuali trials utili alla valutazione dei benefici della CRT e dei defibrillatori endocavitari non includono i pazienti sottoposti a trapianto cardiaco e le indicazioni sono le stesse dei pazienti non trapiantati. La letteratura sulla CRT si focalizza prevalentemente sul pacing biventricolare classico, con ridotte evidenze riguardo il PSC [5]. Quest’ultimo è un metodo emergente per eseguire una CRT efficace, e le tecniche per ottenerlo sono state descritto solo di recente [6]. Le indicazioni per il PSC sono tutt’ora fonte di dibattito data la presenza di estensiva letteratura sul pacing biventricolare e la carenza di trials clinici randomizzati.
Attualmente le evidenze indicano la CRT come terapia per lo scompenso cardiaco sintomatico con frazione d’eiezione ridotta e il QRS > 130 ms. La tecnica tradizionale prevede l’impianto degli elettrocateteri a livello intracavitario destro e nel sistema venoso sinistro passando dal seno coronarico [7]. Le nuove tecniche permettono la stimolazione del sistema di conduzione a livello del fascio di His o della branca sinistra, provvedendo ad una stimolazione fisiologica della massa ventricolare. Le attuali indicazioni suggeriscono l’uso del PSC sono in casi di insuccesso del pacing biventricolare. Grandi registri hanno dimostrato per il PSC una curva di apprendimento rapida ed un sistema sicuro, oltre che facilmente attuabile, fattori che possono portare a nuove indicazioni per il suo utilizzo. In ogni caso, l’applicazione della CRT nei pazienti Htx non vede la presenza di dati consistenti, soprattutto nella presenza di BBDx, il quale risulta essere un elemento frequente nella disfunzione del graft [8]. Alcuni report suggeriscono che i pazienti soggetti a sviluppo di scompenso cardiaco a seguito di Htx che necessitano inoltre sulla base del quadro patologico di un alto tasso di stimolazione cardiaca traggono beneficio dall’impianto di CRT [7,9].
Nel nostro manoscritto abbiamo riporatato un caso di CRT utilizzando il PSC in un paziente con severa disfunzione ventricolare sinistra, fibrillazione atriale, BBdx, EAsn e BAV completo parossistico. Il BAV nei pazienti trapiantati ha la tendenza a svilupparsi in un momento tardivo in quanto disfunzione del sistema di conduzione long-term, mentre la malattia del nodo del seno si manifesta tipicamente nel primo periodo post-operatorio. Il BAV è solitamente parossistico e spesso sotto-diagnosticato a causa della clinica non specifica di manifestazione. Inoltre, il paziente che riceve un impianto di PM per BAV in Htx può necessitare di un’alta percentuale di stimolazione ventricolare [10], rendendo il PSC potenzialmente efficace nel prevenire la disfunzione ventricolare PM indotta. In ultimo, i dati limitati riguardo l’impianto di CRT nei pazienti post-Htx possono essere correlati all’imputazione della causa di disfunzione a cause potenzialmente correggibili come il rigetto cardiaco, evidenziando la necessità di ulteriori studi sul tema.
CONCLUSIONI
In questo caso clinico viene rappresentata la fattibilità nell’esecuzione di pacing del sistema di conduzione in un paziente sottoposto a trapianto cardiaco da numerosi anni, senza cause specifiche di disfunzione del graft quali il rigetto acuto o la patologia coronarica da vasculopatia dell’allotrapianto, ma con disfunzione ventricolare sinistra severa e BAV. L’indicazione alla CRT nei riceventi Htx non è standardizzata ma la procedura è attuabile nonostante le modifiche anatomiche legate all’intervento e le alterazioni del sistema di conduzione correlate alla fibrosi, data dai vari fattori a cui questo tipo di pazienti sono sottoposti dal momento dell’impianto del graft. Gli esiti post-impianto sono risultati sovrapponibili a quelli dei pazienti a cui è stato eseguito un impianto di CRT-PSC non sottoposti ad Htx. I dati raccolti su questo tipo di strategia di pacing e le indicazioni specifiche in relazione agli outcome sono attualmente molto carenti e pressochè assenti in questo subset di pazienti. In considerazione dello stretto follow-up a cui i pazienti Htx vengono sottoposti e dei molteplici fattori coinvolti al danno del miocardio, nuovi studi sono consigliabili e necessari per approfondire e sviluppare le indicazioni in questo campo dove le possibili cause di disfunzione del sistema di conduzione possono rendere difficile l’adeguata selezione delle terapie.
BIBLIOGRAFIA
1. Wellmann P, Herrmann FE, Hagl C, Juchem G. A Single Center Study of 1,179 Heart Transplant Patients-Factors Affecting Pacemaker Implantation. Pacing Clin Electrophysiol. 2017;40(3):247-54. doi:10.1111/pace.13021
2. Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy [published correction appears in Europace. 2022 Mar 07;:]. Europace. 2022;24(1):71-164. doi:10.1093/europace/euab232
3. DeFilippis, Ersilia M et al. “Cardiac Implantable Electronic Devices Following Heart Transplantation.” JACC. Clinical electrophysiology vol. 6,8 (2020): 1028-42. doi:10.1016/j.jacep.2020.06.023
4. Bharati S, Billingham M, Lev M. The conduction system in transplanted hearts. Chest. 1992;102(4):1182-88. doi:10.1378/chest.102.4.1182
5. Boczar K, Ząbek A, Ulman M, Lelakowski J, Małecka B. His bundle pacing in a patient after heart transplant and complete atrioventricular block. Kardiol Pol. 2021;79(1):81-82. doi:10.33963/KP.15681
6. Burri H, Jastrzebski M, Cano Ó, et al. EHRA clinical consensus statement on conduction system pacing implantation: executive summary. Endorsed by the Asia-Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS) and Latin-American Heart Rhythm Society (LAHRS). Europace. 2023;25(4):1237-48. doi:10.1093/europace/euad044
7. McDowell DL, Hauptman PJ. Implantable defibrillators and cardiac resynchronization therapy in heart transplant recipients: results of a national survey. J Heart Lung Transplant. 2009;28(8):847-50. doi:10.1016/j.healun.2009.04.016
8. Marcus GM, Hoang KL, Hunt SA, Chun SH, Lee BK. Prevalence, patterns of development, and prognosis of right bundle branch block in heart transplant recipients. Am J Cardiol. 2006;98(9):1288-90. doi:10.1016/j.amjcard.2006.06.018
9. Tu SJ, Wong CX, Stokes MB, Pitman BM, Sanders P, Lau DH. Cardiac resynchronization therapy in an orthotopic heart transplant recipient. J Cardiol Cases. 2022;27(2):80-83. Published 2022 Nov 10. doi:10.1016/j.jccase.2022.10.011
10. Raghavan C, Maloney JD, Nitta J, et al. Long-term follow-up of heart transplant recipients requiring permanent pacemakers. J Heart Lung Transplant. 1995;14(6 Pt 1):1081-89.




Related Posts