Fattori precipitanti nei pazienti con dissezione coronarica spontanea: implicazioni cliniche, laboratoristiche e prognostiche
Autori: Filippo Luca Gurgoglione1, Davide Rizzello1, Rossella Giacalone2, Marco Ferretti3, Antonella Vezzani4, Bettina Pfleiderer5, Giovanna Pelà6, Chiara De Panfilis6, Maria Alberta Cattabiani2, Giorgio Benatti2, Iacopo Tadonio2, Francesca Grassi2, Giulia Magnani2, Manjola Noni2, Martina Cancellara6, Francesco Nicolini7, Diego Ardissino1, Luigi Vignali2, Giampaolo Niccoli8 ed Emilia Solinas2
Affiliazioni:
- Division of Cardiology, University of Parma, Parma University Hospital, Parma, Italy.
- Division of Cardiology, Parma University Hospital, Parma, Italy.
- Division of Cardiology, IRCCS Arcispedale Santa Maria Nuova, Reggio Emilia, Italy.
- Cardiac Surgery Intensive Care Unit, Parma University Hospital, Parma, Italy.
- Clinic of Radiology, Medical faculty, University of Muenster, Germany.
- Department of Medicine and Surgery, University of Parma, Italy.
- Division of Cardio surgery, University of Parma, Parma University Hospital, Parma, Italy.
- Division of Cardiology, University of Parma, Parma University Hospital, Parma, Italy.
Introduzione
La dissezione coronarica spontanea (SCAD) è una condizione clinica unica caratterizzata dalla separazione della parete dell’arteria coronaria da parte di un ematoma intramurale che comprime il lume del vaso [1, 2] ed è associata ad un ampio spettro di manifestazioni cliniche come sindrome coronarica acuta (ACS), aritmie ventricolari e morte cardiaca improvvisa [3-5]. La fisiopatologia della SCAD è multifattoriale e può comportare la complessa interazione tra fattori predisponenti (genetici, ormonali, infiammatori, vascolari e psicosociali) e fattori scatenanti di stress, come trigger emotivi e fisici. Numerosi studi hanno indagato l’influenza di fattori predisponenti per l’insorgenza di SCAD, la storia naturale e la prognosi [6-11]. Tuttavia, l’associazione tra fattori di stress emotivi e fisici da un lato e i correlati clinici dall’altro non è risultata chiara.
Nel nostro studio abbiamo cercato di confrontare dati clinici, angiografici e caratteristiche prognostiche in una coorte di pazienti con SCAD secondo la presenza e la tipologia di fattori di stress scatenanti.
Metodi
Disegno dello studio e popolazione
Abbiamo condotto uno studio osservazionale misto (retrospettivo e prospettico) a centro singolo includendo 75 pazienti consecutivi sottoposti ad angiografia coronarica per sospetta ACS e con evidenza angiografica di SCAD presso l’Azienda Ospedaliera Universitaria di Parma tra gennaio 2013 e ottobre 2022. Di questa popolazione, abbiamo escluso 11 pazienti senza informazioni sul tipo di fattori di stress scatenanti. 64 soggetti sono stati quindi inclusi nell’analisi (Figura 1). Il protocollo dello studio, rispettoso della Dichiarazione di Helsinki, è stato approvato dal Comitato Etico dell’Ospedale e tutti i pazienti hanno firmato il consenso informato.
L’angiografia coronarica è stata eseguita attraverso approccio radiale o femorale con proiezioni multiple per valutare interamente tutti i segmenti delle arterie coronarie. E’ stata definita angiograficamente come SCAD la dissezione mediale o l’ematoma intramurale senza aterosclerosi e si è utilizzata una classificazione secondo la versione modificata della classificazione Yip e Saw (con l’aggiunta della SCAD di tipo 4) [12, 13]:
-tipo 1, contrasto patognomonico con colorazione di più lumi radiotrasparenti nella parete arteriosa;
-tipo 2, stenosi diffusa (tipicamente >20 mm) solitamente liscia, che spesso si presenta con brusco restringimento;
-tipo 3, stenosi focale o tubulare che mima l’aterosclerosi;
-tipo 4: brusca occlusione totale.
Tutti gli angiogrammi sono stati valutati da due esperti cardiologi interventisti (E.S. e L.V.) per confermare la diagnosi.
Sono stati raccolti per ciascun paziente fattori di rischio cardiovascolare (CV) tradizionali e non tradizionali (RF), distinguendo tra sesso e genere specifici [14].
Sono stati considerati CV RF non tradizionali :
Relativi al sesso: includendo condizioni sesso-specifico (anamnesi ostetrica e ginecologica, incluso periodo postpartum) e sesso-predominante (malattie autoimmuni, connettivopatie, disturbi endocrini, emicrania: queste condizioni sono più frequentemente riscontrabili nel sesso femminile rispetto a quello maschile).
Relativi al genere: includendo ansia, depressione e condizioni di stress con sottostanti fattori psicosociali che colpiscono le donne più spesso rispetto agli uomini (storia di abuso, violenza da parte del partner, basso status socioeconomico o precarietà del lavoro, lutto).
Per ogni paziente è stata inoltre studiata la presenza di fattori di stress precipitanti al momento del ricovero ospedaliero secondo come segue:
- Disagio emotivo nelle 24 ore prima dell’evento ACS: definito come forte turbamento per qualcosa, sentirsi teso o nervoso, preoccupato e/o estremo insolito disagio emotivo.
- Sforzo fisico nelle 24 ore precedenti l’evento ACS: definito come estremo o insolito sforzo fisico [15].
Lo stress cronico è stato definito come risposta psicofisica anche a diversi stimoli emotivi, compiti cognitivi o sociali prolungati nel tempo che una persona percepisce come eccessivi e che costituiscono un ostacolo al raggiungimento degli obiettivi personali, compromettendo la qualità della vita [14].
Sono stati infine raccolti dati laboratoristici ed ecocardiografici.
Follow-up clinico ed endpoint
Tutti i pazienti sono stati sottoposti a follow-up clinico mediante visite programmate ambulatoriali e/o telefoniche con colloqui a 30 giorni e 6 mesi dall’evento indice e successivamente a cadenza annuale.
La raccolta di eventi è stata effettuata su tutti i pazienti.
L’outcome primario era il verificarsi di eventi cardiovascolari avversi maggiori (MACE), definiti come il composito di morte CV, infarto del miocardio non fatale e rivascolarizzazione coronarica non pianificata. E’ stata definita morte CV la morte improvvisa o la morte preceduta dal tipico dolore toracico. E’ stato definito come infarto del miocardio non fatale il tipico dolore toracico a riposo associato ad alterazioni all’ECG del segmento ST e/o dell’onda T con rilevamento di un aumento dei livelli sierici di troponina I. La rivascolarizzazione coronarica non pianificata includeva qualsiasi rivascolarizzazione coronarica non programmata al momento dell’evento indice.
Sono stati registrati anche i seguenti endpoint secondari:
la prevalenza di SCAD ricorrenti;
la frequenza di dolore toracico ricorrente: definita come dolore toracico che si verifica ≥3 volte a settimana (all’ultimo follow-up disponibile) [16];
il verificarsi di eventi avversi emorragici (definiti come sanguinamento maggiore [≥3] secondo la classificazione del Bleeding Academic Research Consortium) [17].
Analisi statistica
Le variabili continue sono state espresse come media (±deviazione standard), le variabili categoriali come frequenze e percentuali. In caso di distribuzione distorta, i dati sono stati raccolti come mediane (con intervalli interquartili). Sono state presentate statistiche riassuntive che valutano le differenze tra i tre gruppi di studio (pazienti con stress emotivi, con fattori di stress fisici e senza alcun fattore scatenante). Tutti i test statistici sono stati eseguiti con alfa bilaterale = 0,05 ed è stato impiegato un intervallo di confidenza del 95%. Le variabili continue sono state confrontate tra i tre gruppi di studio da One-Way Test ANOVA o Kruskal-Willis, a seconda della presenza o meno di distribuzione normale, mentre le variabili categoriche sono state valutate tra i tre gruppi di studio mediante il test Chi-quadrato. E’ stata inoltre applicata l’analisi di regressione di Cox univariata e multivariata per valutare la relazione delle singole variabili con MACE e SCAD ricorrenti, inclusa la presenza di fattori di stress emotivi insieme a caratteristiche meccanicamente ed epidemiologicamente collegate MACE e SCAD ricorrente. Per l’incidenza dell’endpoint primario è stata infine eseguita l’analisi del tempo all’evento mediante lo stimatore di Kaplan-Meier. Tutte le analisi statistiche sono state eseguite con il software SPSS 22.0 (IBM Corp., Armonk, New York, Stati Uniti).
Risultati
Abbiamo arruolato un totale di 64 pazienti con età mediana 54,0 [47,0; 65,0] anni, prevalentemente donne (56 [87,5%]), con bassa frequenza di RFCV tradizionali e un burden elevato di RFCV non tradizionali. Nella popolazione complessiva, 41 [64,0%] pazienti hanno presentato fattori di stress precipitanti, distinti in trigger emotivi (31 [48,4%] soggetti) e sforzi fisici (10 [15,6%] soggetti). Abbiamo scoperto che i pazienti con trigger emotivi erano più frequentemente donne (30 [96,8%] vs 6 [60,0%] nel gruppo con fattori di stress fisico vs 20 [86,9%] nel gruppo senza alcun fattore di stress, p = 0,009]) ed erano più propensi a soffrire di stress cronico (21 [66,7%] vs 3 [30,0%] nel gruppo con fattori di stress fisico vs 8 [34,8%] nel gruppo senza alcun fattore di stress, p = 0,022], mentre quelli con fattori di stress fisici avevano una maggior prevalenza di ipertensione (7 [70,0%] vs 8 [25,8%] nel gruppo con trigger emotivi vs 10 [43,6%] nel gruppo senza fattori di stress, p = 0,039]) e dislipidemia (6 [60,0%] vs 5 [16,1%] nel gruppo con trigger emotivi vs 6 [26,1%]) nel gruppo senza fattore di stress, p = 0,024] (Figura 2). Inoltre, al momento del ricovero in ospedale, il gruppo con i fattori di stress emotivo avevano livelli più elevati di proteina C-reattiva (PCR) (15,0 mg/dL [IQR 5,6; 64,8] rispetto a 3,0 mg/dL [IQR 1,0; 23,9] nel gruppo con fattori di stress fisico, vs 4,0 mg/dL [IQR 2.0; 15.8] nel gruppo senza alcun fattore di stress, p = 0.037) insieme a un conteggio più elevato di eosinofili circolanti (0.10 × 10^3/μL [IQR 0,06; 0,15] rispetto a 0,04 × 10^3 /μL [IQR 0,02; 0,08] nel gruppo con fattori di stress fisico vs 0,05 × 10^3 /μL [IQR 0,02; 0.10] nel gruppo senza alcun fattore di stress, p = 0,012).
Nella popolazione complessiva, l’ACS senza elevazione del tratto ST (44 [68,7%] soggetti) è stata la presentazione clinica più frequente. All’angiografia coronarica, l’arteria discendente anteriore (32 [50,0%]) è risultata essere il vaso più colpito e il tipo 2 (36 [56,2%]) è risultato il più frequente modello SCAD incontrato. La stragrande maggioranza dei pazienti è stata gestita in modo conservativo e solo 4 soggetti [6,2%] sono stati sottoposti a intervento coronarico percutaneo. Nessuna differenza è stata riportata tra i gruppi di studio nella presentazione clinica, caratteristiche angiografiche e gestione clinica. Tutti i dettagli clinici e angiografici sono riassunti nella Tabella 1.
Ad un follow-up mediano di 21 [7; 44] mesi, si è verificato un MACE in 11 [17,2%] pazienti, inclusi 1 [1,6%] morte CV e 10 [15,6%] infarti miocardici non fatali, mentre non sono state riportate rivascolarizzazioni coronariche non pianificate nella nostra coorte di pazienti. L’incidenza complessiva di MACE è stata di 9,83 per 100 persone/anno, mentre l’incidenza di recidive SCAD era 5,03 per 100 persone/anno. Una descrizione dettagliata dei risultati clinici nella popolazione complessiva e nei tre gruppi di studio è riassunta nella Tabella 2. Considerando i tre gruppi di studio, il verificarsi dell’endpoint primario era simile (7 [22,6%] nei pazienti con stress emotivi vs. 1 [10,0%] nel gruppo con stress fisico fattori di stress vs. 3 [13,0%] nel gruppo senza alcun fattore di stress, p = 0,525]) così come l’incidenza di SCAD ricorrente (4 [12,9%] in pazienti con stress emotivi vs. 0 [0,0%] nel gruppo con fattori di stress fisici vs. 1 [4,3%] nel gruppo senza alcun fattore di stress, p = 0,309). Quattro eventi avversi emorragici si sono verificati nella nostra coorte di pazienti, senza differenze tra i tre gruppi di studio (2 [6,4%] vs 1 [10,0%] vs 1 [4,3%] nei gruppi con trigger emotivi, fattori di stress fisici e senza alcun trigger rispettivamente, p = 0,825]. Segnaliamo come i pazienti con fattori di stress emotivo, rispetto agli altri due gruppi di studio, abbiano sperimentato una prevalenza significativamente più alta di dolore toracico ricorrente (10 [32,2%] vs. 1[10,0%] nel gruppo con fattori di stress fisico vs. 1 [4,3%] nel gruppo senza alcun fattore di stress, p = 0,025] e una tendenza verso una maggiore incidenza di MACE (HR 2,996, CI 95% [0,874; 10.271], p=0.081) insieme a recidiva SCAD (HR 6.739, CI 95% [0.753; 60.352], p = 0,088) all’analisi di regressione univariata di Cox (tabelle supplementari 1-2). Infine, il confronto delle curve di Kaplan-Meier con il log-rank test ha mostrato che i tre gruppi di studio hanno avuto una sopravvivenza libera da endpoint primario simile [p= 0,582].
Discussione
Nel nostro studio abbiamo dimostrato come trigger precipitanti si incontrano frequentemente nei pazienti con SCAD con impatto sui correlati clinici e laboratoristici e sulla comparsa di dolore toracico ricorrente, mentre quasi un terzo dei pazienti non ha alcun fattore di stress.
Pochi studi si sono occupati del ruolo dei fattori scatenanti nell’insorgenza della SCAD. Saw et al. hanno osservato che il 57% dei pazienti presentava fattori di stress precipitanti e trigger emotivi erano circa il doppio più frequenti rispetto a quelli fisici [12]. Daoulah et al. hanno riportato trigger emotivi nel 40% della coorte GULF SCAD [15]. E’ ben nota una differenza legata al sesso, poiché i fattori di stress emotivi causano più frequentemente SCAD nelle donne, mentre gli sforzi fisici sono prevalenti nella popolazione maschile [12, 18].
Il nostro studio ha confermato e ulteriormente esteso questi risultati: circa due terzi dei pazienti hanno avuto fattori di stress precipitanti riconoscibili, con una maggiore prevalenza di emozioni trigger [48,4%], rispetto a sforzi fisici vigorosi [15,6%]. E’ da notare inoltre come i nostri risultati abbiano evidenziato differenze cliniche e biochimiche statisticamente significative tra i gruppi di studio. In dettaglio, i pazienti con trigger fisici erano prevalentemente maschi e mostravano un peggior profilo di fattori di rischio CV, con tassi più elevati di ipertensione e dislipidemia, mentre quelli con trigger emotivi erano prevalentemente donne e avevano una frequenza più alta di stress cronico e infiammazione sistemica, come rivelato da livelli più alti di CRP e di conta degli eosinofili circolanti al momento del ricovero, sottolineando il ruolo dello stress cronico nell’ induzione di risposte infiammatorie ed endocrine integrate.
Le suddette differenze possono costituire il substrato per distinti meccanismi fisiopatologici alla base della SCAD. Tra i pazienti con stress emotivi, l’interazione sinergica tra stress cronico e intensa stimolazione simpatica potrebbe svolgere un ruolo centrale ruolo nell’insorgenza di SCAD guidando l’iperattivazione di pathway infiammatori e immunologici [19, 20]. Inoltre lo squilibrio simpatico-vagale a favore del sistema simpatico e la conseguente riduzione della rete vagale gioca un ruolo chiave, inducendo uno stato proinfiammatorio e l’iperattivazione dell’asse ipotalamo-ipofisi-surrene, già sovrastimolato durante il sovraccarico di stress allostatico. Irwin et al. hanno dimostrato che lo stress cronico innesca un rilascio disadattivo prolungato di citochine proinfiammatorie [21], mentre Tarnawski et al. hanno scoperto che fattori di stress acuti fanno presagire uno squilibrio nell’omeostasi del sistema autonomo a favore del sistema simpatico, favorendo rilascio di catecolamine e citochine proinfiammatorie.
Kang et al. hanno fornito prove di una nuova piattaforma a tre organi che collega l’amigdala all’ infiammazione coronarica in-vivo tramite un’aumentata mielopoiesi nel midollo osseo, sostenendo l’intima relazione tra stress emotivo, infiammazione e connessione cuore-cervello come fulcro del cosiddetto modello psico-neuro-endocrino-immunologico [23].
Complessivamente questi risultati potrebbero spiegare l’aumento dei livelli di biomarcatori infiammatori osservato nel gruppo con fattori di stress emotivi rispetto agli altri due gruppi. Un precedente studio fondamentale di Kronzer et al. [10] non è riuscito a mostrare un’associazione tra SCAD e malattie infiammatorie, a supporto di una fisiopatologia non infiammatoria di SCAD [10]. Veniva tuttavia inclusa una popolazione con SCAD eterogenea . Da segnalare che nel nostro studio abbiamo dimostrato un eccesso di biomarcatori infiammatori solo nei pazienti con SCAD e fattori di stress emotivi, suggerendo una fisiopatologia distinta alla base della SCAD in base alla presenza e al tipo di trigger precipitanti. Studi precedenti hanno inoltre rivelato che gli eosinofili sono implicati nel verificarsi di SCAD promuovendo angiogenesi con proliferazione di fragili vasa vasorum [24] e aumentando la suscettibilità dell’albero coronarico a disordini vasomotori [25]. Date queste considerazioni, possiamo ipotizzare che nei pazienti con trigger emotivi, i tassi più elevati di stress cronico e i livelli più elevati di CRP e di eosinofili circolanti potrebbero contribuire all’insorgenza di dissezione coronarica. È importante sottolineare che in una metanalisi molto recente di Ridker et al. [26], alti livelli di CRP hanno predetto futuri eventi avversi CV; pertanto, anche questa informazione potrebbe assumere implicazioni prognostiche. Va inoltre notato che i circuiti neuroumorali coinvolti nelle interazioni bidirezionali cuore-cervello insieme alle risposte infiammatorie e immunologiche allo stesso fattore di stress sono più evidenti nelle donne rispetto agli uomini [20, 27]. Nel nostro studio il legame tra SCAD, prevalenza del sesso femminile, fattori di rischio di genere non tradizionali e stress emotivo come trigger predominante è stato estesamente dimostrato.
Al contrario, i trigger fisici alla base di SCAD possono essere classificati in due categorie:
-intensi sforzi isometrici, come sollevare e tirare pesi pesanti
– sforzi simili a Valsalva, come conati di vomito/vomito, tosse vigorosa e movimenti intestinali forzati [28].
La fisiopatologia sottostante, sebbene non completamente nota, è su base meccanica e ormonale: più specificamente, sforzi isometrici anomali, solitamente accompagnati da un aumento della pressione intra toracoaddominale, sono in grado di provocare un intenso shear stress coronarico, ulteriormente aggravato dall’iperattivazione indotta dall’esercizio del sistema nervoso simpatico e dall’aumentato rilascio di catecolamine. Complessivamente queste caratteristiche possono comportare danno coronarico, favorendo l’insorgenza di lacerazioni intimali ed emorragie intravascolari, in particolare in pazienti con arteriopatie predisponenti [29]”.
Infine, al follow-up a medio termine, i pazienti con fattori di stress emotivi hanno sperimentato una maggior prevalenza di dolore toracico ricorrente [32,2%], rispetto agli altri gruppi di studio. L’entità del problema, che variava dal 7,6% [15] al 23% [16] nei rapporti precedenti, e le conseguenze cliniche associate (scarsa qualità della vita, aumento dello stress psicologico e comportamenti disfunzionali, nonché le importanti conseguenze economiche di ripetuti visite al Pronto Soccorso) [30] comporta la necessità di meccanismi di indirizzamento in base al sottostante dolore toracico ricorrente. Uno studio fondamentale di Sedlak et al. ha dimostrato il ruolo centrale della disfunzione microvascolare coronarica nella fisiopatologia del dolore toracico cronico nella popolazione con SCAD, poiché> 70% dei pazienti presentava una riserva di flusso coronarico anormale e un indice di riserva microvascolare. L’interazione tra infiammazione di basso grado e lo stress cronico è implicato nell’insorgenza della disfunzione microvascolare coronarica [31, 32] ed è in grado di propagare segnali di dolore anche dopo la cessazione dello stimolo nocivo [33].
Complessivamente questi risultati potrebbero in parte spiegare l’eccesso di dolore toracico ricorrente osservato in presenza di fattori di stress emotivi prima della SCAD: questa caratteristica apre nuove strade nel trattamento del dolore toracico ricorrente; tuttavia, l’associazione tra fattori di stress emotivi e il dolore toracico ricorrente potrebbero essere pregiudicati da una netta prevalenza del sesso femminile, dello stress cronico e dell’infiammazione nella nostra popolazione.
Infine, l’incidenza di eventi avversi non era trascurabile nella nostra coorte di pazienti con SCAD, con un’incidenza complessiva di MACE di 9,83 per 100 persone/anno, maggiore rispetto alla metanalisi cardine di Franke et al [34], mentre l’incidenza di SCAD ricorrente era di 5,03 per 100 persone/anno, leggermente inferiore rispetto all’analisi di Franke et al. [34].
Presi insieme, i nostri risultati indicano che la valutazione dei fattori di stress scatenanti è in grado di identificare diversi fenotipi di SCAD, con distinti correlati clinici, laboratoristici e storia naturale, che potrebbe richiedere un approccio terapeutico personalizzato: ai pazienti con fattori di stress fisico dovrebbero essere sconsigliati un’attività isometrica intensa e sforzi tipo Valsalva e dovrebbero essere invece incoraggiati a praticare attività aerobiche di intensità lieve-moderata anche per trattare gli stati dislipidemici e ipertensivi. La gestione dello stress cronico è invece mandatoria in presenza di trigger emotivi. Pensiamo che tutti i pazienti con SCAD dovrebbero essere valutati per l’eventuale presenza di stress cronico e ad essi dovrebbero essere offerti assistenza psicologica e/o programmi convalidati di gestione dello stress.
Limiti dello studio
Il nostro studio ha diversi limiti. Si tratta innanzitutto di uno studio monocentrico con una relativamente ridotta dimensione campionaria e limitato potere statistico. In secondo luogo, il disegno dello studio non randomizzato, insieme con la natura mista retrospettiva (18, 28,1% dei pazienti) e prospettica (46, 71,9% dei pazienti), potrebbe aver promosso un potenziale bias di selezione nella fase prospettica: in particolare, le crescenti prove scientifiche che collegano SCAD e fattori di stress emotivi possono avere portato i cardiologi a diagnosticare con maggiore probabilità la SCAD nei pazienti con stress cronico o emotivo o per promuovere un’indagine approfondita sui fattori di stress emotivi in presenza di evidenza angiografica di SCAD. In terzo luogo, l’esclusione dei pazienti (11 [14,7%] del totale coorte di pazienti con SCAD) con mancanza di dati sui fattori scatenanti potrebbe essere considerato un ulteriore bias di selezione. In quarto luogo, strumenti di imaging intracoronarico per confermare la diagnosi di SCAD sono stati sottoutilizzati nella nostra coorte. In quinto luogo, la ricerca di fattori di stress precipitanti è stata di tipo qualitativo, quindi la loro reale prevalenza e distribuzione potrebbero essere imperfette. La prevalenza del dolore toracico ricorrente è stata valutata all’ultimo follow-up disponibile per ciascun paziente (con una durata simile del follow-up tra i tre gruppi di studio [p = 0,375]) senza l’adozione di questionari validati. Non è stato inoltre effettuata una valutazione biochimica al follow-up.
Conclusioni
Il nostro studio mostra che i fattori di stress emotivi causa di SCAD permettono di identificare un sottotipo di SCAD con caratteristiche specifiche e con più frequente documentazione di dolore toracico. Questi risultati potrebbero sottendere differenti fisiopatologie di base e potrebbero aprire la strada verso una gestione su misura dei pazienti con SCAD. Una migliore caratterizzazione della SCAD dovrebbe essere oggetto di indagini future: in particolare, la ricerca dovrebbe concentrarsi sul possibile ruolo dell’infiammazione e delle cause del dolore toracico ricorrente in questi pazienti.
Bibliografia
1. Hayes SN, Kim ESH, Saw J, et al; American Heart Association Council on Peripheral Vascular Disease; Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Genomic and Precision Medicine; and Stroke Council. Spontaneous Coronary Artery Dissection: Current State of the Science: A Scientific Statement From the American Heart Association. Circulation. 2018 May 8;137(19):e523-e557.
2. Kim ESH. Spontaneous Coronary-Artery Dissection. N Engl J Med. 2020 Dec 10;383(24):2358-2370.
3. Mortensen KH, Thuesen L, Kristensen IB, Christiansen EH. Spontaneous coronary artery dissection: a Western Denmark Heart Registry study. Catheter Cardiovasc Interv. 2009;74(5):710-7.
4. Bergen E, Huffer L, Peele M. Survival after spontaneous coronary artery dissection presenting with ventricular fibrillation arrest. J Invasive Cardiol. 2005;17(10):E4-6.
5. Basso C, Morgagni GL, Thiene G. Spontaneous coronary artery dissection: a neglected cause of acute myocardial ischaemia and sudden death. Heart. 1996;75(5):451-4.
6. Camacho Freire SJ, Díaz Fernández JF, Gheorghe LL, et al. Spontaneous Coronary Artery Dissection and Hypothyroidism. Rev Esp Cardiol (Engl Ed). 2019 Aug;72(8):625-633.
7. Inohara T, Alfadhel M, Choi D, Starovoytov A, Saw J. Coronary Angiographic Manifestations and Outcomes in Spontaneous Coronary Artery Dissection Patients With and Without Fibromuscular Dysplasia. Can J Cardiol. 2021 Nov;37(11):1725- 1732.
8. Smaardijk VR, Mommersteeg PMC, Kop WJ, Pellegrini D, van Geuns RJ, Maas AHEM. Psychological and clinical characteristics of patients with spontaneous coronary artery dissection: A case-control study. Int J Cardiol. 2021 Jan 15;323:1-6.
9. Wang Y, Starovoytov A, Murad AM, et al. Burden of Rare Genetic Variants in Spontaneous Coronary Artery Dissection With High-risk Features. JAMA Cardiol. 2022 Oct 1;7(10):1045-1055.
10.Kronzer VL, Tarabochia AD, Lobo Romero AS, et al. Lack of Association of Spontaneous Coronary Artery Dissection With Autoimmune Disease. J Am Coll Cardiol. 2020 Nov 10;76(19):2226-2234.
11. Saw J, Aymong E, Sedlak T, et al. Spontaneous coronary artery dissection: association with predisposing arteriopathies and precipitating stressors and cardiovascular outcomes. Circ Cardiovasc Interv. 2014 Oct;7(5):645-55.
12.Saw J. Coronary angiogram classification of spontaneous coronary artery dissection. Catheter Cardiovasc Interv. 2014 Dec 1;84(7):1115-22.
13.Al-Hussaini A, Adlam D. Spontaneous coronary artery dissection. Heart. 2017 Jul;103(13):1043-1051.
14.Giacalone R., Ferretti M., Gurgoglione FL, et al. (2022). Assessment of the Role of NonTraditional Risk Factors on Spontaneous Coronary Artery Dissections. J. Clinical Cardiology and Cardiovascular Interventions, 5(8).
15.Daoulah A, Al-Faifi SM, Hersi AS, et al; G-SCAD Investigators. Spontaneous Coronary Artery Dissection in Relation to Physical and Emotional Stress: A Retrospective Study in 4 Arab Gulf Countries. Curr Probl Cardiol. 2021 Mar;46(3):100484.
16.Sedlak T, Starovoytov A, Humphries K, Saw J. Coronary Flow Reserve in Patients With Prior Spontaneous Coronary Artery Dissection and Recurrent Angina. J Am Heart Assoc. 2020 Aug 18;9(16):e015834.
17.Mehran R, Rao SV, Bhatt DL, et al. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011 Jun 14;123(23):2736-47.
18.McAlister C, Alfadhel M, Samuel R, et al. Differences in Demographics and Outcomes Between Men and Women With Spontaneous Coronary Artery Dissection. JACC Cardiovasc Interv. 2022 Oct 24;15(20):2052-2061.
19.Bottaccioli AG, Bologna M, Bottaccioli F. Psychic Life-Biological Molecule Bidirectional Relationship: Pathways, Mechanisms, and Consequences for Medical and Psychological Sciences-A Narrative Review. Int J Mol Sci. 2022 Apr 1;23(7):3932.
20.Rossi A, Mikail N, Bengs S, et al. Heart-brain interactions in cardiac and brain diseases: why sex matters. Eur Heart J. 2022 Oct 14;43(39):3971-3980.
21.Irwin MR, Cole SW. Reciprocal regulation of the neural and innate immune systems. Nat Rev Immunol. 2011 Aug 5;11(9):625-32.
22.Tarnawski L, Olofsson PS. Inflammation neuroscience: neuro-immune crosstalk and interfaces. Clin Transl Immunology. 2021 Oct 31;10(11):e1352.
23.Kang DO, Eo JS, Park EJ, et al. Stress-associated neurobiological activity is linked with acute plaque instability via enhanced macrophage activity: a prospective serial 18F-FDG-PET/CT imaging assessment. Eur Heart J. 2021 May 14;42(19):1883- 1895.
24.Nissim Ben Efraim AH, Levi-Schaffer F. Roles of eosinophils in the modulation of angiogenesis. Chem Immunol Allergy. 2014;99:138-54. doi: 10.1159/000353251. Epub 2013 Oct 17. PMID: 24217607.
25.Kajihara H, Tachiyama Y, Hirose T, et al. Eosinophilic coronary periarteritis (vasospastic angina and sudden death), a new type of coronary arteritis: report of seven autopsy cases and a review of the literature. Virchows Arch. 2013 Feb;462(2):239-48.
26. Ridker PM, Bhatt DL, Pradhan AD, Glynn RJ, MacFadyen JG, Nissen SE; PROMINENT, REDUCE-IT, and STRENGTH Investigators. Inflammation and cholesterol as predictors of cardiovascular events among patients receiving statin therapy: a collaborative analysis of three randomised trials. Lancet. 2023 Mar 3:S0140-6736(23)00215-5.
27.Fioranelli M, Bottaccioli AG, Bottaccioli F, Bianchi M, Rovesti M, Roccia MG. Stress and Inflammation in Coronary Artery Disease: A Review Psychoneuroendocrineimmunology-Based. Front Immunol. 2018 Sep 6;9:2031.
28. Souza P, Herdy AH. Spontaneous Exercise-Related Coronary Artery Dissection among Young Patients Without Risk Factors or Atherosclerotic Disease. Arq Bras Cardiol. 2019 Nov;113(5):988-998.
29.Fahmy P, Prakash R, Starovoytov A, Boone R, Saw J. Pre-Disposing and Precipitating Factors in Men With Spontaneous Coronary Artery Dissection. JACC Cardiovasc Interv. 2016 Apr 25;9(8):866-868. Bhatt DD, Kachru R, Gupta S, Kaul U. Recurrent chest pain after treatment of spontaneous coronary artery dissection: An enigma. Indian Heart J. 2015 Dec;67 Suppl 3(Suppl 3):S18-20.
30.Duncker D.J., Bache R.J. Regulation of coronary blood flow during exercise. Physiol. Rev. 2008;88:1009–1086.
31.Choudhury L., Rosen S.D., Patel D., Nihoyannopoulos P., Camici P.G. Coronary vasodilator reserve in primary and secondary left ventricular hypertrophy. A study with positron emission tomography. Eur. Heart J. 1997;18:108–116.
32.Armstrong SA, Herr MJ. Physiology, Nociception. 2022 May 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan
33, Franke KB, Nerlekar N, Marshall H, Psaltis PJ. Systematic review and metaanalysis of the clinical characteristics and outcomes of spontanous coronary artery dissection. Int J Cardiol. 2021 Jan 1;322:34-39.
Figure 1. Study Flow Chart
Abbreviations: SCAD: Spontaneous Coronary Artery Dissection.
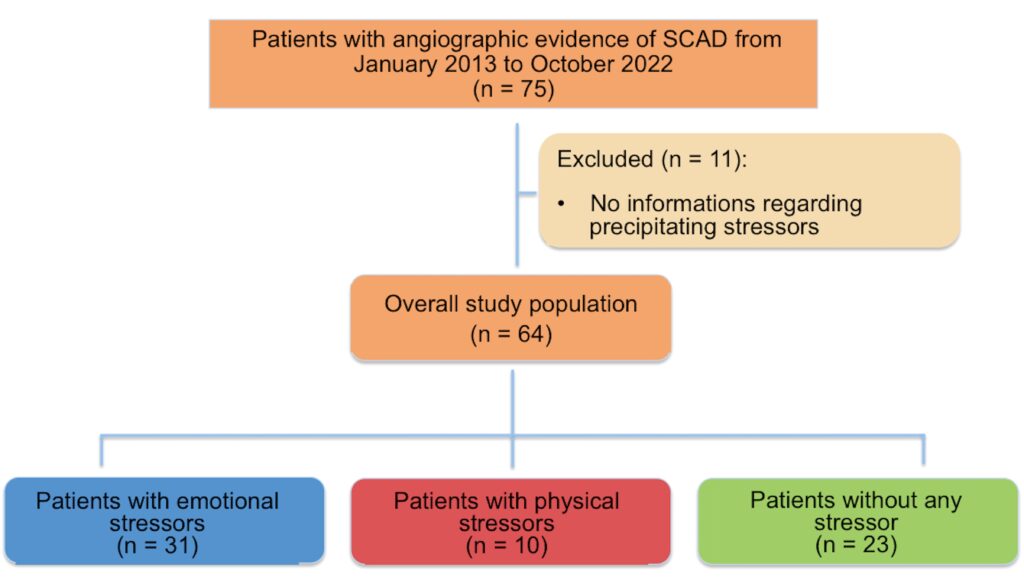
Figure 2. Clinical characteristics in the overall population according to the presence and type of precipitating stressors
Table 1. Clinical, biochemical, echocardiographic and angiographic features in the overall population and according to the presence and type of precipitating stressors
| Characteristics | Overall population (n = 64) | Patients with emotional stressors (n = 31) | Patients with physical stressors (n = 10) | Patients without any stressor (n = 23) | p value |
| Clinical characteristics Age [median (IQR)] Female sex [n, (%)] Peripheral artery disease [n, (%)] CKD [n, (%)] Fibromuscular dysplasia [n, (%)] Previous stroke/TIA [n, (%)] Previous PE [n, (%)] T-RF Hypertension [n, (%)] Diabetes [n, (%)] Smoking habit [n, (%)] Dyslipidaemia [n, (%)] Family history of CAD [n, (%)] BMI [median (IQR)] NT-RF [n, (%)] Sex-related Autoimmune disease Connective tissue disorders Obstetrics disease Thrombophilia Hormone therapy Thyroid disorders Migraine Gender-related Chronic stress Anxiety Depression | 54.0 [47.0; 65.0] 56 (87.5) 3 (4.7) 0 (0.0) 7 (10.9) 1 (1.6) 1 (1.6) 25 (39.1) 2 (3.1) 18 (28.1) 17 (26.6) 14 (21.9) 23.0 [22.0; 26.0] 6 (9.4) 0 (0.0) 12 (18.8) 6 (9.4) 19 (29.7) 19 (29.7) 8 (12.5) 32 (50.0) 9 (14.1) 5 (7.8) | 51.0 [47.0; 60.0] 30 (96.8) 0 (0.0) 0 (0.0) 5 (16.1) 0 (0.0) 1 (3.2) 8 (25.8) 0 (0.0) 9 (29.0) 5 (16.1) 8 (25.8) 23.0 [21.0; 25.0] 3 (9.7) 0 (0.0) 6 (19.3) 5 (16.1) 11 (35.5) 10 (32.2) 5 (16.1) 21 (66.7) 5 (16.1) 3 (9.7) | 53.0 [48.0; 63.2] 6 (60.0) 1 (10.0) 0 (0.0) 1 (10.0) 0 (0.0) 0 (0.0) 7 (70.0) 0 (0.0) 5 (50.0) 6 (60.0) 4 (40.0) 25.0 [22.0; 30.2] 0 (0.0) 0 (0.0) 0 (0.0) 1 (10.0) 1 (10.0) 3 (30.0) 1 (10.0) 3 (30.0) 1 (10.0) 0 (0.0) | 60.0 [48.0; 66.0] 20 (86.9) 2 (8.7) 0 (0.0) 1 (4.3) 1 (4.3) 0 (0.0) 10 (43.5) 2 (8.7) 4 (17.4) 6 (26.1) 2 (8.7) 24.0 [22.0; 27.0] 3 (13.0) 0 (0.0) 6 (26.1) 0 (0.0) 7 (30.4) 6 (26.1) 2 (8.7) 8 (34.8) 3 (13.0) 2 (8.7) | 0.094 0.009 0.225 – 0.118 0.413 0.817 0.039 0.159 0.158 0.024 0.103 0.364 0.496 – 0.209 0.132 0.307 0.886 0.693 0.022 0.876 0.600 |
| Clinical presentation [n, (%)] STEMI NSTEMI Cardiac arrest caused by VF | 16 (25.0) 44 (68.8) 4 (6.2) | 6 (19.3) 23 (74.2) 2 (6.4) | 3 (30.0) 7 (70.0) 0 (0.0) | 7 (30.4) 14 (60.9) 2 (8.7) | 0.744 |
| Laboratory data [median (IQR)] Hb (g/dL) PLT (× 103/L) WBC (× 103/μL) Neutrophils (× 103/μL) Eosinophils (× 103/μL) Monocytes (× 103/μL) Basophils (× 103/μL) Lymphocytes(×103/μL) CRP (mg/dL) Fasting glycaemia (mg/dL) HbA1c (mmol/mol) Total cholesterol (mg/dL) LDL cholesterol (mg/dL) Serum creatinine on admission (mg/ dL) | 13.5 [12.3; 14.1] 239.0 [209.0; 293.0] 7.5 [6.7; 10.0] 5.6 [4.6; 8.1] 0.07 [0.03; 0.11] 0.49 [0.38; 0.69] 0.02 [0.02; 0.04] 1.46 [1.15; 1.97] 6.5 [3.0; 40.1] 94.0 [85.0; 122.0] 34.0 [31.5; 36.5] 170.0 [147.0; 209.0] 97.0 [75.0; 123.5] 0.6 [0.6; 0.8] | 13.5 [12.3; 14.2] 234.0 [189.0; 292.0] 7.3 [6.3; 10.0] 5.0 [4.3; 8.5] 0.10 [0.06; 0.15] 0.45 [0.36; 0.69] 0.02 [0.02; 0.03] 1.46 [1.24; 1.85] 15.0 [5.6; 64.8] 93.0 [82.0; 123.0] 33.5 [30.7; 35.5] 165.0 [142.0; 187.5] 85.5 [74.0; 112.0] 0.6 [0.6; 0.7] | 13.1 [10.9; 14.2] 270.0 [219.8; 325.2] 9.0 [7.0; 12.6] 6.3 [5.4; 10.2] 0.04 [0.02; 0.08] 0.59 [0.37; 0.78] 0.02 [0.04; 0.04] 1.56 [1.17; 1.90] 3.0 [1.0; 23.9] 111.5 [87.5; 142.7] 35.5 [34.0; 42.2] 208.0 [176.2; 213.2] 133.5 [108.0; 145.0] 0.6 [0.6; 0.9] | 13.5 [12.4; 14.0] 230.0 [195.7; 254.5] 8.2 [6.3; 10.0] 5.6 [4.7; 7.1] 0.05 [0.02; 0.10] 0.50 [0.47; 0.69] 0.02 [0.02; 0.03] 1.39 [0.94; 2.12] 4.0 [2.0; 15.8] 95.0 [89.0; 113.5] 35.0 [31.0; 36.0] 174.0 [132.0; 218.7] 104.0 [63.7; 121.5] 0.6 [0.6; 0.7] | 0.794 0.232 0.269 0.240 0.012 0.422 0.243 0.986 0.037 0.306 0.228 0.109 0.011 0.855 |
| Echocardiographic data LVEF on admission (%) [median (IQR)] LVEF on admission < 50% [n, (%)] | 55.0 [55.0; 60.0] 9 (14.1) | 55.0 [55.0; 60.0] 3 (9.7) | 55.0 [48.7; 60.0] 2 (20.0) | 55.0 [55.0; 60.0] 4 (17.4) | 0.737 0.608 |
| Angiographic-related data [n, (%)] Vessel involved LM LAD LCX RCA Yip-Saw classification Type 1 Type 2 Type 3 Type 4 PCI/DES Therapy at discharge [n, (%)] DAPT ASA + Clopidogrel ASA + Ticagrelor ASA + Prasugrel SAPT | 1 (1.6) 32 (50.0) 22 (34.4) 9 (14.1) 12 (18.8) 36 (56.2) 6 (9.4) 10 (15.6) 4 (6.2) 37 (57.8) 22 (34.4) 0 (0.0) 5 (7.8) | 1 (3.2) 19 (63.3) 9 (29.0) 2 (6.4) 4 (12.9) 21 (67.7) 3 (9.7) 3 (9.7) 2 (6.4) 19 (61.3) 10 (32.2) 0 (0.0) 2 (6.5) | 0 (0.0) 4 (40.0) 4 (40.0) 2 (20.0) 3 (30.0) 4 (40.0) 0 (0.0) 3 (30.0) 0 (0.0) 7 (70.0) 3 (30.0) 0 (0.0) 0 (0.0) | 0 (0.0) 9 (39.1) 9 (39.1) 5 (21.8) 5 (21.8) 11 (47.8) 3 (13.0) 4 (17.4) 2 (8.7) 11 (47.8) 9 (39.2) 0 (0.0) 3 (13.0) | 0.471 0.404 0.636 0.680 |
Legend to table:
ASA: Cardioaspirin; BMI: Body Mass Index; CAD: Coronary Artery Disease; CKD: Chronic Kidney Disease; CRP: C-Reactive Protein; DAPT: Dual Anti-Platelet therapy; Hb: Hemoglobin; HbA1c: Glycated Hemoglobin; IQR: InterQuartile Range; LAD: Left Atrial Descending; LDL: Low-Density Lipoprotein; LM: Left Main; LCX: Left Circumflex; LVEF: Left Ventricular Ejection Fraction; NSTEMI: NON-ST segment Elevation Myocardial Infarction; NT-RF: Non-Traditional Risk Factors; PCI-DES: Percutaneous Coronary Intervention – Drug Eluting Stent; PE: Pulmonary Embolism; PLT: Platelets; RCA: Right Coronary Artery; SAPT: Single Anti-Platelet therapy SD: Standard Deviation; STEMI: ST-segment Elevation Myocardial Infarction; TIA: Transient Ischemic Attack; T-RF: Traditional Risk Factors; VF: Ventricular Fibrillation; WBC: White Blood Count.
Table 2. Clinical outcomes in the overall population and according to the presence and type of precipitating stressors
| Characteristics | Overall population (n= 64) | Patients with emotional stressors (n=31) | Patients with physical stressors (n = 10) | Patients without any stressor (n = 23) | p value |
| MACE [n, (%)] CV death Non-fatal MI Unplanned coronary revascularization Recurrent SCAD [n, (%)] Recurrent chest pain [n, (%)] Hemorrhagic events [n, (%)] | 11 (17.2) 1 (1.6) 10 (15.6) 0 (0.0) 5 (8.8) 12 (18.7) 4 (6.2) | 7 (22.6) 1 (3.2) 6 (19.4) 0 (0.0) 4 (12.9) 10 (32.2) 2 (6.4) | 1 (10.0) 0 (0.0) 1 (10.0) 0 (0.0) 0 (0.0) 1 (10.0) 1 (10.0) | 3 (13.0) 0 (0.0) 3 (13.0) 0 (0.0) 1 (4.3) 1 (4.3) 1 (4.3) | 0.525 0.309 0.025 0.825 |
Legend to table:
CV: Cardiovascular; MACE: Major Adverse Cardiovascular Event; MI: Myocardial Infarction; SCAD: Spontaneous Coronary Artery Dissection
Un fortuito riscontro di forame ovale pervio
Simone Pasquale Crispino1, Andrea Segreti1,2, Ylenia La Porta1, Paola Liporace1, Myriam Carpenito1, Valeria Cammalleri1, Gian Paolo Ussia1, Francesco Grigioni1
1 Dipartimento di Scienze Cardiovascolari, Fondazione Policlinico Universitario Campus Bio-Medico, Roma.
2 Dipartimento di Scienze Motorie, Umane e della Salute, Università degli studi di Roma “Foro Italico”, Roma.
ABSTRACT
Un uomo di 55 anni affetto da scompenso cardiaco a frazione di eiezione ridotta e con storia di TIA è stato ricoverato per dispnea ed intolleranza all’esercizio fisico. Dopo ottimizzazione della terapia medica, è stato effettuato un test da sforzo cardiopolmonare che ha mostrato un repentino aumento della VE/VCO2 slope, della PETO2 e del RER, con concomitante diminuzione della PETCO2 e della SpO2. Questi reperti hanno posto il sospetto di un’ipertensione indotta dall’esercizio fisico e della presenza di uno shunt destro-sinistro dinamico. Esami strumentali successivi hanno rivelato la presenza di un forame ovale pervio misconosciuto.
PRESENTAZIONE DEL CASO
Un uomo di 55 anni affetto da scompenso cardiaco a frazione di eiezione ridotta (HFrEF) noto è stato ricoverato in Cardiologia per dispnea ingravescente. L’anamnesi patologica remota metteva in evidenza un pregresso riscontro di vasi coronarici indenni da lesioni angiograficamente significative, successivo impianto di defibrillatore transvenoso (ICD) in prevenzione primaria ed un pregresso attacco ischemico transitorio (TIA). Il paziente è stato indirizzato presso il nostro Centro per la caratterizzazione della dispnea e l’approfondimento diagnostico dell’ulteriore peggioramento della funzione sistolica ventricolare sinistra. È stato sottoposto a nuova coronarografia che ha confermato l’assenza di malattia coronarica ostruttiva, e a cateterismo cardiaco destro che non ha rilevato ipertensione polmonare a riposo. L’ecocardiogramma transtoracico (TTE) ha mostrato un ventricolo sinistro dilatato con ipocinesia globale (FEVS 35%), in assenza di ulteriori reperti di rilievo. Il controllo dell’ICD ha evidenziato alcuni episodi di tachicardia ventricolare interrotta con pacing antitachicardico (ATP). Durante la degenza, è stata ulteriormente ottimizzata la terapia medica secondo le linee guida ESC 2021 sullo scompenso cardiaco.
Prima della dimissione, è stato infine eseguito un test da sforzo cardiopolmonare (CPET) per valutare la dispnea e la limitata tolleranza all’esercizio fisico.
Il test è stato eseguito con un protocollo di rampa da 10 Watt ed è risultato massimale. La VO2 di picco ottenuta è risultata fortemente ridotta (16,8 ml/kg/min, 51% del predetto). Durante l’esercizio, a circa 60 W, è stato osservato un notevole aumento della PETO2 e del quoziente respiratorio (RER) con una concomitante diminuzione della PETCO2 e della SpO2. Contestualmente, è stato osservato un aumento della VE/VCO2, a sottolineare la presenza di ipertensione polmonare indotta dall’esercizio.
Nel sospetto di uno shunt interatriale, è stato successivamente eseguito un ecocardiogramma transtoracico e Doppler transcranico con bubble test che hanno evidenziato la presenza di un PFO misconosciuto. Inoltre, è stato eseguito un ecocardiogramma transesofageo (TEE) per fornire una valutazione dettagliata del PFO. Secondo la classificazione di Rana1, il TEE ha mostrato un PFO con una morfologia “semplice”, caratterizzato da un “tunnel length” di 6,5 mm e da un unico orifizio che si immette nell’atrio sinistro delle dimensioni di 4,5 mm.
DISCUSSIONE
Il forame ovale è una comunicazione vestigiale tra gli atri che funziona come un bypass della circolazione polmonare durante la vita fetale e che nella maggior parte delle persone, successivamente alla nascita, va incontro a chiusura dopo l’inizio della respirazione. Ad ogni modo, in circa il 25% degli adulti persiste una pervietà del forame ovale. Tramite questa pervietà può instaurarsi uno shunt destro-sinistro, in particolar modo nei pazienti con scompenso cardiaco, che possono presentare ipertensione polmonare a riposo o durante l’esercizio.
Da un punto di vista fisiopatologico, in presenza di un PFO e di un concomitante aumento delle resistenze vascolari polmonari, il ritorno venoso indotto dall’esercizio aumenta e determina un aumento della pressione atriale destra. Quando quest’ultima supera la pressione atriale sinistra, il ritorno venoso può deviare attraverso il PFO, portando il sangue deossigenato, acido e ricco di CO2 verso la circolazione sistemica.2 Pertanto i chemocettori vengono attivati ed inducono, così, l’iperventilazione per compensare adeguatamente l’elevata quantità di CO2 presente nel sangue proveniente dalle sezioni destre del cuore. Questi aspetti fisiopatologici vengono evidenziati al CPET da un improvviso aumento di PETO2 e una diminuzione della PETCO2, che riflettono PaO2 e PaCO2.
Nel caso presentato, il concomitante aumento della pendenza VE/VCO2 sottolinea un’ipertensione polmonare indotta dall’esercizio, condizione frequentemente associata allo scompenso cardiaco, e che contribuisce ulteriormente alla dispnea e all’intolleranza allo sforzo fisico. In questo caso, infatti, l’ipertensione polmonare si è sviluppata durante l’esercizio, determinando l’inversione dello shunt in un paziente con PFO misconosciuto.
I risultati presentati concordano con i criteri postulati nel 2002 da Sun3 per indentificare mediante il CPET uno shunt destro-sinistro indotto dall’esercizio.
CONCLUSIONI
Nel caso presentato, il CPET ha contribuito a diagnosticare un PFO misconosciuto con uno shunt destro-sinistro indotto dallo sforzo in un paziente con un precedente TIA inspiegato. Inoltre, ha smascherato l’ipertensione polmonare indotta dallo sforzo come causa di dispnea ingravescente in un paziente affetto da scompenso cardiaco. Per la valutazione di un sospetto PFO le attuali linee guida non prevedono l’uso del CPET o del cateterismo cardiaco destro sotto sforzo, bensì esclusivamente l’esecuzione di esami in condizioni di riposo.4 Una valutazione durante l’esercizio potrebbe, tuttavia, rivelarsi particolarmente utile per la diagnosi di PFO, come dimostrato nel presente caso.
BIBLIOGRAFIA
1. Rana BS, Shapiro LM, McCarthy KP, Ho SY. Three-dimensional imaging of the atrial septum and patent foramen ovale anatomy: defining the morphological phenotypes of patent foramen ovale. Eur J Echocardiogr. 2010;11(10):i19-25.
2. Lovering AT, Stickland MK, Amann M, O’Brien MJ, Hokanson JS, Eldridge MW. Effect of a patent foramen ovale on pulmonary gas exchange efficiency at rest and during exercise. J Appl Physiol (1985). 2011;110(5):1354-1361.
3. Sun X-G, Hansen JE, Oudiz RJ, Wasserman K. Gas Exchange Detection of Exercise-Induced Right-to-Left Shunt in Patients With Primary Pulmonary Hypertension. Circulation. 2002;105(1):54-60.
4. Pristipino C, Sievert H, D’Ascenzo F, et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. European Heart Journal. 2018;40(38):3182-3195.
Tachicardia ventricolare da RVOT: il mappaggio elettroanatomico tridimensionale come chiave per la diagnosi differenziale tra forma idiopatica e cardiomiopatia aritmogena del ventricolo destro.
Linda Piras1, Raffaella Mistrulli1, Armando Ferrera1, Erika Pagannone1, Giuliano Tocci1, Roberta Falcetti1, Francesco Raffaele Spera1, Emanuele Barbato1
1U.O.C Cardiologia, Azienda Ospedaliero-Universitaria Sant’Andrea, Roma.
ABSTRACT
La cardiomiopatia aritmogena (ACM) è una cardiomiopatia ereditaria caratterizzata da una progressiva sostituzione fibroadiposa del miocardio che può colpire il ventricolo destro, quello sinistro o entrambi i ventricoli.
La ACM presenta un ampio spettro di manifestazioni cliniche, tra cui aritmie ventricolari, scompenso cardiaco e miocardite. Nonostante siano stati validati una serie di criteri elettrocardiografici, morfologici, istologici e genetici, la diagnosi di ACM rimane una sfida clinica, soprattutto nelle fasi precoci o forme lievi in cui le alterazioni strutturali sono minime, ma si associano ugualmente ad instabilità elettrica e rischio aritmico. In questo contesto, il mappaggio elettroanatomico tridimensionale (EAM) potrebbe offrire la possibilità di individuare le cicatrici elettroanatomiche che nella maggior parte dei casi si trovano nel tratto di efflusso ventricolare destro (RVOT) e sono predittive della sostituzione fibroadiposa, anche quando le alterazioni sono poco evidenti con altre tecniche.
CASO CLINICO
Presentiamo il caso di un uomo di 37 anni fumatore, privo di familiarità per cardiomiopatie o morte improvvisa ed altri fattori di rischio. Da circa un anno, aveva presentato saltuari episodi di cardiopalmo.
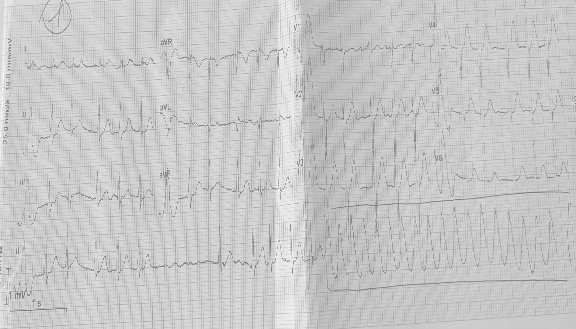
Per la comparsa di un episodio più intenso e di maggior durata, accedeva in Pronto Soccorso. L’elettrocardiogramma (Figura 1) mostrava fibrillazione atriale con FC media di 120 bpm con comparsa di una tachicardia a complessi larghi e FC di 200 bpm, emodinamicamente ben tollerata. Al secondo elettrocardiogramma, si evidenziava ripristino del ritmo sinusale e ritardo di conduzione intraventricolare destro. Gli esami ematici e l’ecocardiogramma non mostravano anomalie di rilievo. Il paziente veniva ricoverato e sottoposto a studio elettrofisiologico, che non mostrava presenza di vie accessorie, di doppia fisiologia nodale o pattern di Brugada al test all’ajmalina.
Si decideva dunque di procedere ad isolamento delle vene polmonari con crioablazione. Nel postoperatorio, si documentavano al monitoraggio telemetrico frequenti extrasistoli ventricolari e brevi run di tachicardia ventricolare non sostenuta (TVNS) monomorfa, ad apparente origine dal RVOT. Il paziente veniva sottoposto a cardio-TC, risultata nella norma, e risonanza magnetica cardiaca, che evidenziava una sottile stria di late gadolinium enhancement subepicardico a carico del segmento basale della parete laterale e inferiore del ventricolo sinistro, in assenza di segni di sostituzione fibroadiposa. Si decideva di ripetere lo studio elettrofisiologico, inducendo, dopo singolo extrastimolo (drive 600/210 msec), di una TV monomorfa alla FC di 240 bpm emodinamicamente ben tollerata e a verosimile partenza dal RVOT.
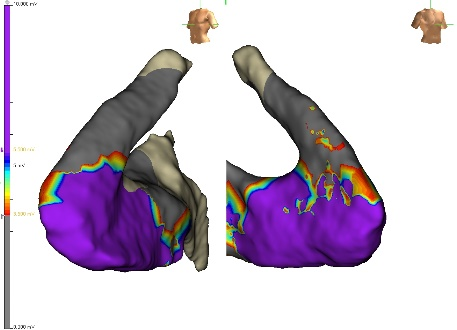
In considerazione del mismtach tra il risultato della risonanza e l’origine della TV, si decideva di eseguire un EAM di substrato del ventricolo destro e mappa di attivazione dell’extrasistolia ventricolare, con evidenza di origine dalla porzione anterolaterale del RVOT. Si procedeva dunque ad ablazione del focus mediante radiofrequenza con scomparsa dell’extrasistolia dopo sei secondi.
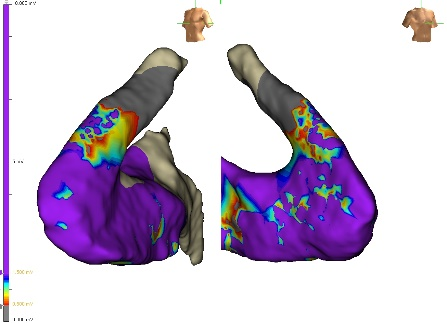
Mediante catetere multipolare ad alta definizione (HD Grid, Abbott) si evidenziavano aree di bassi voltaggi bipolari a livello della parete anterolaterale e un’ampia zona di bassi voltaggi unipolari a livello di tutto il RVOT (Figure 2 e 3) confermati con il catetere ablatore con sensore di contatto. Veniva eseguita infusione di isoprotenerolo senza induzione di aritmie.
In considerazione del buon risultato dell’ablazione e della necessità di uno stretto follow-up, veniva impiantato un loop recorder (Biomonitor III m, Biotronik) e il paziente veniva dimesso in terapia betabloccante ed anticoagulante. All’ultimo follow-up, si è mostrato asintomatico, con assenza di anomalie significative all’elettrocardiogramma ed ecocardiogramma. Il loop recorder non ha evidenziato aritmie significative. È stato inoltre eseguito un prelievo per l’analisi genetica, tuttora in corso.
DISCUSSIONE
La TV ad origine dal RVOT costituisce un’aritmia comune, attribuibile a due principali cause: 1) forma idiopatica; 2) secondaria alla ACM, con coinvolgimento del ventricolo destro.
La forma idiopatica è generalmente benigna, non ereditaria, che si manifesta tipicamente in giovani senza alcuna cardiopatia strutturale. Al contrario, la forma legata alla ACM predispone all’insorgenza di morte improvvisa [1][2]. Sebbene sia cruciale distinguere queste due condizioni, spesso la diagnosi differenziale può essere complessa, specialmente nel caso di forme precoci o lievi di ACM, difficilmente rilevabili dalle tecniche di imaging convenzionali [2][3][4]. In questo contesto, la dimostrazione istopatologica della sostituzione fibroadiposa tramite biopsia rappresenterebbe l’unico metodo per una diagnosi certa [5]. Tuttavia, tale tecnica è limitata dalla sua invasività, dalla natura segmentale della patologia e incapacità di valutare le variazioni transmurali della parete del ventricolo destro, dalla difficoltà nel distinguere il tessuto adiposo patologico dal tessuto subepicardico o da altre cardiomiopatie [5][6]. Recentemente, l’utilizzo dell’EAM è emerso come un metodo affidabile per identificare e caratterizzare le regioni a basso voltaggio, note come “cicatrici elettroanatomiche”, che nei pazienti con ACM corrispondono a zone di deplezione miocardica e correlano con l’aspetto istopatologico di atrofia e sostituzione fibroadiposa [5][7][8][9]. Questa tecnica è dunque utile per la diagnosi differenziale della TV da RVOT, dove nel caso di forme idiopatiche si hanno voltaggi normali mentre nel caso della ACM si osservano aree di basso voltaggio [1][5][7].
La presentazione iniziale del nostro paziente, con la fibrillazione atriale, non è rara nei pazienti con ACM. Una recente meta-analisi comprendente 16 studi con 1986 pazienti affetti da ACM ha riportato una prevalenza complessiva del 12,9% [10]. Dai dati attualmente a disposizione, la fibrillazione atriale si verifica prevalentemente nella fase iniziale di malattia in assenza di alterazioni strutturali conclamate e riflette la presenza di instabilità elettrica [11].
CONCLUSIONI
Nonostante l’elevato sospetto clinico, in assenza dei risultati dell’analisi genetica non possiamo porre una diagnosi definitiva di ACM [12]. Tuttavia, le caratteristiche cliniche sembrerebbe confermare l’esistenza di una fase precoce “occulta”, caratterizzata da sottili modificazioni strutturali, che possono limitarsi a una specifica zona del cosiddetto “triangolo di displasia” e manifestarsi esclusivamente con TV da RVOT. Inoltre, la descrizione di tale caso fornisce un contributo alla validazione dell’EAM come strumento diagnostico in questo contesto. Questo approccio, focalizzato sugli effetti elettrici – piuttosto che meccanici – della sostituzione fibroadiposa, potrebbe infatti superare alcune delle limitazioni dell’analisi istologica.
BIBLIOGRAFIA
[1] D. Corrado et al., “Three-Dimensional Electroanatomical Voltage Mapping and Histologic Evaluation of Myocardial Substrate in Right Ventricular Outflow Tract Tachycardia,” J. Am. Coll. Cardiol., vol. 51, no. 7, pp. 731–739, 2008, doi: 10.1016/j.jacc.2007.11.027.
[2] A. E. Buxton, H. L. Waxman, F. E. Marchlinski, M. B. Simson, D. Cassidy, and M. E. Josephson, “Right ventricular tachycardia: Clinical and electrophysiologic characteristics,” Circulation, vol. 68, no. 5, pp. 917–927, 1983, doi: 10.1161/01.CIR.68.5.917.
[3] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: an update,” Heart, 2009.
[4] D. Corrado et al., “Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: A multicenter study,” J. Am. Coll. Cardiol., vol. 30, no. 6, pp. 1512–1520, 1997, doi: 10.1016/S0735-1097(97)00332-X.
[5] D. Corrado et al., “Three-dimensional electroanatomic voltage mapping increases accuracy of diagnosing arrhythmogenic right ventricular cardiomyopathy/dysplasia,” Circulation, vol. 111, no. 23, pp. 3042–3050, 2005, doi: 10.1161/CIRCULATIONAHA.104.486977.
[6] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: diagnosis, prognosis, and treatment,” Heart, 2000.
[7] M. Boulos, I. Lashevsky, S. Reisner, and L. Gepstein, “Electroanatomic mapping of arrhythmogenic right ventricular dysplasia,” J. Am. Coll. Cardiol., vol. 38, no. 7, pp. 2020–2027, 2001, doi: 10.1016/S0735-1097(01)01625-4.
[8] F. E. Marchlinski et al., “Electroanatomic substrate and outcome of catheter ablative therapy for ventricular tachycardia in setting of right ventricular cardiomyopathy,” Circulation, vol. 110, no. 16, pp. 2293–2298, 2004, doi: 10.1161/01.CIR.0000145154.02436.90.
[9] A. Verma et al., “Short- and long-term success of substrate-based mapping and ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia,” Circulation, vol. 111, no. 24, pp. 3209–3216, 2005, doi: 10.1161/CIRCULATIONAHA.104.510503.
[10] Rujirachun P, Wattanachayakul P, Charoenngam N, Winijkul A, Ungprasert P. Prevalence of atrial arrhythmia in patients with arrhythmogenic right ventricular cardiomyopathy: a systematic review and meta-analysis. J Cardiovasc Med (Hagerstown). 2020 May;21(5):368-376
[11] Peters S. Atrial arrhythmias in arrhythmogenic cardiomyopathy: at the beginning or at the end of the disease story? Circ J. 2015;79(2):446
[12] Corrado D, Perazzolo Marra M, Zorzi A, Beffagna G, Cipriani A, Lazzari M, Migliore F, Pilichou K, Rampazzo A, Rigato I, Rizzo S, Thiene G, Anastasakis A, Asimaki A, Bucciarelli-Ducci C, Haugaa KH, Marchlinski FE, Mazzanti A, McKenna WJ, Pantazis A, Pelliccia A, Schmied C, Sharma S, Wichter T, Bauce B, Basso C. Diagnosis of arrhythmogenic cardiomyopathy: The Padua criteria. Int J Cardiol. 2020 Nov 15;319:106-114.
Ventricular ectopy unmasked: ectopia ventricolare maligna da sistema del Purkinje in paziente con Wolff-Parkinson-White
Silvia Grimaldi,1 Mattia Alberti,1 Francesco Gentile1,2
1 Department of Pathology, Cardiology Division, University of Pisa, Pisa, Italy
2 Health Science Interdisciplinary Center, Scuola Superiore Sant’Anna, Pisa, Italy
ABSTRACT
La flecainide è un farmaco antiaritmico di largo impiego nella pratica clinica, nel trattamento e prevenzione delle tachicardie sopraventricolari, come la fibrillazione atriale (FA). Riportiamo il caso di un uomo di 53 anni, sottoposto ad ablazione di fascio accessorio postero-settale destro a seguito di episodio di FA pre-eccitata, candidato a terapia profilattica con flecainide. A distanza di qualche ora dall’assunzione del farmaco, al monitoraggio elettrocardiografico si documentavano extrasistoli ventricolari polimorfe a QRS stretto, precoci e ripetitive. Con la sospensione della flecainide, queste si riducevano fino a scomparire. Nel sospetto di extrasistolia maligna da sistema del Purkinje, veniva eseguito studio elettrofisiologico e test provocativo, con conferma del sospetto clinico. Il paziente veniva quindi sottoposto ad ablazione transcatetere del substrato aritmico e impianto di defibrillatore.
ABBREVIAZIONI
FA: fibrillazione atriale
EV: extrasistoli ventricolari
SEF: studio elettrofisiologico
INTRODUZIONE
La flecainide è impiegata nel trattamento della fibrillazione atriale (FA) in quanto rapida ed efficace nel ripristino del ritmo sinusale in acuto1 e ben tollerata in cronico.2-3 Le controindicazioni al suo utilizzo sono: disturbi della conduzione,4 cardiopatia strutturale5 e sindrome di Brugada. In quest’ultimo scenario, l’utilizzo dei farmaci di classe IC è limitato al test provocativo.6
CASO CLINICO
Presentiamo il caso di un paziente di 53 anni senza storia cardiologica, fattori di rischio cardiovascolari e familiarità per morte improvvisa.
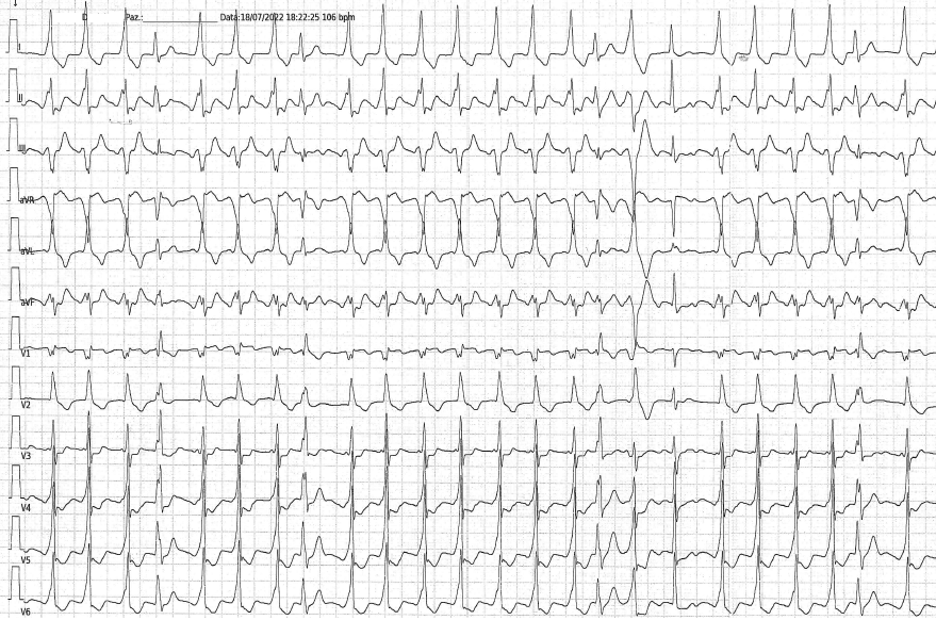
Il paziente giungeva alla nostra attenzione per cardiopalmo, discomfort toracico e dispnea. L’elettrocardiogramma mostrava tachicardia a QRS largo e ciclo irregolare (Figura 1). L’ecocardiogramma e gli esami ematochimici risultavano nella norma. Si decideva pertanto di eseguite una con cardioversione elettrica e ricoverare il paziente.
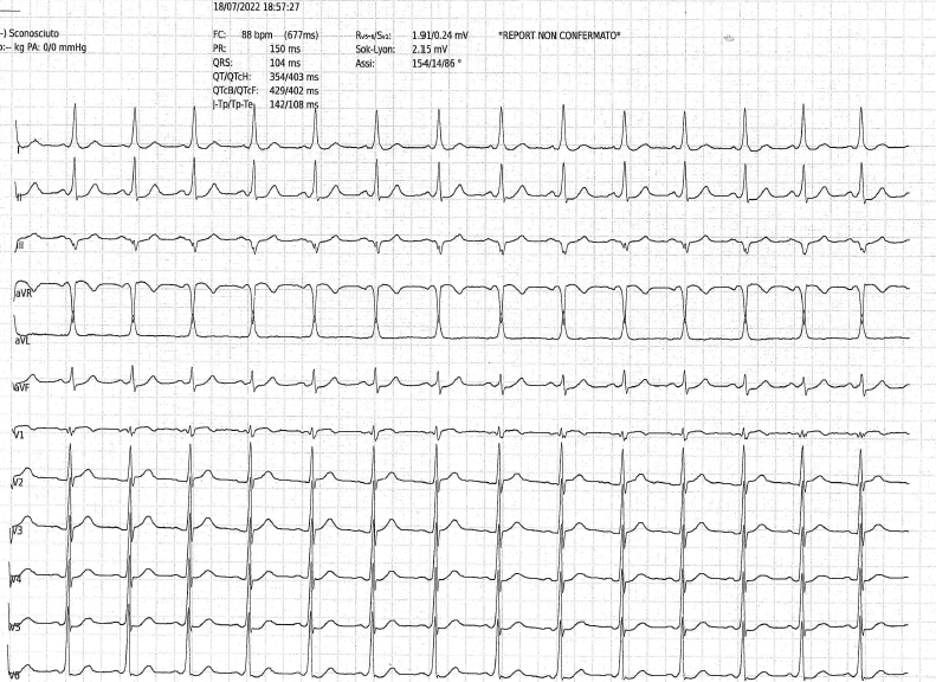
Al ripristino del ritmo sinusale, si osservavano segni elettrocardiografici di pre-eccitazione (Figura 2). Si eseguiva dunque uno studio elettrofisiologico (SEF), con identificazione di un fascio accessorio postero-settale destro con caratteristiche di esclusiva conduzione anterograda, sottoposto ad ablazione transcatetere. Si introduceva dunque la flecainide per la prevenzione di recidive aritmiche.
In seguito alla prima assunzione del farmaco, si osservava la comparsa di extrasistolia ventricolare (EV) polimorfa precoce e ripetitiva, con QRS relativamente stretto. La morfologia prevalente risultava compatibile con un’origine dal sistema di Purkinje del ventricolo sinistro. Si sospendeva la flecainide e si introduceva verapamil, parzialmente efficace nel sopprimere le EV, ma mal tollerata per spiccata bradicardia.
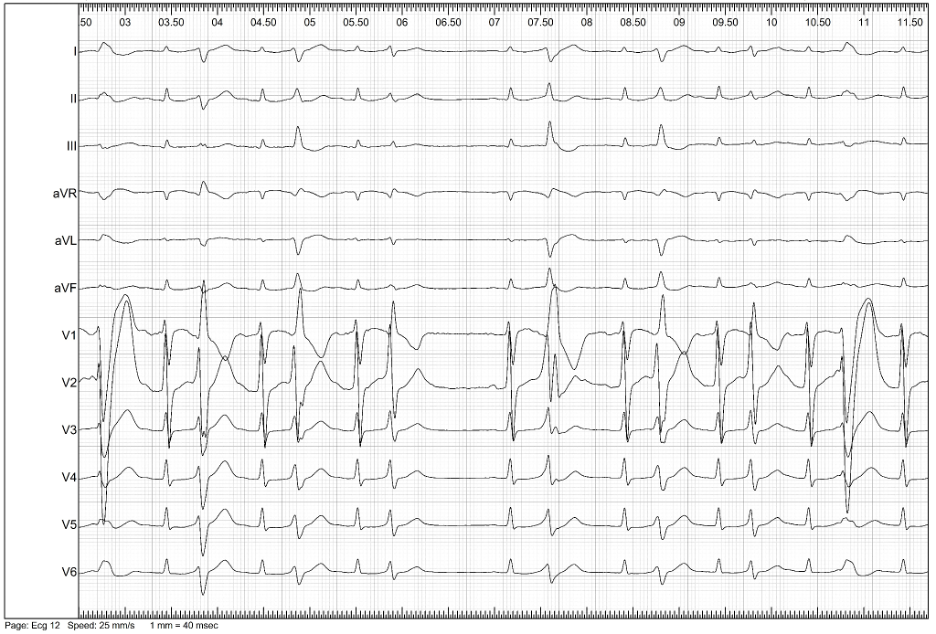
Per una migliore caratterizzazione dell’EV, si decideva di sottoporre il paziente a nuovo SEF. Al mappaggio elettroanatomico basale non si evidenziavano aree di attivazione ventricolare precoce. Si procedeva all’infusione di ajmalina (1 mg/kg in 10 minuti) con comparsa di EV multifocale precoce e ripetitiva, ad origine dal fascicolo posteriore e anteriore del sistema di conduzione (Figura 3-4).
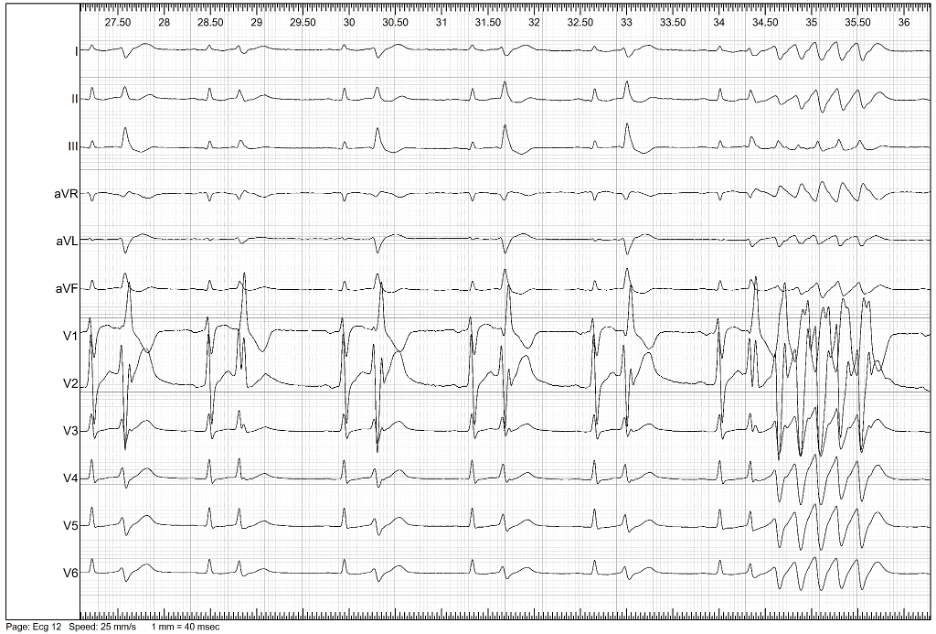
In assenza di cardiopatia strutturale e della riproducibilità del fenomeno ectopico con infusione di antiaritmico di classe I, si poneva il sospetto di EV maligna del sistema del Purkinje. Tenendo conto dell’elevato rischio aritmico associato a questo tipo di EV, si procedeva ad ablazione del focus aritmico.
Tuttavia, nei giorni successivi, nonostante la procedura ablativa e la sospensione della flecainide, si assisteva alla recidiva di EV precoce polimorfa. In considerazione dell’associazione tra tale fenomeno ed il rischio di aritmie maligne, nonostante la difficoltà nella stratificazione del rischio nel caso di riscontro occasionale in paziente asintomatico, si decideva di procedere ad impianto di defibrillatore sottocutaneo, dopo colloquio esaustivo col paziente e sua partecipazione attiva alla decisione. Il paziente veniva dimesso con indicazione ad eseguire test genetico, risultato negativo per i geni testati (compreso SCN5A), e risonanza magnetica cardiaca, che ha confermato l’assenza di cardiopatia strutturale. Veniva data indicazione all’esecuzione di elettrocardiogramma basale nei familiari di primo grado, risultati nei limiti. Il paziente veniva seguito in follow-up nell’anno successivo, senza evidenza di recidive aritmiche.
DISCUSSIONE
Osservando come l’infusione di farmaci bloccanti i canali del sodio possa indurre EV in pazienti senza pattern di Brugada, Haissaguerre et al. hanno descritto per la prima volta l’extrasistolia maligna del Purkinje.7L’accezione “maligna” deriva dal breve intervallo di accoppiamento delle EV (<300 msec), con il rischio di “R-on-T”, fibrillazione ventricolare e morte improvvisa.8 In soggetti di età <45 anni sopravvissuti ad arresto cardiaco, dopo aver escluso cardiopatia ischemica e strutturale e le comuni canalopatie, è possibile porre diagnosi di fibrillazione ventricolare idiopatica. Questa è classificabile in due fenotipi 1) il substrato è rappresentato da alterazioni miocardiche subcliniche, identificabili al SEF come piccole aree in cui si registrano elettrogrammi anomali; 2) il trigger è rappresentato da EV precoci che originano dal sistema del Purkinje, più frequente in termini assoluti e con efficacia del trattamento ablativo.
In quest’ultima classe di pazienti, se la somministrazione di ajmalina è in grado di indurre EV precoci (>10/min) e/o forme ripetitive senza comparsa di pattern di Brugada, è possibile porre diagnosi di ectopia maligna del Purkinje. L’eziologia di questa condizione non è nota. I pazienti inclusi nello studio di Haissaguerre et al. sono stati sottoposti a test genetico per 63 geni implicati nella genesi di cardiomiopatie o canalopatie,7 ma non sono state identificate mutazioni patogenetiche. Alla risonanza magnetica, in nessuno dei pazienti sono state identificate anomalie strutturali. Inoltre, nessuno dei pazienti dello studio era precedentemente in terapia con farmaci di classe IC, per cui è possibile sospettare che esistano altri trigger, attualmente non noti, in grado di slatentizzare queste aritmie.
Al momento è impossibile produrre raccomandazioni circa la gestione di un paziente asintomatico con riscontro di EV maligna del Purkinje. Infatti, i casi di riscontro occasionali si collocano in una gray zone, senza evidenze cliniche. Considerando il modello del triangolo di Coumel,9 si può supporre che, in assenza di un substrato, l’identificazione e il trattamento del trigger (le EV) possa essere utile per prevenire aritmie maligne.10 Tuttavia, nel caso da noi riportato, la persistenza di EV precoci ha suggerito un risultato subottimale dell’ablazione. In assenza di evidenze riguardo al rischio di aritmie maligne nel contesto della prevenzione primaria, dopo discussione del caso con coinvolgimento attivo del paziente, è stato deciso di procedere all’impianto di un defibrillatore sottocutaneo.
CONCLUSIONI
L’extrasistolia maligna da fibre del Purkinje è una condizione rara e poco esplorata in letteratura. Nonostante incidenza e impatto clinico non siano chiari, è fondamentale riconoscere questa condizione, che può essere smascherata dall’utilizzo di antiaritmici di classe IC. Futuri studi dovranno chiarire l’impatto clinico di tale condizione, definendo dei percorsi diagnostici e strategie terapeutiche ottimali.
BIBLIOGRAFIA
- Donovan KD, Power BM, Hockings BE, Dobb GJ, Lee KY. Intravenous flecainide versus amiodarone for recent-onset atrial fibrillation. Am J Cardiol. 1995;75:693–697.
- Gulizia M, Mangiameli S, Orazi S, et al. A randomized comparison of amiodarone and class IC antiarrhythmic drugs to treat atrial fibrillation in patients paced for sinus node disease: the Prevention Investigation and Treatment: A Group for Observation and Research on Atrial arrhythmias (PITAGORA) trial. Am Heart J. 2008;155:100-107.e1.
- Aliot E, Denjoy I. Comparison of the safety and efficacy of flecainide versus propafenone in hospital out-patients with symptomatic paroxysmal atrial fibrillation/flutter. The flecainide AF French Study Group. Am J Cardiol. 1996;77:66A–71A.
- Hellestrand KJ, Bexton RS, Nathan AW, Spurrell RA, Camm AJ. Acute electrophysiological effects of flecainide acetate on cardiac conduction and refractoriness in man. Br Heart J. 1982;48:140-148.
- Greene HL, Roden DM, Katz RJ, Woosley RL, Salerno DM, Henthorn RW. The Cardiac Arrhythmia Suppression Trial: first CAST … then CAST-II. J Am Coll Cardiol. 1992;19:894-898.
- Wolpert C, Echternach C, Veltmann C, et al. Intravenous drug challenge using flecainide and ajmaline in patients with Brugada syndrome. Heart Rhythm. 2005;2:254-260.
- Escande W, Gourraud JB, Haissaguerre M, et al. Malignant Purkinje ectopy induced by sodium channel blockers. Heart Rhythm. 2022;19:1595-1603.
- Engel TR, Meister SG, Frankl WS. The “R-on-T” phenomenon: an update and critical review. Ann Intern Med. 1978;88:221-225.
- Jordaens L. A clinical approach to arrhythmias revisited in 2018 : From ECG over noninvasive and invasive electrophysiology to advanced imaging. Neth Heart J. 2018;26:182-189.
- Marcus GM. Evaluation and Management of Premature Ventricular Complexes. Circulation. 2020;141:1404-1418.




