Sassari 2023
Coinvolgimento cardiaco in corso di sclerosi sistemica
Enrico Ponti 1, Camilla Cirelli 2, Anna Merlo 2, Emanuele Curti 2, Gaetano Asile 3, Gaia Gasperini 4, Piermario Scuri 2
1. Università degli studi di Sassari
2. Università degli studi di Milano-Bicocca
3. Università degli studi di Napoli Federico II
4. Humanitas University
ABSTRACT
La sclerosi sistemica (SSc) è una rara malattia autoimmune che si manifesta con fenomeni fibrotici e vasculopatici interessanti la cute e talvolta gli organi interni. [1] La SSc può essere associata ad elevata morbilità e mortalità, soprattutto quando sussiste un coinvolgimento poli organo. [2]
Riportiamo un raro caso di una paziente di 27 anni con diagnosi di sclerosi sistemica e concomitante impegno cardiaco.
INTRODUZIONE
La diagnosi di coinvolgimento cardiaco primario nella SSc (pSHI) rappresenta una sfida significativa per i medici che gestiscono questa tipologia di pazienti. Il pSHI può presentarsi clinicamente con un fenotipo clinico variabile: talora con quadri di insufficienza cardiaca acuta o miocardite fulminante, difetti di conduzione asintomatici, aritmie ventricolari ed infine disfunzione diastolica ritenuta secondaria alla fibrosi miocardica.[3] In letteratura vi sono crescenti evidenze sui fenomeni fisiopatologici che portano all’insufficienza cardiaca: quest’ultima potrebbe instaurarsi in seguito a ripetuti episodi di ischemia che portano ad una fibrosi miocardica focale irreversibile. Le ragioni di questo fenomeno sono date dalla compromissione del microcircolo coronarico e l’anormale vasoreattività tipica di questi pazienti. La fibrosi miocardica e la microangiopatia vascolare possono favorire inoltre l’insorgenza di aritmie e disturbi della conduzione. Nonostante le evidenze istopatologiche di coinvolgimento cardiaco all’autopsia, il riscontro di pSHI nella pratica clinica è relativamente raro.[4]
In questo caso clinico vi parleremo di una paziente giunta alla nostra osservazione con il fenotipo clinico sopra menzionato.
CASO CLINICO
Donna di 27 anni, senza fattori di rischio e precedenti cardiovascolari. All’anamnesi patologica remota presenza di bronchite asmatica e disturbo dell’adattamento.
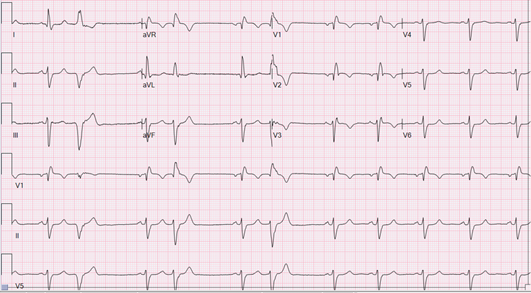
Nel 2016 è stata diagnosticata la Sclerosi Sistemica con interessamento cutaneo diffuso ed ulcere digitali ricorrenti. In tale occasione la paziente ha eseguito un ecocardiogramma che non mostrava alterazioni morfo-funzionali. È stata impostata con beneficio terapia con Metotrexate, Iloprost ev. e Bosentan. La paziente ha eseguito sino al 2021 le visite di follow-up reumatologico in maniera regolare. Persa al FU, ha interrotto le terapie sino a Giugno 2023, periodo in cui ha eseguito una visita reumatologica di controllo per ricomparsa di ulcere digitali. In tale occasione la paziente ha riferito nell’ultimo periodo presenza di dispnea ingravescente. Gli esami ematochimici mostravano un concomitante aumento dei valori di BNP (1112 ng/L). Per tale motivo è stata eseguita una consulenza cardiologica: l’ECG ha mostrato dei disturbi di conduzione (BBDx+EAS), all’ecocardiogramma sono state evidenziate alterazioni della cinetica segmentaria, un’iniziale disfunzione sistolica biventricolare e la presenza di segni indiretti di ipertensione polmonare. È stato inoltre eseguita la registrazione ECG Holter 24h dove sono state identificate numerose extrasistoli sopraventricolari e ventricolari polimorfe (entrambe, talvolta, disposte in ritmo bi e trigemino). Agli esami ematochimici è stato riscontrato un rialzo degli enzimi di miocardiocitonecrosi con andamento a plateau (TnI 400-500 ng/L). La paziente è stata pertanto ricoverata presso l’unità di Cardiologia dell’Ospedale ASST Papa Giovanni XXIII per gli approfondimenti diagnostici del caso.
Durante il ricovero, sono stati eseguiti diversi esami strumentali.
Ecocardiogramma- stress con dobutamina: il test è stato submassimale (66 % FC max teorica), interrotto per malessere e AIVC (triplette). Sono stati descritti verosimili esiti ischemici polidistrettuali: fibrosi della parete inferiore e posterolaterale ed assottigliamento del segmento apicale del setto interventricolare. È stata evidenziata una risposta ischemica sul setto apicale e sul segmento basale della parete laterale. È stata segnalata infine un’adeguata riserva contrattile.
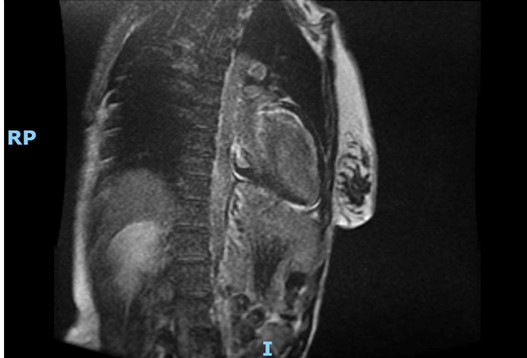
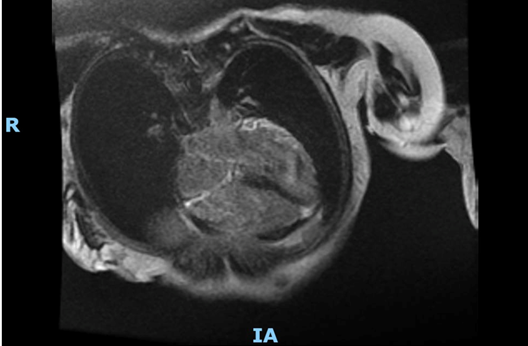
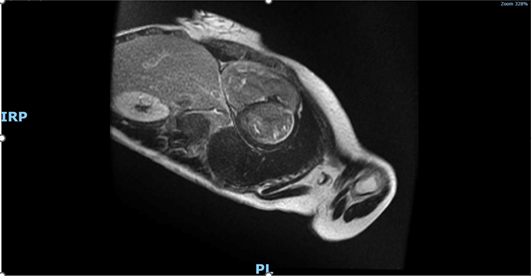
Data l’incidenza in corso di sclerosi sistemica di processi infiammatori coinvolgenti il miocardio, è stata eseguita una RM cardiaca al fine di differenziare un eventuale pattern ischemico da uno miocarditico/infiammatorio.
L’esito della RM cardiaca ha mostrato un ventricolo sinistro con volume telesistolico aumentato e frazione di eiezione ridotta (FE 42%). Ipocinesia della parete antero-settale e anteriore dei segmenti medio-basali. Non sono state evidenziate aree di edema miocardico nelle sequenze T2 pesate. Nelle immagini tardive dopo mdc è stata segnalata la presenza di LGE sub-endocardico della parete anteriore e setto anteriore nei segmenti basali e della parete laterale nei segmenti medio-basale. Presente LGE anche nei muscoli papillari.
Il ventricolo destro presenta volumetrie sisto-diastoliche aumentate, con funzione globale depressa (frazione di eiezione 24 %). Ipocinesia della parete libera nel III medio prossimale. Presenza focale di LGE della parete libera più prossimale alla base.
Dato il riscontro di un pattern ischemico con esteso coinvolgimento del microcircolo coronarico, è stata proposta, al fine di un ulteriore completamento diagnostico, l’esecuzione di una coronarografia e concomitante studio del microcircolo che tuttavia la paziente ha rifiutato.
Alla dimissione, discusso il caso con i colleghi Reumatologi, è stata introdotta una terapia antiaggregante.
BIBLIOGRAFIA
- J.E. Pope, C.P. Denton, S.R. Johnson et al. State-of-the-art evidence in the treatment of systemic sclerosis. Nat Rev Rheumatol. 2023; 19(4): 212–226.
- C- Bruni, L. Ross. Cardiac involvement in systemic sclerosis: Getting to the heart of the matter. Best Pract Res Clin Rheumatol. 2021 Sep;35(3):101668
- L.Nie, X. Wang, T.Zhang et al. Cardiac complications in systemic sclerosis: early diagnosis and treatment. Chin Med J (Engl). 2019 Dec 5; 132(23): 2865–2871
- A. Kruszec, P. Kotyla. Heart involvement in systemic sclerosis. Pol Merkur Lekarski 2016 Sep 29;41(243):156-159.
Peak strain dispersion nel pacing della branca sinistra: case report
Alessandra Nocilla (1), Giuseppe Caliendo (1), Emanuele Nigro (1), Gennaro Vitulano (2), Rodolfo Citro (2), Cristina Esposito (2), Angelo Giano (1), Antonella Rispoli (1), Michele Manzo (2), Carmine Vecchione (1), Gennaro Galasso (1)
1. Azienda ospedaliero Universitaria San Giovanni di Dio Ruggi d’Aragona, Scuola Medica Salernitana, Università di Salerno, Sezione di Cardiologia
2. Azienda ospedaliero Universitaria San Giovanni di Dio Ruggi d’Aragona, Sezione di Cardiologia
ABSTRACT
La stimolazione selettiva della branca sinistra è un nuovo metodo di pacing che prevede il collocamento di un elettrocatetere nell’area della branca sinistra, che risolve buona parte dei problemi correlati alla stimolazione hissiana (1,2). Presentiamo il caso di un paziente di 82 anni con malattia del nodo del seno e blocco di branca sinistra (BBsn), sottoposto ad impianto di pacemaker bicamerale con stimolazione selettiva di branca sinistra. Dopo l’impianto si è evidenziato un netto accorciamento della durata del QRS (da 166 msec a 126 msec) nonché, a livello ecocardiografico, un accorciamento della Peak Strain Dispersion (PSD) da 69 msec a 49 msec, indice di una migliore sincronia della contrazione miocardica.
CASO CLINICO
Paziente di 82 anni giungeva presso il nostro Pronto Soccorso in seguito ad insorgenza improvvisa di dispnea NYHA III. In anamnesi presentava storia di ipertensione arteriosa, diabete mellito di tipo II insulino-dipendente e anemia multifattoriale. L’elettrocardiogramma evidenziava ritmo idioventricolare di scappamento a frequenza ventricolare media di 30 bpm. Gli esami ematochimici mostravano iperkaliemia (K+ 6.8 mEq/L) ed iposodiemia (118 mEq/L) con rialzo dei valori di creatinina (1.5 mg/dl) oltre che un quadro di anemia (Hb 8.7 g/dl).
Si disponeva pertanto per il ricovero presso il reparto di Cardiologia per il proseguimento dell’iter diagnostico-terapeutico. Inizialmente è stata effettuata la correzione delle disionie a seguito delle quali non si riscontrava una risoluzione delle anomalie elettriche del paziente. Veniva pertanto iniziata terapia con isoprenalina in infusione continua a seguito della quale si evidenziava all’ECG di superficie la comparsa di ritmo sinusale a frequenza cardiaca di 58 bpm con BBsn (QRS della durata di 166 msec) e frequente extrasistolia sopraventricolare. A completamento diagnostico, il paziente veniva sottoposto ad esame ecocardiografico con evidenza di funzione contrattile globale conservata (frazione d’eiezione 57%), marcata dissincronia del setto interventricolare (SIV), lieve ipertrofia parietale concentrica, sezioni destre nei limiti per dimensioni e cinesi con segni indiretti di ipertensione sistolica polmonare (PAPs 50 mmHg).
Il paziente veniva inoltre sottoposto a monitoraggio Holter ECG delle 24 ore, da cui si documentava un quadro di malattia del nodo del seno, per cui veniva posta indicazione ad impianto di pacemaker bicamerale. Data la presenza di BBsn con importante dissincronia del SIV e possibile elevata stimolazione ventricolare destra si optava per l’esecuzione di una stimolazione del sistema di conduzione tramite impianto di elettrocatetere sulla branca sinistra.
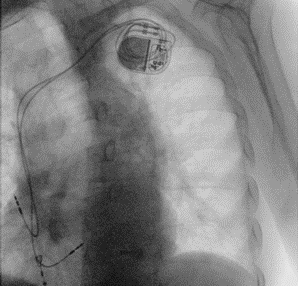
La procedura decorreva senza complicanze intra-procedurali con buona tolleranza da parte del paziente.
Successivamente, per la valutazione di adeguata stimolazione e posizionamento degli elettrocateteri sono stati misurati i seguenti parametri:
- Elettrocatetere atriale destro: impedenza di stimolazione 526 Ohm; onda P 2 mV; soglia di stimolazione 0.8 V x 0.4 msec di durata dell’impulso;
- Elettrocatetere ventricolare con stimolazione di branca: impedenza di stimolazione 487 Ohm; onda R 14 mV; soglia di stimolazione 0.6 V x 0.4 msec di durata dell’impulso.
Al controllo radiografico post-impianto si confermava l’assenza di complicanze pleuro-parenchimali acute con elettrocateteri normoposizionati (Figura 1).
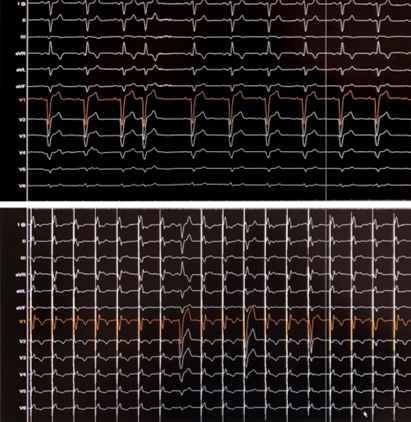
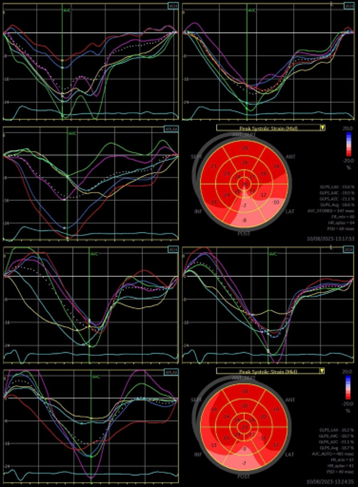
L’’ECG post-impianto mostrava ritmo da pacemaker (atrio guidato-ventricolo stimolato) con QRS della durata di 126 msec (Figura 2). Al controllo ecocardiografico, si evidenziava la presenza di funzione contrattile globale e segmentaria conservata con netto miglioramento della sincronia intraventricolare sinistra. A sostegno di ciò ci si è affidati in post-processing alla tecnica di ecocardiografia avanzata del global longitudinal strain, con evidenza di un accorciamento del PSD da 69 msec a 49 msec (Figura 3). Si è inoltre osservato un miglioramento della gittata cardiaca: sfruttando l’equazione di continuità si è infatti posto a confronto lo stroke volume pre-impianto (60 ml/min) e quello post-stimolazione di branca sinistra (80 ml/min).
DISCUSSIONE
La stimolazione di branca sinistra è una novità relativamente recente nel mondo della cardiostimolazione e prevede il collocamento di un elettrocatetere nell’area della branca sinistra. Nell’ambito della stimolazione del sistema di conduzione (CSP), i vantaggi rispetto alla stimolazione hissiana sono molteplici: l’area target è più ampia, le soglie sono più basse e stabili nel tempo e si riduce il rischio di oversensing atriale (1). Ad oggi, le linee guida europee si limitano a considerare l’utilizzo della stimolazione selettiva di branca sinistra nel caso in cui l’anatomia cardiaca del paziente non consenta l’impianto di un sistema di stimolazione cardiaca biventricolare o in caso in di failure del pacemaker/defibrillatore biventricolare a causa di dislocazione/malfunzionamento (2). Le linee guida americane, invece, prendono in considerazione l’impiego di questa tecnica come alternativa al pacemaker/defibrillatore biventricolare o ancora nei casi in cui, come in questo caso clinico, a dispetto di una conservata funzione contrattile globale ventricolare sinistra (LVEF > 50%), si prospetti una stimolazione ventricolare prolungata (3,4).
Da un punto di vista ecocardiografico, per valutare l’efficacia della tecnica di CSP ci siamo affidati al GLS, metodica che analizza il movimento meccanico di 17 segmenti del miocardio nel ventricolo sinistro (5). In particolare, ci siamo concentrati sull’indice PSD che rappresenta la deviazione standard del tempo al picco di deformazione longitudinale per ciascun segmento del ventricolo sinistro durante la sistole (6). Un accorciamento significativo di questo valore, come dimostrato dalla maggiore sovrapposizione dei picchi delle curve del GLS nella Figura 3, indica una migliore sincronizzazione nella contrazione ventricolare (7, 8).
CONCLUSIONI
Questo caso clinico evidenzia come la stimolazione selettiva della branca sinistra possa determinare un significativo accorciamento del QRS, che a livello ecocardiografico ha comportato un miglioramento della sincronia di contrazione miocardica ed un aumento della gittata cardiaca. La stimolazione di branca garantisce un pacing più fisiologico e una maggiore sincronia cardiaca (9,10). In questo report abbiamo mostrato come la tecnica della stimolazione selettiva della branca sinistra costituisca potenzialmente una valida alternativa all’impianto di pacemaker/defibrillatore biventricolare, con il vantaggio di avere una vasta area target d’impianto e la necessità di stimolazione con basse soglie migliorando la performance cardiaca. Data la carenza dei dati in letteratura, sono necessari studi di larga scala che permettano di poter identificare correttamente i pazienti da candidare a questa tecnica.
BIBLIOGRAFIA
- Jastrzębski M, Kiełbasa G, Cano O et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J. 2022 Oct 21;43(40):4161-4173.
- Michael Glikson, Jens Cosedis Nielsen, Mads Brix Kronborg et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA) European Heart Journal, Volume 42, Issue 35, 14 September 2021, Pages 3427–3520.
- Kusumoto FM, Schoenfeld MH, Barrett C et al. 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines, and the Heart Rhythm Society. J Am Coll Cardiol. 2019 Aug 20;74(7):932-987.
- Chung MK, Patton KK, Lau CP et al. 2023 HRS/APHRS/LAHRS guideline on cardiac physiologic pacing for the avoidance and mitigation of heart failure. Heart Rhythm. 2023 Sep;20(9):e17-e91.
- Lang RM, Badano LP, Mor-Avi V et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 233–270.
- Voigt JU, Pedrizzetti G, Lysyansky P e al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 1–11
- Li, C., Yuan, M., Li, K. et al. Value of peak strain dispersion in discovering left ventricular dysfunction in diabetes mellitus. Sci Rep 10, 21437 (2020).
- Erika, N. A. et al. Left ventricular mechanical dispersion in a general population: data from the Akershus Cardiac Examination 1950 study. Eur. Heart J. Cardiovasc. Imaging. 21, 183–190 (2020).
- Wang Y, Zhu H, Hou X, et al. LBBP-RESYNC Investigators. Randomized Trial of Left Bundle Branch vs Biventricular Pacing for Cardiac Resynchronization Therapy. J Am Coll Cardiol. 2022 Sep 27;80(13):1205-1216.
- Mornos, C. et al. Risk stratification in patients with heart failure: the value of considering both global longitudinal left ventricular strain and mechanical dispersion. Can. J Physiol. Pharmacol. 95, 1360–1368 (2017).
Ablazione bipolare di una tachicardia atriale proveniente dal setto interatriale
Vincenzo Mirco La Fazia, MD1-2, Nicola Pierucci, MD2-3, Giacomo Bonacchi, MD1, Saverio Muscoli, MD1
1 Division of Cardiology, University Hospital “Tor Vergata”, 00133 Rome, Italy
2 Texas Cardiac Arrhythmia Institute, St David’s Medical Center, Austin, Texas, USA
3 Division of Cardiology, University Hospital “Umberto I”, Rome, Italy
ABSTRACT
Paziente maschiodi 70 anni con fibrillazione atriale (FA) ricorrente arriva per ablazione transcatetere con radiofrequenza dopo tre precedenti ablazioni non riuscite. Nonostante fossero state ablate i tipici trigger della FA, l’aritmia persisteva, portando all’identificazione del setto interatriale (IAS) come probabile causa della tachicardia. Data la profondità e lo spessore dell’IAS, l’ablazione tradizionale con radiofrequenza si è rivelata inefficace. Tuttavia, utilizzando la tecnica alternativa di erogare energia in modalità bipolare (B-RFCA), la tachicardia atriale è stata terminata con successo. La B-RFCA si dimostra un potenziale nell’interrompere efficacemente le tachicardie derivanti da localizzazioni intramurali profonde, suggerendo il suo potenziale come tecnica fondamentale per casi complessi come la tachicardia atriale settale.
CASO CLINICO
Un paziente maschio di 70 anni con fibrillazione atriale (FA) persistente si è presentato per ablazione transcatetere dopo recidiva nonostante precedenti ablazioni.
Tramite accesso giugulare è stato posizionato un catetere lineare a 20 poli con elettrodi che dalla SVC e alla crista terminalis (CT) al seno coronarico (CS). L’ecocardiografia intracardiaca (ICE) è stata posizionata nell’atrio destro come aiuto per la puntura transettale. Un catetere mappante circolare (Lasso 20 mm/10 elettrodi) e un catetere per ablazione (QDOT MICROTM) sono stati avanzati nell’atrio sinistro.
Durante il mappaggio, è stato osservato che tutte le PV erano silenti dalle precedenti ablazioni. Nonostante l’isolamento del PW atriale sinistro, SVC, CS e LAA, il paziente è rimasto in AF.
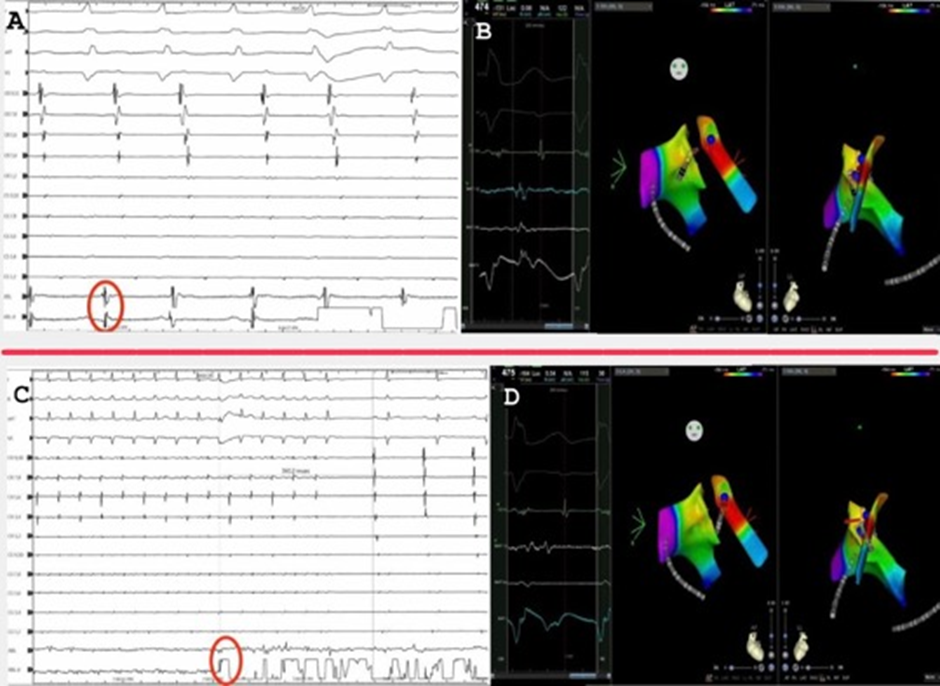
A: Elettrogrammi intracardici prima della prima terminazione sul lato destro dell’IAS.
Il cerchio rosso indica il potenziale più precoce registrato dal catetere ablatore.
B: Mappa di voltaggio CARTO-3D che mostra potenziali precoci (-151 msec) e il corrispondente elettrogramma sharp (near-field) sul lato destro dell’IAS precedenti alla prima terminazione in visione anteroposteriore e laterale sinistra.
C: Elettrogrammi intracardici della seconda terminazione sul lato sinistro dell’IAS. il tempo necessario dall’inizio dell’ablazione alla temppranea ristorazione del ritmo sinusale è stato 3412 msec.
Il cerchio rosso indica il potenziale più precoce registrato dal catetere ablatore e l’inizio dell’ablazione.
D: Mappa di voltaggio CARTO-3D che mostra potenziali precoci (-164 msec) e il corrispondente elettrogramma far-field) sul lato sinistro dell’IAS precedenti alla seconda terminazione in visione anteroposteriore e laterale sinistra.
I cateteri per identificare eventuali trigger extrapolmonari sono stati posizionati per identificare trigger extrapolmonari: il Lasso nella PV superiore sinistra per registrare il far-field proveniente dall’ LAA, il QDOT nella PV superiore destra per registrare il far-field dall’ IAS e fisso, il duodecapolare con gli elettrodi che vanno dalla SVC al CS. Con questa configurazione, quando si osserva un’attività atriale ectopica focale, la sua sequenza di attivazione viene confrontata con quella del ritmo sinusale, portando così all’identificazione della sua area di origine.4 L’onda P è usata come riferimento per identificare il sito di attivazione più precoce in correlazione agli elettrogrammi locali.
È stata eseguita cardioversione elettrica esterna con ripristino del ritmo sinusale e un successivo test di provocazione farmacologica con infusione di isoproterenolo ad alte dosi (20 μg/min) per identificare i trigger extrapolmonari.
Poco dopo, è stata indotta una AT con cycle lenght (CL) di 250 msec.
Sono stata registrate un’attivazione sincrona in entrambi i segmenti CT e CS del duodecapolare e un’attività atriale far-field più precoce sul QDOT, suggerendo così l’origine dall’IAS.
L’ablazione con radiofrequenza è stata eseguita lungo il setto atriale sinistro, con conseguente terminazione dell’AT.
Poche ore dopo l’ablazione, il paziente ha avuto una recidiva di AT sintomatica ed è stato quindi sottoposto a nuova procedura di ablazione di AT il giorno seguente.
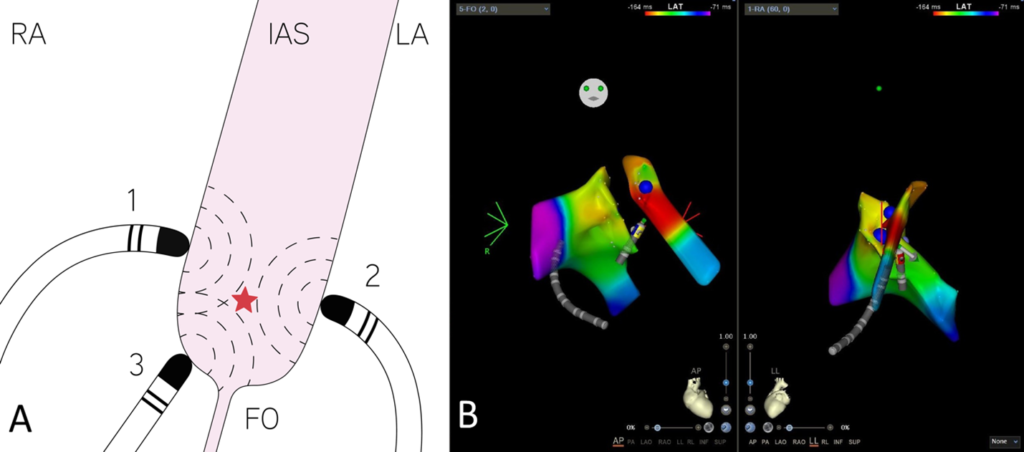
A: Disegno digitale che mostra: il primo punto di terminazione sul lato destro dell’IAS (1), il secondo punto di terminazione sul lato sinkstro dell’IAS (2), il terzo punto di terminazione a livello della fossa ovale (3) e la potenziale posizione intramurale del focus della AT all’interno dell’IAS (stella rossa).
B: Mappa CARTO-3D che mostra i tre punti di terminazione (sfere blu) in visione anteroposterioere e laterale sinistra.
Il paziente arrivava nel laboratorio di elettrofisiologia in AT.
La registrazione degli elettrogrammi e la mappa di attivazione hanno suggerito la stessa origine dall’ IAS della procedura precedente.
Potenziali precoci sono stati registrati dal catetere di ablazione posizionato sul lato destro dell’IAS. (Figura 1A-1B) Il QDOT è stato quindi avanzato nell’atrio sinistro.
Potenziali più precoci sono stati ablati lungo il setto atriale sinistro con breve terminazione dell’AT. (Figura 1C-1D)
Potenziali precoci sono stati quindi mappati e ablati nuovamente dall’atrio destro a livello della fossa ovale, portando a un’ulteriore temporanea cessazione dell’AT. (Figura 2)
Considerando l’ampio spessore del setto evidenziato dal catetere ICE e l’ablazione prolungata richiesta da entrambi i lati del setto, è stata presa la decisione di ablare con un approccio bipolare per creare una lesione transmurale profonda nella IAS.
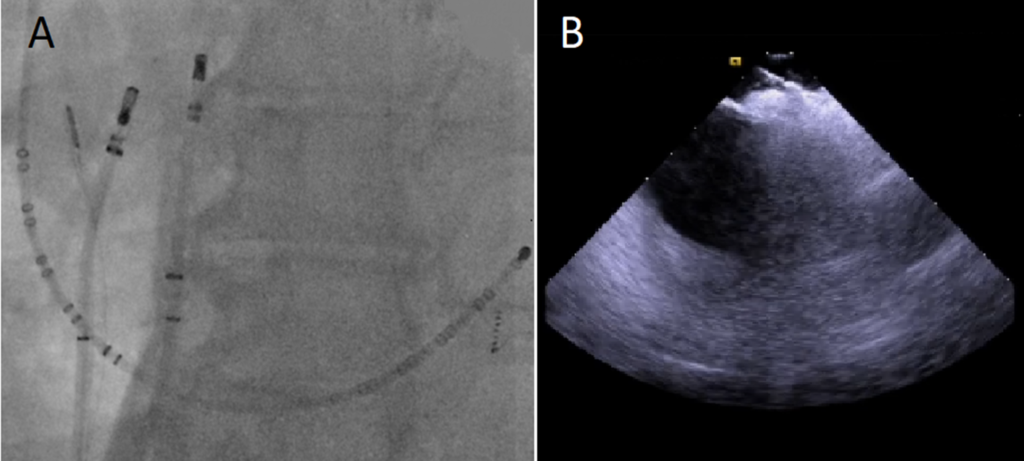
A: Immagine fluoroscopica anteroposteriore che mostra i due cateteri ai due lati dell’IAS durante il rilascio di energia a radiofrequenza bipolare. Uno dei due cateteri SF-J è nell’atrio sinistro, l’altro è nell’atrio destro insieme alla sonda ICE.
B: Immagine ecocardiografica intracardiaca che mostra il catetere SF-J in contatto con il lato destro dell’IAS e l’altro catetere SF-J alla stessa altezza dall’altro lato del setto. In questa immagine si può notare il notevole spessore dell’IAS.
Un ulteriore catetere ablatore Thermocool SF-J è stato posizionato lungo il setto atriale destro, alla stessa altezza del punto di terminazione della tachicardia nel setto atriale sinistro, e l’energia a radiofrequenza è stata erogata dal catetere posizionato nell’atrio sinistro a quello nell’atrio destro. (Figura 3)
L’erogazione di energia bipolare è durata 62s con un aumento progressivo della potenza da 20W a 35W, una temperatura media di 25oC (max 32oC) e un’impedenza media di 142 W (max 171W) e ha portato alla definitiva terminazione della AT.
Dopo un periodo di attesa di 20 minuti, la tachicardia non è stata più osservata.
Durante il follow-up, il paziente è rimasto in ritmo sinusale con sospensione di farmaci antiaritmici.
DISCUSSIONE
La ricorrenza di AT può derivare dalla presenza di substrati aritmogeni atriali residui dopo l’ablazione della AF.1 Le AT da macrorientro settale possono essere relativamente resistenti all’ablazione con catetere e tendono a recidivare durante il follow-up1, a causa della loro posizione intramurale profonda e della difficoltà di ottenere un buon contatto e una buona stabilità del catetere di ablazione sul lato sinistro della IAS.2-3
Nel nostro caso, il focolaio di AT risultava all’interno dell’IAS e sia lo spessore del setto che l’ablazione prolungata necessaria per la terminazione suggerivano una localizzazione intramurale profonda. La difficoltà di ottenere un’ablazione efficace utilizzando un’energia unipolare ha portato alla decisione di optare per un approccio bipolare.
Con la B-RFCA la corrente a radiofrequenza scorre tra gli elettrodi distali di 2 cateteri ablatori situati ai lati opposti del substrato bersaglio, invece di raggiungere l’elettrodo indifferente posto sulla superficie del paziente.
La B-RFCA si è dimostrata molto efficace nel creare lesioni più grandi e nel migliorare la transmuralità delle lesioni4-5, aumentando così le possibilità di successo nell’ablazione di circuiti intramurali profondi, considerando che è stato dimostrato che l’incapacità di creare lesioni transmurali è una causa di fallimento dell’ablazione.6
Il miglioramento della transmuralità della lesione può essere attribuito a diversi meccanismi, come la sinergia termica tra gli elettrodi dei cateteri dovuta al riscaldamento simultaneo, una maggiore densità di corrente che determina una lesione termica concentrata e una maggiore efficacia dell’ablazione.4
CONCLUSIONI
L’ablazione di una tachicardia atriale derivante dal setto può essere difficoltosa a causa della localizzazione intramurale profonda. Questo caso vuole evidenziare la sicurezza e l’efficacia dell’ablazione con radiofrequenza bipolare per interrompere una AT focale settale verificatasi in un paziente con precedenti ablazioni di AF.
BIBLIOGRAFIA
- Chae S, Oral H, Good E, et al. Atrial Tachycardia After Circumferential Pulmonary Vein Ablation of Atrial Fibrillation. J Am Coll Cardiol. 2007;50(18):1781-1787.
- Leonelli F, Bagliani G, Boriani G, Padeletti L. Arrhythmias Originating in the Atria. Card Electrophysiol Clin. 2017;9(3):383-409.
- Heck PM, Rosso R, Kistler PM. The Challenging Face of Focal Atrial Tachycardia in the Post AF Ablation Era. J Cardiovasc Electrophysiol. 2011;22(7):832-838.
- Koruth JS, Dukkipati S, Miller MA, Neuzil P, d’Avila A, Reddy VY. Bipolar irrigated radiofrequency ablation: A therapeutic option for refractory intramural atrial and ventricular tachycardia circuits. Heart Rhythm. 2012;9(12):1932-1941.
- Sivagangabalan G, Barry MA, Huang K, et al. Bipolar Ablation of the Interventricular Septum is More Efficient at Creating a Transmural Line than Sequential Unipolar Ablation. Pacing Clin Electrophysiol. 2010;33(1):16-26.
- Melby SJ, Lee AM, Zierer A, et al. Atrial fibrillation propagates through gaps in ablation lines: Implications for ablative treatment of atrial fibrillation. Heart Rhythm. 2008;5(9):1296-1301.
Il ritorno venoso anomalo parziale delle vene polmonari: gestione di una serendipity
Enrico Maggioa, Jean Pierre Jabboura, Gianmarco Scocciaa, Roberto Badagliaccaa
aDipartimento di Scienze Cliniche Internistiche, Anestesiologiche e Cardiovascolari, Università La Sapienza di Roma
BACKGROUND
Le connessioni venose polmonari anomale totali (TAPVC) e parziali (PAPVC) rappresentano anomalie rare caratterizzate da una connessione anomala di alcune (PAPVC) o di tutte (TAPVC) le vene polmonari che, anziché drenare nell’atrio sinistro, drenano direttamente o meno nell’atrio destro. [1, 2] La PAPVC può essere distinta in tipo unilaterale a ramo singolo, tipo unilaterale a 2 rami e tipo bilaterale a ramo singolo, [3] ed il tipo più comune è rappresentato da una vena polmonare anomala del lobo superiore destro che drena nella vena cava superiore o nell’atrio destro, [4] con uno shunt da sinistra a destra.
CASO CLINICO
Paziente di 75 anni ricoverato presso il nostro centro di riferimento per l’ipertensione arteriosa polmonare (IAP), per sospetta IAP all’ecocardiogramma eseguito presso un’altra sede. All’ecocardiogramma transtoracico (ETT) veniva riscontrata una dilatazione delle sezioni cardiache destre e una insufficienza tricuspidalica di grado moderato-severo da dilatazione dell’annulus valvolare (gradiente trans-tricuspidalico 41 mmHg, vena cava inferiore dilatata ed ipocollassabile, PAPs 61mmHg) con buona la funzione sistolica del ventricolo destro (VD) (TAPSE 30mm, S’ 13cm/s). Veniva pertanto programmato un cateterismo cardiaco destro ed il work up diagnostico dell’ipertensione polmonare.
Nell’anamnesi del paziente risultavano salienti una cardiopatia ischemico-ipertensiva cronica trattata mediante angioplastica percutanea e impianto di uno stent a livello dell’arteria discendente anteriore e uno a livello del primo ramo diagonale nel 2017, gammopatia monoclonale di significato incerto, pregressa infezione da HBV ed un disturbo dell’eloquio in follow-up neurologico. All’esame obiettivo l’unico riscontro degno di nota era rappresentato da un soffio III/VI Levine meglio udibile sul focolaio tricuspidalico. L’ECG mostrava un blocco di branca destro incompleto.
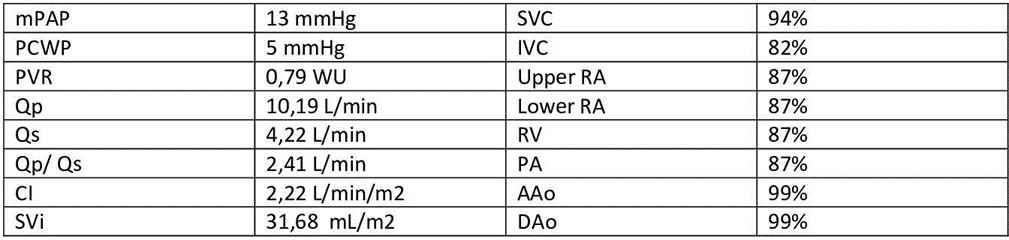
Il cateterismo del cuore destro escludeva un quadro d’ipertensione polmonare (PAPm 13mmHg, PAPs 26mmHg, PVR <2WU) ma alla valutazione ossimetrica metteva in evidenza un sospetto di shunt sinistro-destro (Fig. 1). In considerazione di tale riscontro, l’iter diagnostico proseguiva con l’esecuzione di un ecocardiogramma trans-esofageo (ETE) che escludeva la presenza di difetti intracardiaci del setto interatriale (SIA) e del setto interventricolare (SIV) (Fig. 2), ma in cui non risultava visibile lo sbocco della vena polmonare superiore sinistra e della vena polmonare superiore destra nell’atrio sinistro. In considerazione di tale quadro ecocardiografico non era possibile escludere la presenza di un ritorno venoso anomalo delle vene polmonari. Gli elevati livelli ossimetrici riscontrati in vena cava superiore (VCS) ponevano l’ipotesi di uno shunt localizzato a monte dell’atrio destro, in virtù del quale si decideva di proseguire l’iter con l’esecuzione di un’angioTC del torace.
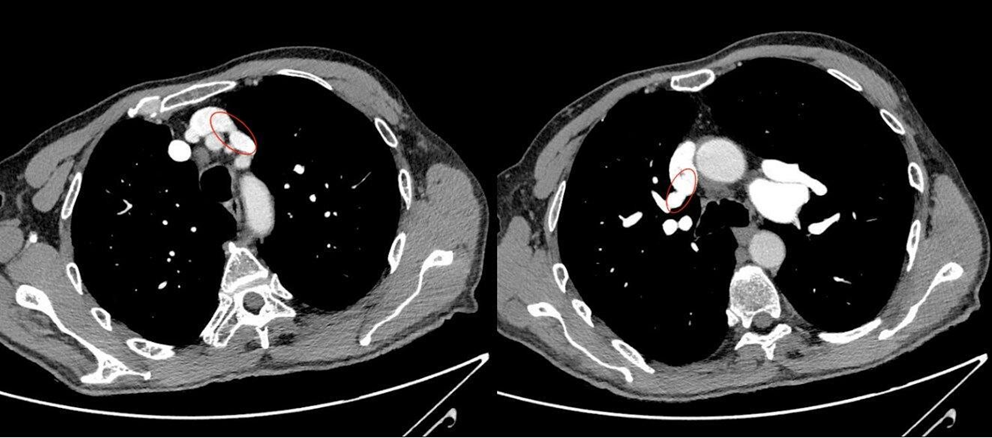
Tale indagine strumentale documentava un anomalo drenaggio della vena polmonare superiore di sinistra nella vena brachiocefalica sinistra, e della vena polmonare superiore destra nella vena cava superiore (Fig. 3). Inoltre, una scintigrafia polmonare perfusionale svolta per escludere possibili forme di pregresse embolie polmonari (e valutare quindi il carico di morbidità) evidenziava un’ ipoperfusione a carico dei versanti mediali dei segmenti antero-basale e postero-basale del lobo inferiore destro ed un’ ipoperfusione del segmento apicale del lobo superiore sinistro con presenza di deficit a carattere cuneiforme localizzato a livello del segmento anteriore. Per una corretta valutazione dell’impatto emodinamico di tale shunt sulla capacità funzionale e per escludere un’ipertensione polmonare indotta da sforzo, si sottoponeva il paziente a test cardiopolmonare. A tale prova, il paziente mostrava un’ottima capacità d’esercizio (VO2 picco pari al 100% del predetto 24 ml/min/kg per un quoziente respiratorio pari a 1,12) una normale soglia anaerobica raggiunta al 50% del VO2 max predetto, un polso dell’ossigeno sempre crescente pari al 117% del predetto, una normale efficienza di lavoro aerobico (VO2/WR pari a 10 ml/min/Watt) e l’assenza di segni di barrage polmonare (VE/VCO2 slope pari a 29). Nonostante il Qp/Qs > 1,5 e le PVR < 5 WU, in considerazione dell’età del paziente e dell’ottima capacità funzionale mostrata al test cardiopolmonare l’Heart Team del nostro ospedale decideva di non procedere con la correzione chirurgica del difetto, anche in virtù dell’elevata complessità tecnica e dei rischi perioperatori.
CONCLUSIONE
In conclusione, è importante ricordare che anche in presenza di segni ecocardiografici d’ ipertensione polmonare, essa può non essere presente, e che non sempre il valore di PAPs riscontrato all’ecocardiogramma risulta concordante con quello registrato dalle metodiche invasive (per possibile sotto-/sovrastima sia all’ecografia, in virtù dell’allineamento al flusso e delle caratteristiche del rigurgito e dell’anatomia, sia al cateterismo destro, in virtù di possibili errori di calibrazione). È infine importante tenere a mente che i difetti congeniti non sempre vengono diagnosticati in età giovanile (specialmente se asintomatici) e, quindi, non è da escludere a priori la loro presenza nel paziente geriatrico. Un’ attenta interpretazione dei valori ossimetrici riscontrati durante il cateterismo destro può rilevare una cardiopatia congenita non identificabile mediante le metodiche diagnostiche di I livello.
BIBLIOGRAFIA
- Tarniceriu, C.C., et al., The Pulmonary Venous Return from Normal to Pathological-Clinical Correlations and Review of Literature. Medicina (Kaunas), 2021. 57(3).
- Paladini, D., et al., Prenatal diagnosis of total and partial anomalous pulmonary venous connection: multicenter cohort study and meta-analysis. Ultrasound Obstet Gynecol, 2018. 52(1): p. 24-34.
- Abdel Razek, A.A.K., et al., Computed Tomography Angiography and Magnetic Resonance Angiography of Congenital Anomalies of Pulmonary Veins. J Comput Assist Tomogr, 2019. 43(3): p. 399-405.
- Türkvatan, A., et al., Multidetector Computed Tomographic Angiography Imaging of Congenital Pulmonary Venous Anomalies: A Pictorial Review. Can Assoc Radiol J, 2017. 68(1): p. 66-76.
- Fragata, J., et al., Partial anomalous pulmonary venous connections: surgical management. World J Pediatr Congenit Heart Surg, 2013. 4(1): p. 44-9.
Cardiomiopatia infiammatoria cronica: dalla presentazione clinica all’interpretazione della risonanza magnetica e della biopsia cardiaca
Elisa Cesarano, Maria Luisa Carbone, Emanuela Frau, Edoardo Carugi, Bianca Noli, Luca Fazzini, Enrico Mulargia, Roberta Montisci
Clinical Cardiology Unit, University Hospital of Cagliari, Italy
ABSTRACT
La cardiomiopatia infiammatoria cronica è una condizione di persistente infiammazione miocardica che esita in una disfunzione ventricolare. La diagnosi definitiva rappresenta ancora oggi una sfida, considerate l’assenza di segni e sintomi patognomonici.
La risonanza magnetica cardiaca e la biopsia endomiocardica sono esami diagnostici essenziali per giungere ad una diagnosi corretta. Talora l’interpretazione non è univoca, soprattutto nei casi di presentazione clinica tardiva. È questo il caso della nostra paziente, presentatasi in Pronto Soccorso con un quadro di shock cardiogeno conclamato.
CASO CLINICO
Una paziente di 57 anni affetta da sindrome di Kartagener, situs viscerum inversus, ipertensione arteriosa e storia di tachicardia parossistica sopraventricolare, accedeva in Pronto Soccorso per dispnea e plurimi episodi presincopali nelle ultime ore. Lamentava da circa due mesi febbricola, sintomi simil-influenzali, ortopnea, dispnea parossistica notturna e comparsa di edemi declivi.
All’ingresso si presentava marcatamente ipotesa (PA 60/40 mmHg), tachipnoica, lievemente tachicardica e anurica; all’elettrocardiogramma non evidenza di alterazioni suggestive di ischemia. Agli esami ematochimici, modesto rialzo degli indici di flogosi e degli enzimi di miocardiocitolisi ad andamento non fasico, pro-BNP marcatamente elevato (13882 pg/mL) e danno epato-renale. All’emogasanalisi acidosi metabolica con iperlattacidemia (12 mmol/L).
All’ecocardiogramma riscontro di atrio e ventricolo sinistri dilatati con grave disfunzione biventricolare da ipocinesia diffusa (frazione d’eiezione ventricolo sinistro 15%) e insufficienza mitralica funzionale di grado severo. In considerazione del sospetto di miocardite presentatasi con un quadro di shock cardiogeno veniva avviato sostegno al circolo con inotropi (dobutamina 10 mcg/kg/min) e successivo supporto meccanico con posizionamento di contropulsatore aortico (IABP).
La paziente veniva quindi ricoverata presso l’UTIC, vigile, in respiro spontaneo (ossigenoterapia FiO2 40%), con terapia diuretica endovenosa in infusione continua e sostegno al circolo mediante dobutamina ridotta a 7.5 mcg/kg/min e IABP 1:1. Al monitoraggio pressorio PA 125/70 mmHg, SpO2 99%, progressiva ripresa della diuresi. Dopo circa 36 ore veniva svezzata dalla terapia inotropa e da IABP e, una volta superata la fase acuta, si assisteva a miglioramento clinico-laboratoristico con sospensione dell’ossigenoterapia e progressiva titolazione della terapia per lo scompenso, con progressivo miglioramento della funzione sistolica biventricolare.
A completamento diagnostico, veniva eseguita risonanza magnetica cardiaca (CMR) che evidenziava frazione d’eiezione ventricolo sinistro (FEVS) 17% e ventricolo destro 25%; nelle sequenze STIR e per il T2 mapping area di alterato segnale nei segmenti infero-laterale basale e medio da riferire a edema miocardico e, nelle sequenze acquisite tardivamente dopo somministrazione di mezzo di contrasto, area di late gadolinium enhancement (LGE) subepicardico, compatibili con un quadro di miocardite. Si decideva inoltre di indagare il quadro coronarico mediante angio-TC, risultata negativa per lesioni stenosanti.
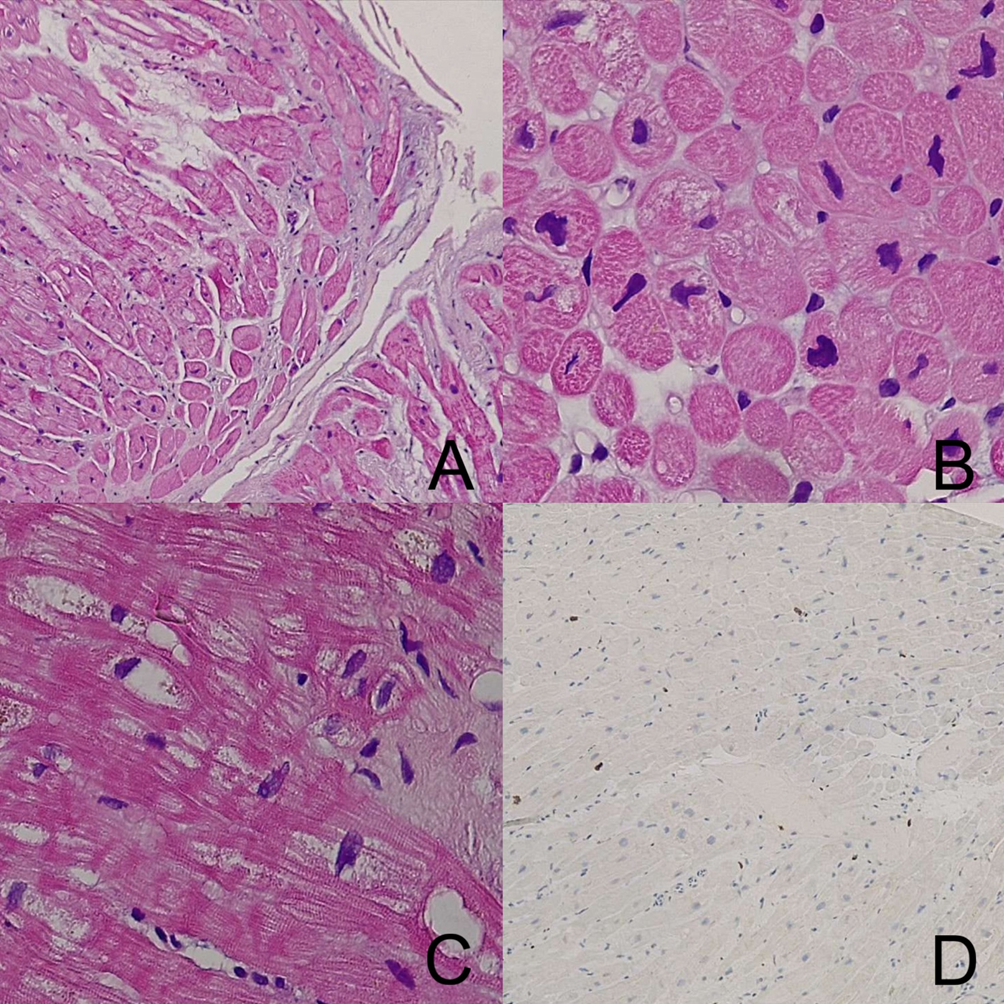
Sette giorni dopo la paziente veniva trasferita presso un altro Presidio per eseguire biopsia endomiocardica: venivano prelevati quattro frammenti caratterizzati da focale edema, lieve ipertrofia nucleare dei cardiomiociti e aspetti di degenerazione sarcoplasmatica con aloni perinucleari e tralci di sostituzione fibrosa, ma solo modesta presenza di infiltrati infiammatori aspecifici per miocardite (Figura 1).
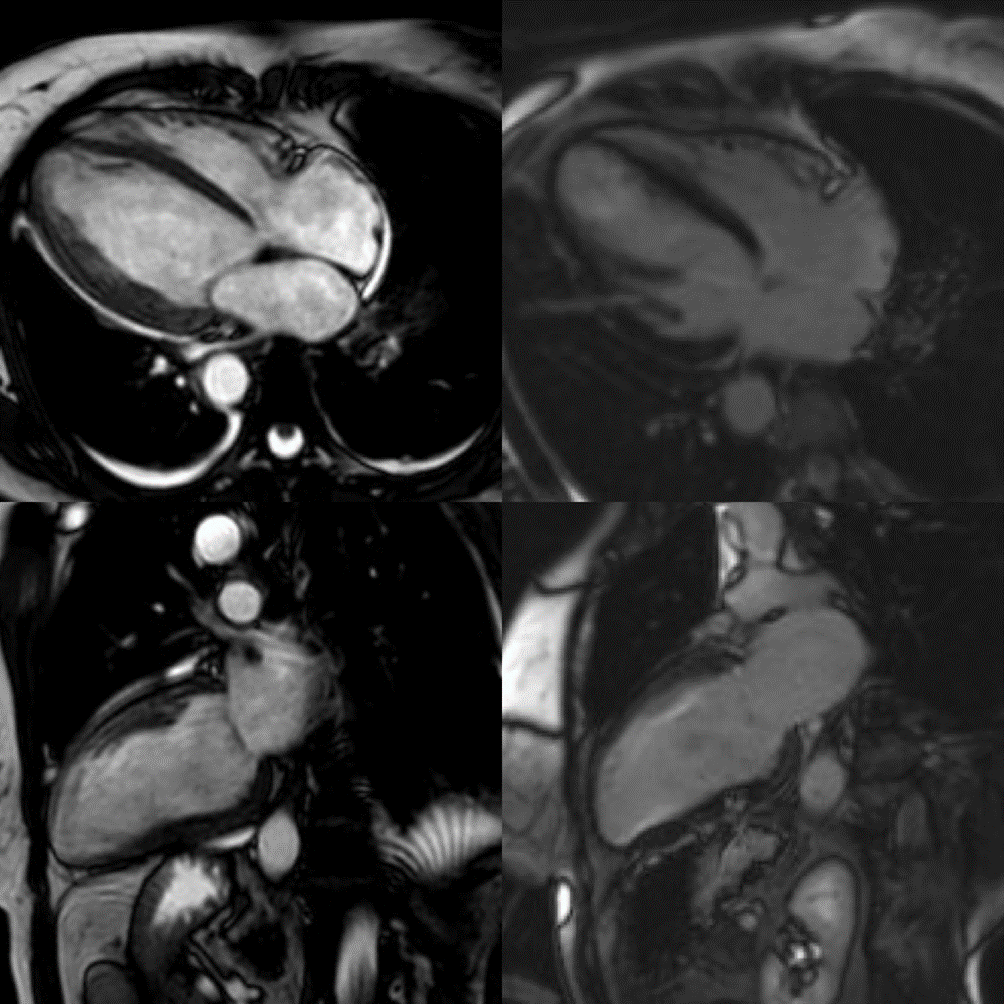
Alla CMR eseguita a un mese dalla dimissione, parziale recupero della funzione biventricolare (FEVS 36%) con risoluzione dell’edema miocardico senza aree di LGE (Figura 2).
DISCUSSIONE
La cardiomiopatia infiammatoria cronica è causata da un persistente stimolo infiammatorio, generalmente associato a un substrato genetico, e può rappresentare l’evoluzione di una miocardite clinicamente diagnosticata o silente. Presenta tipicamente segni e sintomi dell’insufficienza cardiaca fino allo shock cardiogeno, sindrome caratterizzata da una grave compromissione della contrattilità miocardica con riduzione della portata cardiaca, che si può manifestare con diversi fenotipi clinici, la cui diagnosi si basa sul riscontro di ipotensione associata a segni di ipoperfusione periferica.
Il caso presentato è suggestivo di una miocardite subacuta evoluta in cardiomiopatia infiammatoria cronica presentatasi all’esordio come uno shock cardiogeno in bassa portata (SCAI C). A supporto della nostra ipotesi diagnostica vi sono la storia clinica di durata superiore a 30 giorni, la dilatazione delle sezioni sinistre, il minimo incremento della troponina discordante rispetto alla severa disfunzione ventricolare e l’aspecifico infiltrato infiammatorio alla biopsia. Nonostante la presenza di modesta fibrosi all’esame istologico, è peculiare il riscontro di cambiamenti dinamici del LGE alla CMR. Al follow-up, la risoluzione dell’edema è di frequente riscontro, mentre l’estensione del LGE è un processo dinamico principalmente relato all’edema tissutale nella fase acuta che progressivamente si risolve nel tempo, contrariamente al riscontro di LGE al controllo che riflette la sostituzione fibrosa post-infiammatoria [1,2].
Se la miocardite acuta si presenta maggiormente con dolore toracico (“infarct-like”) [3], la cardiomiopatia infiammatoria cronica rientra nello spettro dell’insufficienza cardiaca (“cardiomyopathic”) fino allo shock cardiogeno fenotipicamente sovrapponibile ad uno scenario di “acute decompensated heart failure”. Il repentino ricorso a dispositivi di assistenza meccanica al circolo come il IABP può risultare vincente per interrompere la spirale dello shock cardiogeno migliorando l’accoppiamento ventricolo-arterioso e conseguentemente la performance cardiaca e la perfusione d’organo.
La caratterizzazione eziologica del nostro quadro non può prescindere da una definizione istologica. La biopsia endomiocardica risulta comunque gravata da bassa sensibilità e non si può escludere la difficoltà della metodica di fronte a una destrocardia per cui la sua aspecificità non esclude una malattia infiammatoria del miocardio, soprattutto a distanza di due settimane rispetto all’esordio dei sintomi [4]. Inoltre, nella cardiomiopatia infiammatoria cronica, sia la CMR che la biopsia endomiocardica possono repertare un’infiammazione meno florida rispetto alla gravità della presentazione clinica [1].
Il nostro caso clinico ci ricorda come la prima presentazione di una cardiomiopatia infiammatoria cronica può essere un’urgenza e richiedere immediata assistenza farmacologica e meccanica al circolo. Certamente la CMR e la biopsia endomiocardica rappresentano gli esami diagnostici principali seppur necessitino di una notevole esperienza nell’interpretazione dei risultati, talora non univoci. La determinazione dei fattori responsabili della transizione da miocardite acuta a cardiomiopatia infiammatoria cronica rimane oggetto di studio [1].
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405
- Aquaro GD, Ghebru Habtemicael Y, Camastra G, Monti L, Dellegrottaglie S, Moro C, Lanzillo C, Scatteia A, Di Roma M, Pontone G, Perazzolo Marra M, Barison A, Di Bella G; “Cardiac Magnetic Resonance” Working Group of the Italian Society of Cardiology. Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J Am Coll Cardiol. 2019 Nov 19;74(20):2439-2448. doi: 10.1016/j.jacc.2019.08.1061.
- Francone M, Chimenti C, Galea N, Scopelliti F, Verardo R, Galea R, Carbone I, Catalano C, Fedele F, Frustaci A. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis. JACC Cardiovasc Imaging. 2014 Mar;7(3):254-63. doi: 10.1016/j.jcmg.2013.10.011.
- Basso C. Myocarditis. N Engl J Med. 2022 Oct 20;387(16):1488-1500. doi: 10.1056/NEJMra2114478. PMID: 36260793.




