Verona 2024


Verona 2024
Elena M.S. Jannello1, Gabriele Bertani1, Marco De Stefano1, Anna Carrer1, Giovanni Benfari1, Flavio Luciano Ribichini1 1Dipartimento di Medicina, Sezione di Cardiologia, Università di Verona ABSTRACT Un uomo di 61 anni…
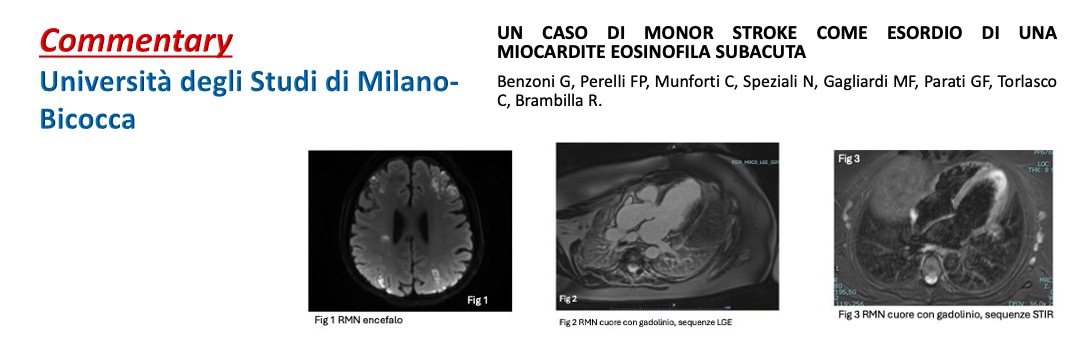
Milano Bicocca 2024
Benzoni G.1, Perelli F.P.1;2, Munforti C.2, Speziali N.1, Gagliardi M.F.1, Parati G.F.1;2, Torlasco C.2, Brambilla R.2 Università degli studi Milano-Bicocca, Scuola di Specializzazione in Malattie dell’Apparato Cardiovascolare;IRCCS Istituto Auxologico Italiano-…
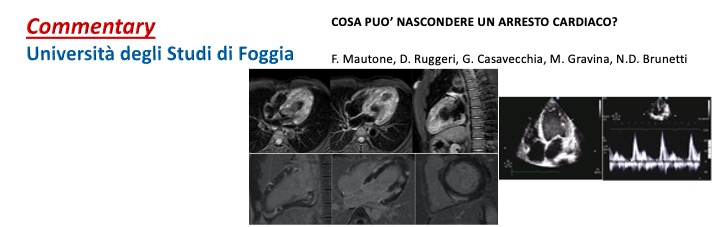
F. Mautone, D. Ruggeri, G. Casavecchia, M. Gravina, N.D. Brunetti Università degli Studi di Foggia S.C. Cardiologia Universitaria-UTIC, Policlinico Riuniti Foggia ABSTRACT. La Miocardite acuta da M. Tuberculosis è una…
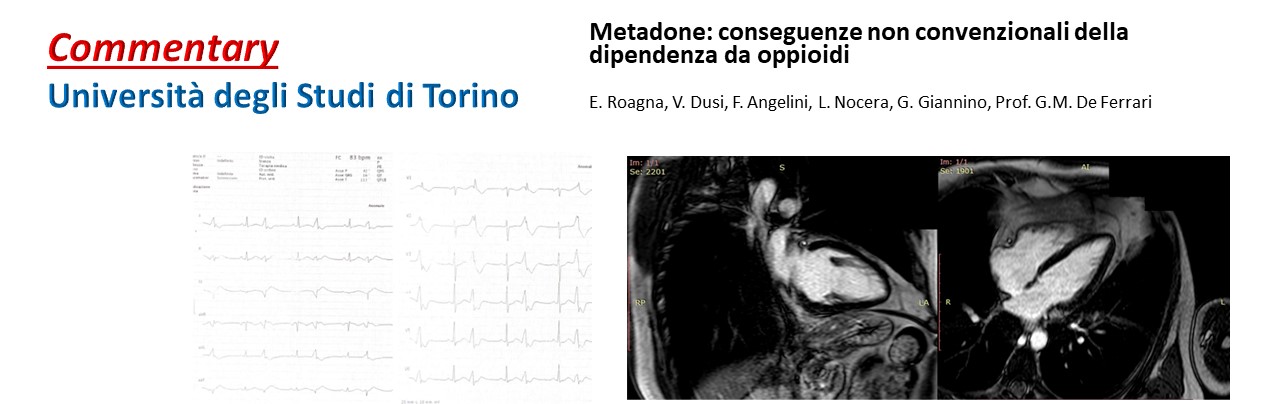
Torino 2023
E. Roagna1; V. Dusi1; F. Angelini1; L. Nocera1; G. Giannino1; Prof. G.M. De Ferrari1 1Division of Cardiology, Cardiovascular and Thoracic Department, "Città della Salute e della Scienza" Hospital, Turin, Italy…
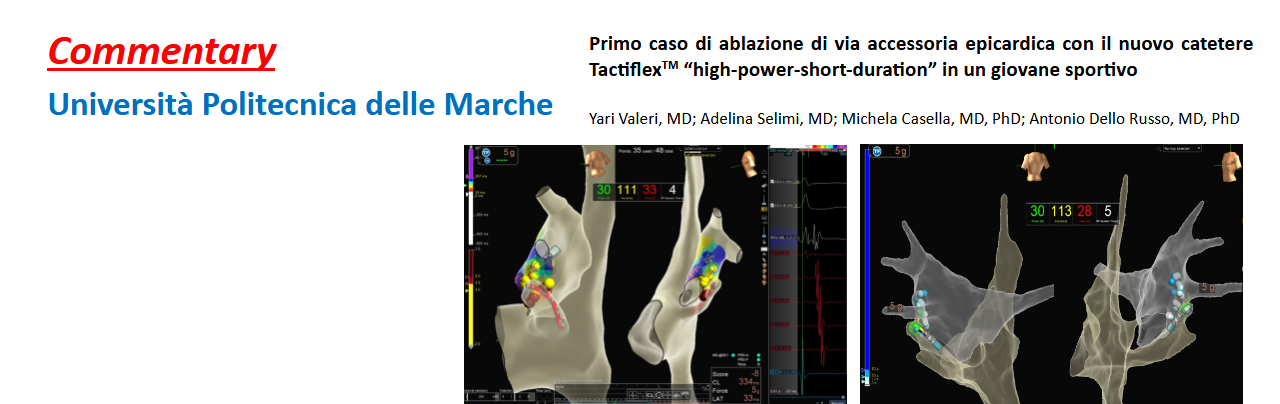
Ancona 2023
Yari Valeri, MD1,2; Adelina Selimi, MD1,2; Michela Casella, MD, PhD1,3; Antonio Dello Russo, MD, PhD1,2 1 Cardiology and Arrhythmology Clinic, University Hospital “Ospedali Riuniti”, Ancona, Italy;2 Department of Biomedical Sciences…