Ventricular ectopy unmasked: ectopia ventricolare maligna da sistema del Purkinje in paziente con Wolff-Parkinson-White
Silvia Grimaldi,1 Mattia Alberti,1 Francesco Gentile1,2
1 Department of Pathology, Cardiology Division, University of Pisa, Pisa, Italy
2 Health Science Interdisciplinary Center, Scuola Superiore Sant’Anna, Pisa, Italy
ABSTRACT
La flecainide è un farmaco antiaritmico di largo impiego nella pratica clinica, nel trattamento e prevenzione delle tachicardie sopraventricolari, come la fibrillazione atriale (FA). Riportiamo il caso di un uomo di 53 anni, sottoposto ad ablazione di fascio accessorio postero-settale destro a seguito di episodio di FA pre-eccitata, candidato a terapia profilattica con flecainide. A distanza di qualche ora dall’assunzione del farmaco, al monitoraggio elettrocardiografico si documentavano extrasistoli ventricolari polimorfe a QRS stretto, precoci e ripetitive. Con la sospensione della flecainide, queste si riducevano fino a scomparire. Nel sospetto di extrasistolia maligna da sistema del Purkinje, veniva eseguito studio elettrofisiologico e test provocativo, con conferma del sospetto clinico. Il paziente veniva quindi sottoposto ad ablazione transcatetere del substrato aritmico e impianto di defibrillatore.
ABBREVIAZIONI
FA: fibrillazione atriale
EV: extrasistoli ventricolari
SEF: studio elettrofisiologico
INTRODUZIONE
La flecainide è impiegata nel trattamento della fibrillazione atriale (FA) in quanto rapida ed efficace nel ripristino del ritmo sinusale in acuto1 e ben tollerata in cronico.2-3 Le controindicazioni al suo utilizzo sono: disturbi della conduzione,4 cardiopatia strutturale5 e sindrome di Brugada. In quest’ultimo scenario, l’utilizzo dei farmaci di classe IC è limitato al test provocativo.6
CASO CLINICO
Presentiamo il caso di un paziente di 53 anni senza storia cardiologica, fattori di rischio cardiovascolari e familiarità per morte improvvisa.
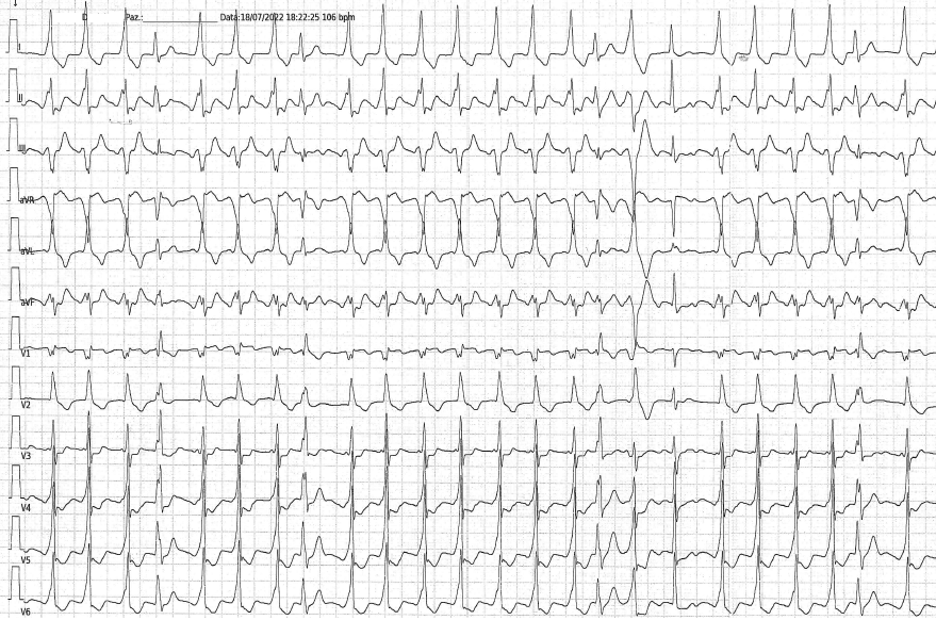
Il paziente giungeva alla nostra attenzione per cardiopalmo, discomfort toracico e dispnea. L’elettrocardiogramma mostrava tachicardia a QRS largo e ciclo irregolare (Figura 1). L’ecocardiogramma e gli esami ematochimici risultavano nella norma. Si decideva pertanto di eseguite una con cardioversione elettrica e ricoverare il paziente.
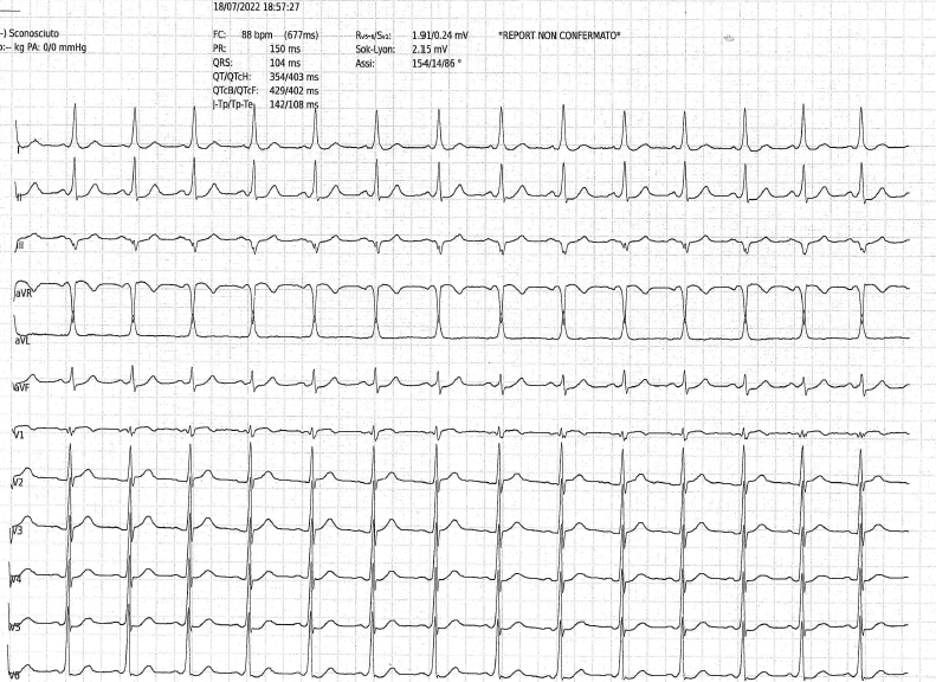
Al ripristino del ritmo sinusale, si osservavano segni elettrocardiografici di pre-eccitazione (Figura 2). Si eseguiva dunque uno studio elettrofisiologico (SEF), con identificazione di un fascio accessorio postero-settale destro con caratteristiche di esclusiva conduzione anterograda, sottoposto ad ablazione transcatetere. Si introduceva dunque la flecainide per la prevenzione di recidive aritmiche.
In seguito alla prima assunzione del farmaco, si osservava la comparsa di extrasistolia ventricolare (EV) polimorfa precoce e ripetitiva, con QRS relativamente stretto. La morfologia prevalente risultava compatibile con un’origine dal sistema di Purkinje del ventricolo sinistro. Si sospendeva la flecainide e si introduceva verapamil, parzialmente efficace nel sopprimere le EV, ma mal tollerata per spiccata bradicardia.
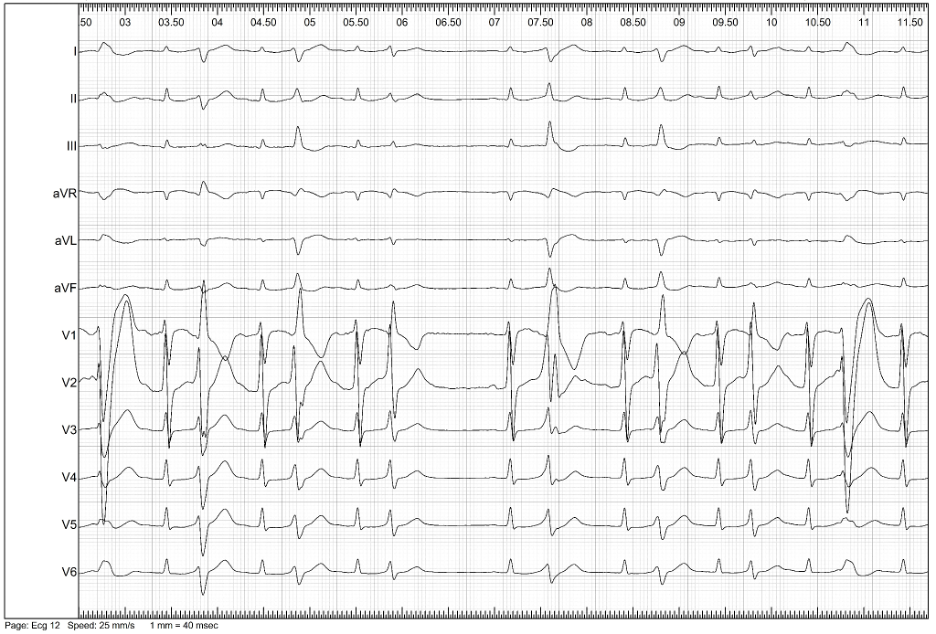
Per una migliore caratterizzazione dell’EV, si decideva di sottoporre il paziente a nuovo SEF. Al mappaggio elettroanatomico basale non si evidenziavano aree di attivazione ventricolare precoce. Si procedeva all’infusione di ajmalina (1 mg/kg in 10 minuti) con comparsa di EV multifocale precoce e ripetitiva, ad origine dal fascicolo posteriore e anteriore del sistema di conduzione (Figura 3-4).
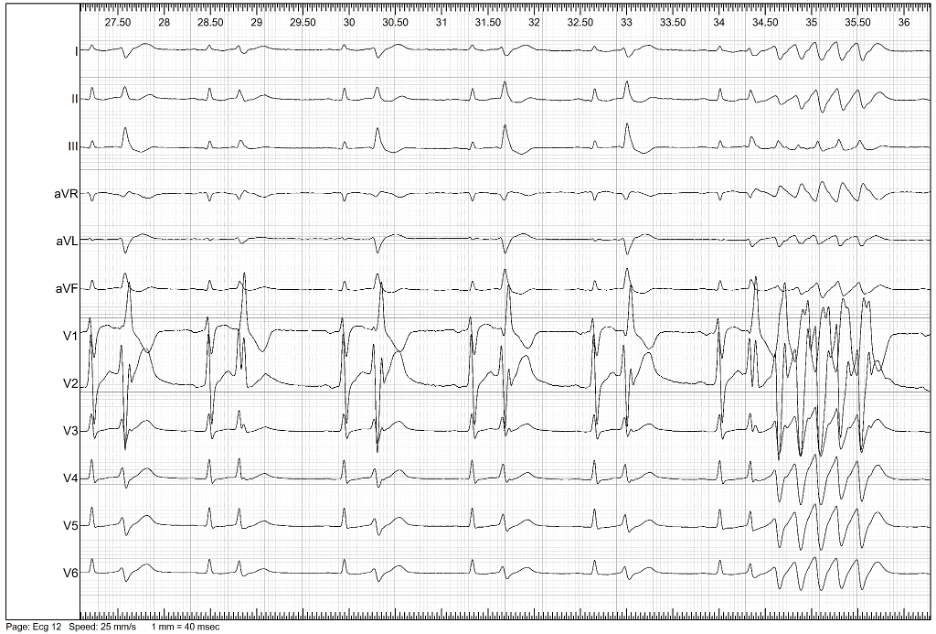
In assenza di cardiopatia strutturale e della riproducibilità del fenomeno ectopico con infusione di antiaritmico di classe I, si poneva il sospetto di EV maligna del sistema del Purkinje. Tenendo conto dell’elevato rischio aritmico associato a questo tipo di EV, si procedeva ad ablazione del focus aritmico.
Tuttavia, nei giorni successivi, nonostante la procedura ablativa e la sospensione della flecainide, si assisteva alla recidiva di EV precoce polimorfa. In considerazione dell’associazione tra tale fenomeno ed il rischio di aritmie maligne, nonostante la difficoltà nella stratificazione del rischio nel caso di riscontro occasionale in paziente asintomatico, si decideva di procedere ad impianto di defibrillatore sottocutaneo, dopo colloquio esaustivo col paziente e sua partecipazione attiva alla decisione. Il paziente veniva dimesso con indicazione ad eseguire test genetico, risultato negativo per i geni testati (compreso SCN5A), e risonanza magnetica cardiaca, che ha confermato l’assenza di cardiopatia strutturale. Veniva data indicazione all’esecuzione di elettrocardiogramma basale nei familiari di primo grado, risultati nei limiti. Il paziente veniva seguito in follow-up nell’anno successivo, senza evidenza di recidive aritmiche.
DISCUSSIONE
Osservando come l’infusione di farmaci bloccanti i canali del sodio possa indurre EV in pazienti senza pattern di Brugada, Haissaguerre et al. hanno descritto per la prima volta l’extrasistolia maligna del Purkinje.7L’accezione “maligna” deriva dal breve intervallo di accoppiamento delle EV (<300 msec), con il rischio di “R-on-T”, fibrillazione ventricolare e morte improvvisa.8 In soggetti di età <45 anni sopravvissuti ad arresto cardiaco, dopo aver escluso cardiopatia ischemica e strutturale e le comuni canalopatie, è possibile porre diagnosi di fibrillazione ventricolare idiopatica. Questa è classificabile in due fenotipi 1) il substrato è rappresentato da alterazioni miocardiche subcliniche, identificabili al SEF come piccole aree in cui si registrano elettrogrammi anomali; 2) il trigger è rappresentato da EV precoci che originano dal sistema del Purkinje, più frequente in termini assoluti e con efficacia del trattamento ablativo.
In quest’ultima classe di pazienti, se la somministrazione di ajmalina è in grado di indurre EV precoci (>10/min) e/o forme ripetitive senza comparsa di pattern di Brugada, è possibile porre diagnosi di ectopia maligna del Purkinje. L’eziologia di questa condizione non è nota. I pazienti inclusi nello studio di Haissaguerre et al. sono stati sottoposti a test genetico per 63 geni implicati nella genesi di cardiomiopatie o canalopatie,7 ma non sono state identificate mutazioni patogenetiche. Alla risonanza magnetica, in nessuno dei pazienti sono state identificate anomalie strutturali. Inoltre, nessuno dei pazienti dello studio era precedentemente in terapia con farmaci di classe IC, per cui è possibile sospettare che esistano altri trigger, attualmente non noti, in grado di slatentizzare queste aritmie.
Al momento è impossibile produrre raccomandazioni circa la gestione di un paziente asintomatico con riscontro di EV maligna del Purkinje. Infatti, i casi di riscontro occasionali si collocano in una gray zone, senza evidenze cliniche. Considerando il modello del triangolo di Coumel,9 si può supporre che, in assenza di un substrato, l’identificazione e il trattamento del trigger (le EV) possa essere utile per prevenire aritmie maligne.10 Tuttavia, nel caso da noi riportato, la persistenza di EV precoci ha suggerito un risultato subottimale dell’ablazione. In assenza di evidenze riguardo al rischio di aritmie maligne nel contesto della prevenzione primaria, dopo discussione del caso con coinvolgimento attivo del paziente, è stato deciso di procedere all’impianto di un defibrillatore sottocutaneo.
CONCLUSIONI
L’extrasistolia maligna da fibre del Purkinje è una condizione rara e poco esplorata in letteratura. Nonostante incidenza e impatto clinico non siano chiari, è fondamentale riconoscere questa condizione, che può essere smascherata dall’utilizzo di antiaritmici di classe IC. Futuri studi dovranno chiarire l’impatto clinico di tale condizione, definendo dei percorsi diagnostici e strategie terapeutiche ottimali.
BIBLIOGRAFIA
- Donovan KD, Power BM, Hockings BE, Dobb GJ, Lee KY. Intravenous flecainide versus amiodarone for recent-onset atrial fibrillation. Am J Cardiol. 1995;75:693–697.
- Gulizia M, Mangiameli S, Orazi S, et al. A randomized comparison of amiodarone and class IC antiarrhythmic drugs to treat atrial fibrillation in patients paced for sinus node disease: the Prevention Investigation and Treatment: A Group for Observation and Research on Atrial arrhythmias (PITAGORA) trial. Am Heart J. 2008;155:100-107.e1.
- Aliot E, Denjoy I. Comparison of the safety and efficacy of flecainide versus propafenone in hospital out-patients with symptomatic paroxysmal atrial fibrillation/flutter. The flecainide AF French Study Group. Am J Cardiol. 1996;77:66A–71A.
- Hellestrand KJ, Bexton RS, Nathan AW, Spurrell RA, Camm AJ. Acute electrophysiological effects of flecainide acetate on cardiac conduction and refractoriness in man. Br Heart J. 1982;48:140-148.
- Greene HL, Roden DM, Katz RJ, Woosley RL, Salerno DM, Henthorn RW. The Cardiac Arrhythmia Suppression Trial: first CAST … then CAST-II. J Am Coll Cardiol. 1992;19:894-898.
- Wolpert C, Echternach C, Veltmann C, et al. Intravenous drug challenge using flecainide and ajmaline in patients with Brugada syndrome. Heart Rhythm. 2005;2:254-260.
- Escande W, Gourraud JB, Haissaguerre M, et al. Malignant Purkinje ectopy induced by sodium channel blockers. Heart Rhythm. 2022;19:1595-1603.
- Engel TR, Meister SG, Frankl WS. The “R-on-T” phenomenon: an update and critical review. Ann Intern Med. 1978;88:221-225.
- Jordaens L. A clinical approach to arrhythmias revisited in 2018 : From ECG over noninvasive and invasive electrophysiology to advanced imaging. Neth Heart J. 2018;26:182-189.
- Marcus GM. Evaluation and Management of Premature Ventricular Complexes. Circulation. 2020;141:1404-1418.
Info sull'autore