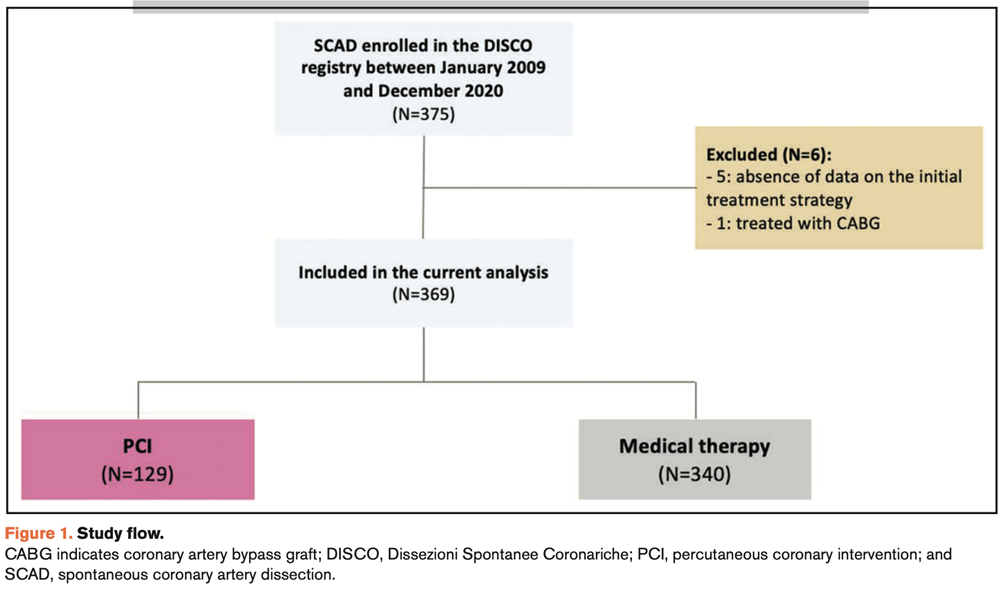
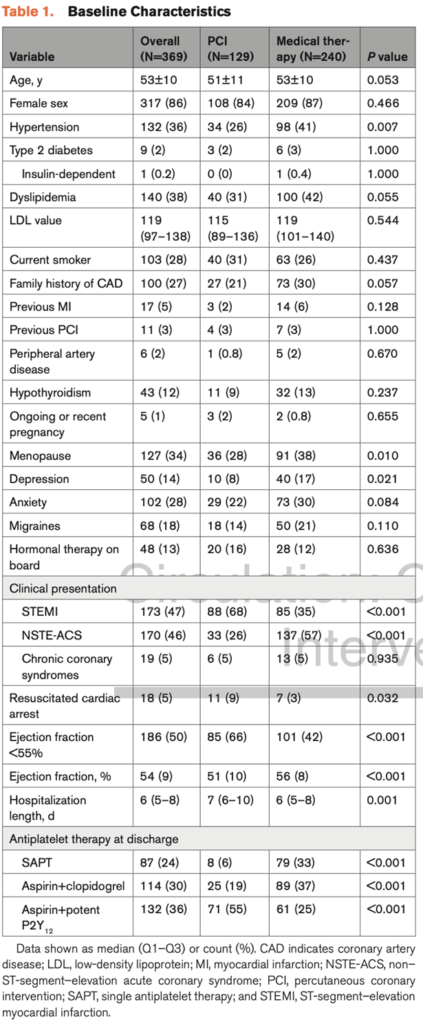
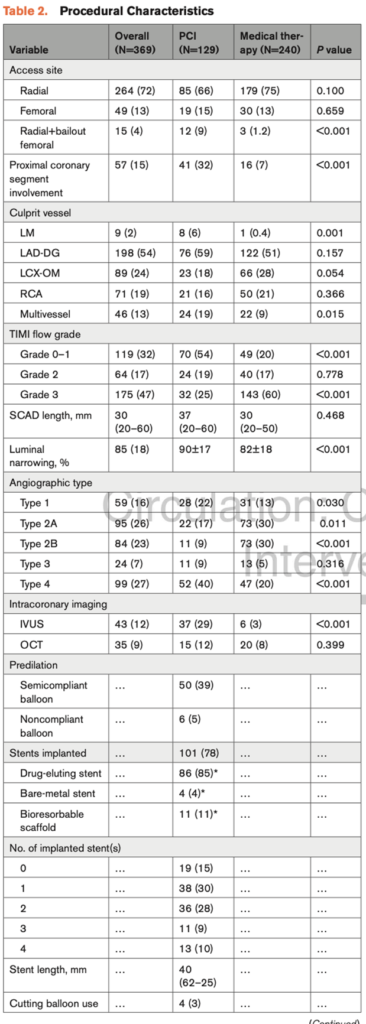
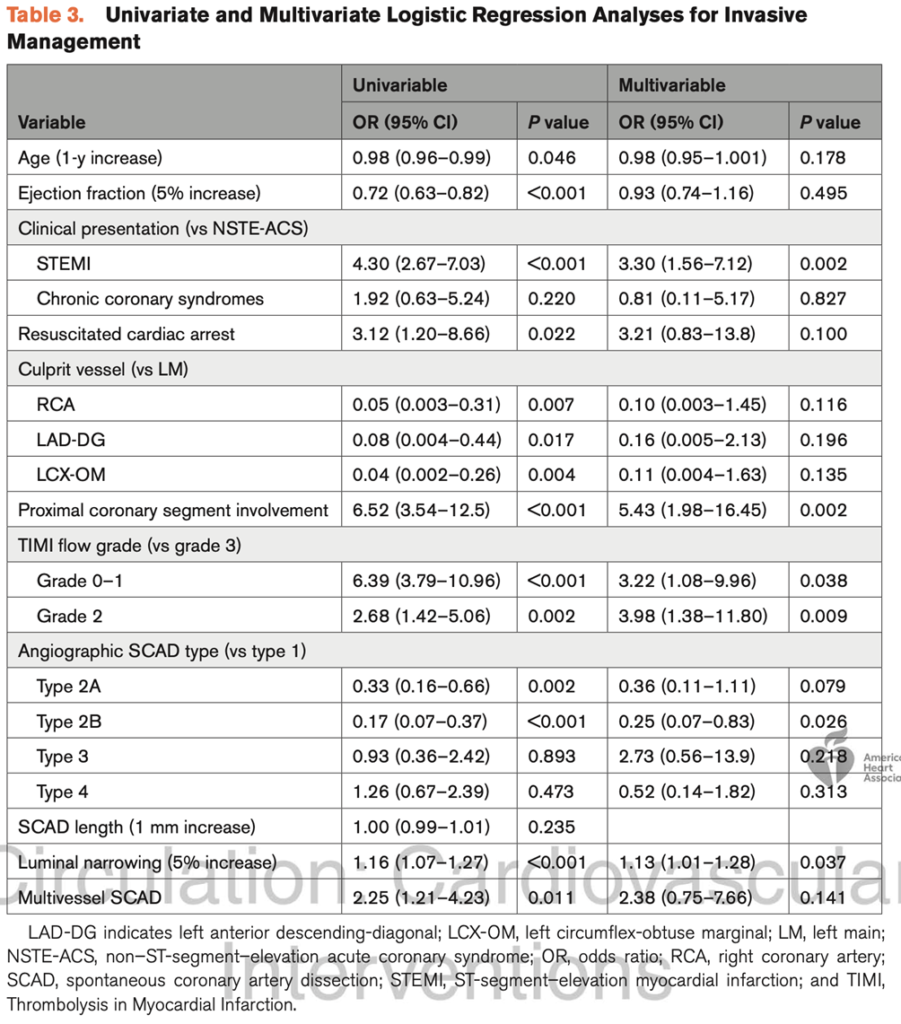
Raimondo Pittorru1, Simone Ungaro1, Antonella Capomolla1, Vittorio Zuccarelli1, Federico Migliore1, Giuseppe Tarantini1, Annalisa Angelini1, Sabino Iliceto1, Manuel De Lazzari1, Martina Perazzolo Marra1
1. Dipartimento di Scienze Cardio-Toraco-Vascolari e Sanità Pubblica, Università degli Studi di Padova, Padova, Italia
ABSTRACT
La malattia da deposito di catene leggere (LCDD) è una rara discrasia plasmacellulare caratterizzata da una deposizione di catene leggere (LC) mal ripiegate, che presenta diverse differenze con l’amiloidosi AL1,2. Il coinvolgimento cardiaco è considerato un evento raro oltre che tardivo nella storia naturale della patologia3, e potrebbe associarsi ad un’aumentata instabilità elettrica. La risonanza magnetica cardiaca, l’esame istopatologico con caratterizzazione tissutale e la microscopia elettronica sono elementi diagnostici essenziali per giungere ad una diagnosi corretta.
CASO CLINICO
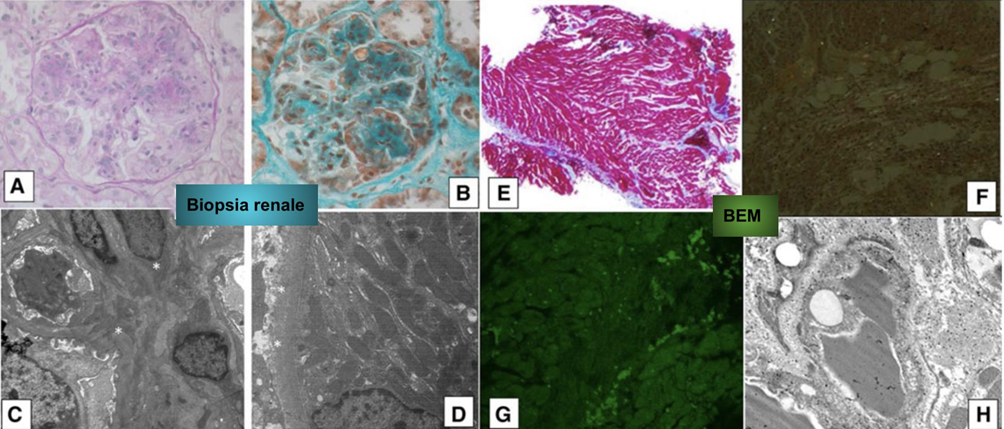
Riportiamo il caso di un uomo di 52 anni affetto da gammopatia monoclonale IgGk + k e sindrome nefrosica. Tale patologia era stata diagnosticata mediante biopsia del midollo osseo, che mostrava una presenza di plasmacellule del 60%, mentre la biopsia renale, attraverso tecniche di immunofluorescenza e microscopia ottica ed elettronica, confermava la presenza di malattia da deposito di catene leggere. Alla biopsia si riscontravano reperti caratteristici della malattia (Figure 2A e 2B); il microscopio elettronico mostrava un particolare materiale granulare, non fibrillare, elettrondenso lungo la membrana basale dei capillari glomerulari entro i nodulo mesangiali e lungo la membrana basale tubulare (Figure 2C, 2D).
Il paziente, trattato inizialmente con protocollo chemioterapico a base di Bortezomib-desametasone, veniva poi sottoposto a trapianto autologo di cellule staminali con remissione clinica e laboratoristica completa della patologia, renale ed ematologica.
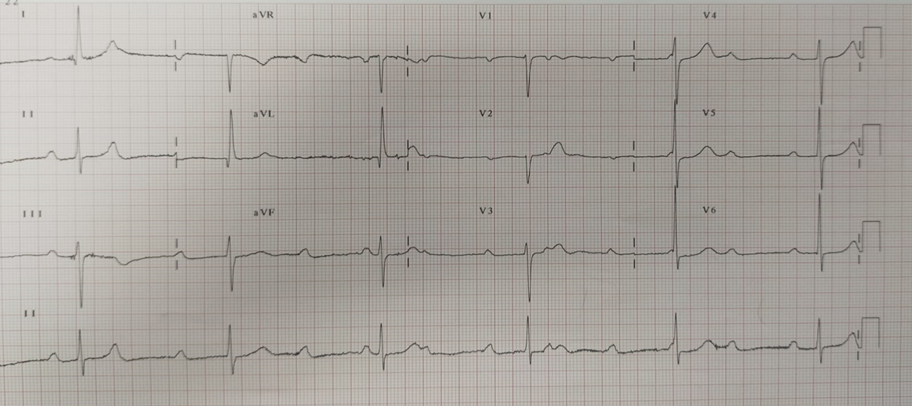
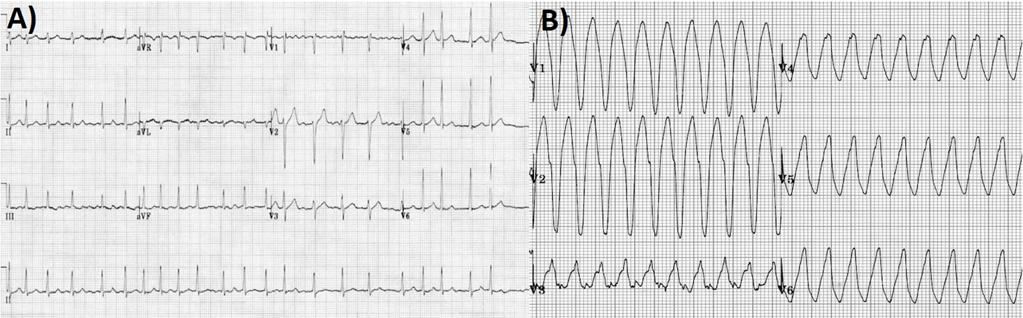
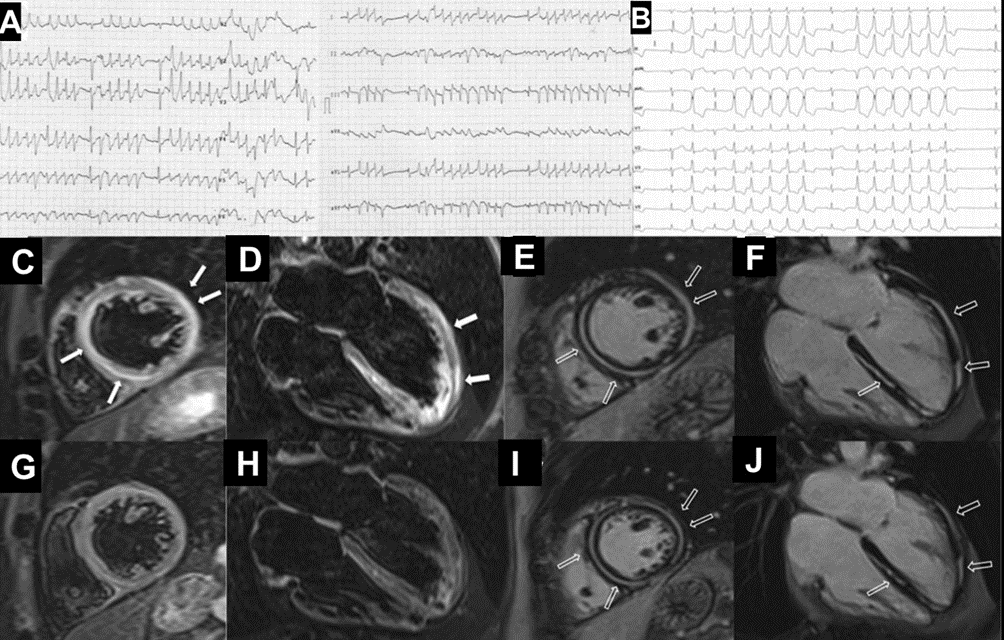
In seguito, tuttavia, si assisteva ad una ripresa di malattia testimoniata da un repentino aumento sierico delle IgG/k e delle catene leggere k, pertanto veniva introdotta la Lenalidomide. Due mesi dopo la modifica terapeutica, il paziente accedeva in Pronto Soccorso per comparsa di un episodio sincopale a riposo. Durante il ricovero, i valori degli indici di miocardiocitolisi registrati risultavano negativi, mentre al monitoraggio elettrocardiografico, si riscontravano onde T negative in sede infero-laterale in presenza di un bigeminismo ventricolare alternato a episodi ditorsioni di punta innescati dal fenomeno “R su T” (Figura 1A).
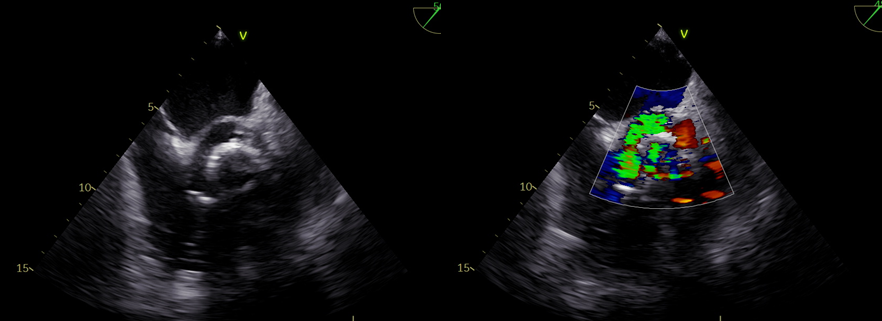
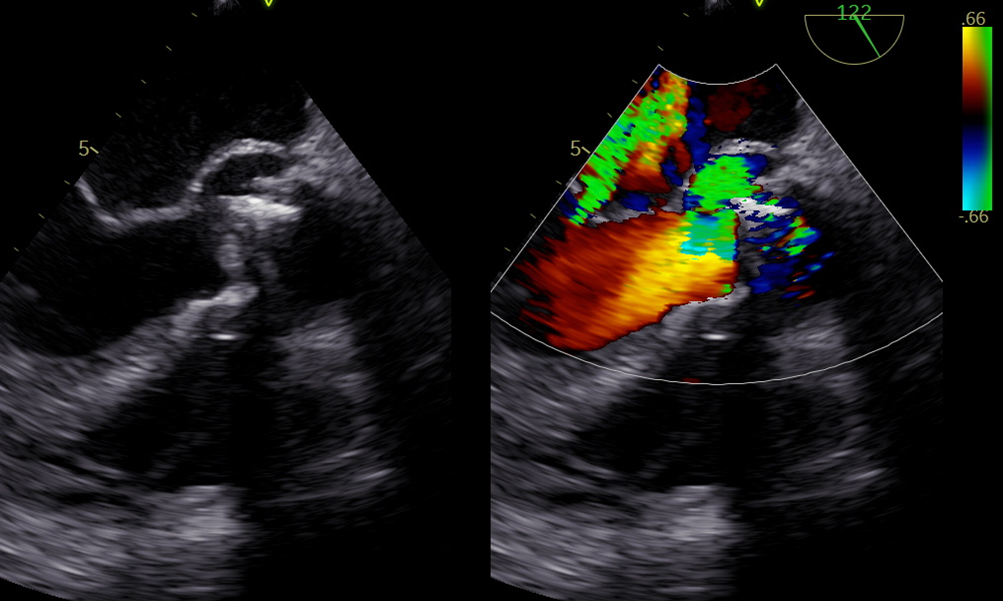
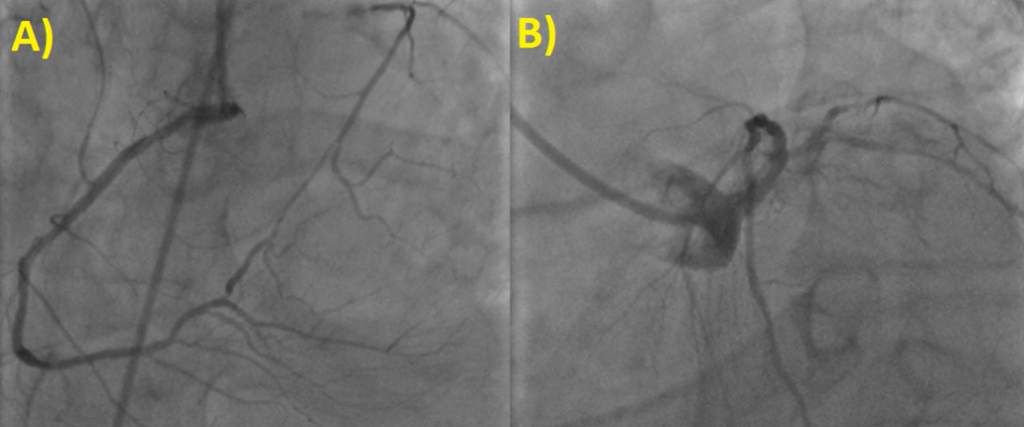
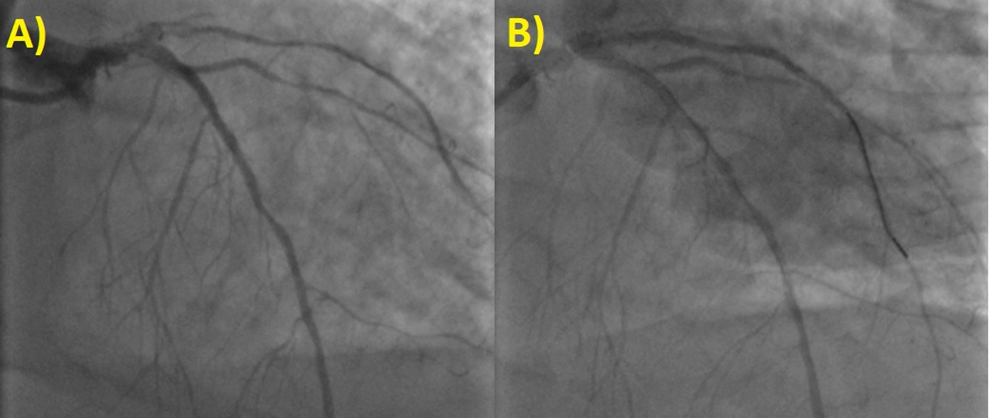
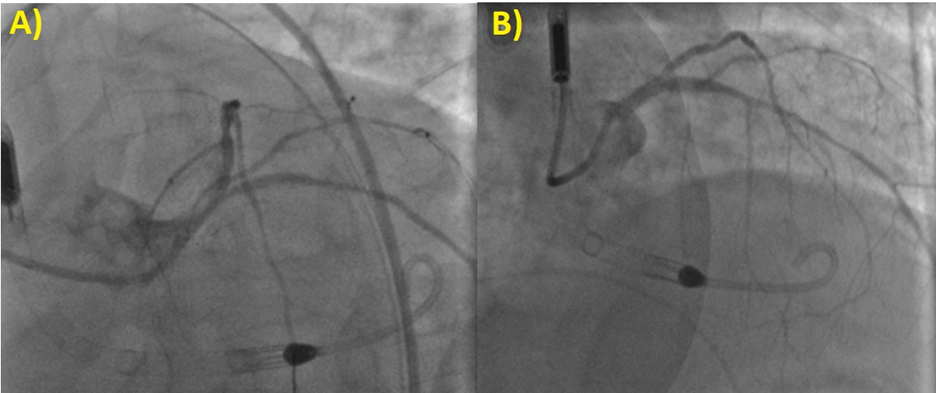
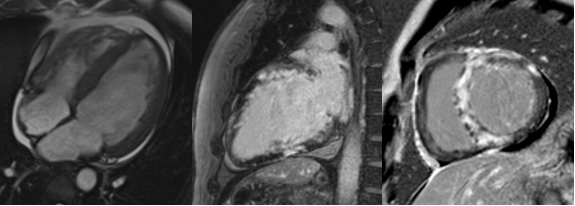
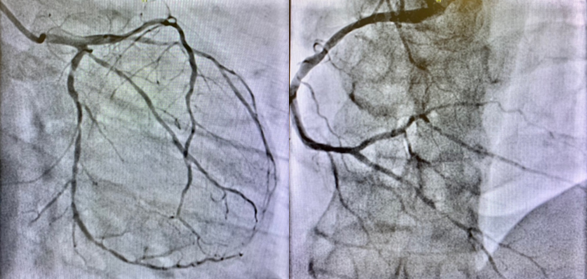
Nonostante la frazione di eiezione conservata, si proponeva approfondimento diagnostico mediante coronarografia con riscontro di ponte intramiocardico lungo il decorso dell’arteria coronaria discendente anteriore. Si procedeva quindi all’esecuzione di una risonanza magnetica cardiaca (RM), che mostrava un ventricolo sinistro non ipertrofico e con frazione di eiezione preservata, nonostante la presenza di ipocinesia regionale. Particolare attenzione veniva indirizzata nei confronti del late-gadolinium enhancement e nella valutazione dell’edema intramiocardico. L’edema, infatti, era localizzato in corrispondenza della parete subepicardica infero-laterale del ventricolo sinistro e associato a una stria edematosa a livello medio-settale (Figure da 1C a 1F). Alle sequenze post-contrastografiche, si rilevava LGE nelle medesime sedi con pattern ring-like (Figure da 1G a 1L) di natura non ischemica e non-amiloidotica.
Sulla scorta dei reperti della RM, il paziente veniva sottoposto a biopsia endomiocardica: i preparati colorati con ematossilina-eosina mostravano reperti aspecifici, tra cui fibrosi e necrosi miocardica focale, in assenza di infiltrato infiammatorio (Figura 2 E); le colorazioni specifiche per amiloidosi, ossia Rosso congo (Figura 2F) e Tioflavina T (Figura 2G) risultavano altresì negative.
Risultava, invece, dirimente l’analisi al microscopio elettronico che documentava materiale elettrondenso granulare a livello interstiziale, senza dimostrazione di alcun pattern o caratteristica tipica di patologia amiloidotica cardiaca (tra cui foglietti-beta fibrillari; Figura 2H).
Durante la degenza, si registravano ripetuti episodi di tachicardia ventricolare non sostenuta (Figura 1B) per i quali, anche in considerazione delle evidenze strumentali, il paziente veniva sottoposto a impianto di ICD transvenoso.
Veniva quindi dimesso con una diagnosi finale di “LCDD (κ) con coinvolgimento cardiaco”, e prosecuzione del regime chemioterapico con la lenalidomide.
Dopo 3 mesi dall’impianto dell’ICD, a causa di endocardite su elettrocatetere, si procedeva all’estrazione transvenosa e all’impianto di un nuovo dispositivo, previa ripetizione di RM. Tale esame, rispetto al precedente, rivelava una significativa riduzione di edema miocardico e persistenza di LGE.
DISCUSSIONE
La LCDD è una rara discrasia delle plasmacellule caratterizzata da una deposizione non-amiloidotica di catene leggere (LC) malripiegate in organi e tessuti1,2. Il coinvolgimento cardiaco è considerato un evento raro oltre che tardivo nella storia naturale della patologia3. Proprio per questo motivo, il pattern di deposizione non fibrillare delle catene leggere nel miocardio è stato evidenziato solo in poche biopsie endomiocardiche. Le aritmie ventricolari life-threatening e gli ecocardiogrammi non-diagnostici rappresentano i due hallmarks di tale coinvolgimento3,4,5.
In letteratura esistono poche evidenze in merito al coinvolgimento cardiaco in presenza di LCDD, verosimilmente a causa della rarità della patologia, per tale motivo non si dispone di dati in merito all’imaging in vivo di tale condizione. In merito al caso, la presenza di edema alla prima RM identifica la deposizione subacuta interstiziale di LC, che, considerata la loro intrinseca proteotossicità, sono alla base dell’instabilità elettrica e del burden aritmico. Inoltre, il pattern LGE che risparmia l’endocardio confermerebbe le evidenze in merito agli studi autoptici relativi a tale patologia3.
CONCLUSIONI
Il nostro gruppo, per la prima volta, ha descritto un pattern in vivo del coinvolgimento cardiaco in corso di LCDD mediante la caratterizzazione tissutale ottenuta attraverso risonanza magnetica cardiaca, preparati istologici e microscopia elettronica. Abbiamo dimostrato che la LCDD ha, quindi, una distribuzione ed un’organizzazione ultrastrutturale diverse rispetto alle caratteristiche tissutali evidenziabili in corso di amiloidosi AL, e si associa ad una importante instabilità elettrica.
BIBLIOGRAFIA
1. Sayed RH, Wechalekar AD, Gilbertson JA, Bass P, Mahmood S, Sachchithanantham S, Fontana M, Patel K, Whelan CJ, Lachmann HJ, Hawkins PN, Gillmore JD. Natural history and outcome of light chain deposition disease. Blood. 2015 Dec 24;126(26):2805-10. doi: 10.1182/blood-2015-07-658872. Epub 2015 Sep 21. PMID: 26392598; PMCID: PMC4732758.
2. Masood A, Ehsan H, Iqbal Q, Salman A, Hashmi H. Treatment of Light Chain Deposition Disease: A Systematic Review. J Hematol. 2022 Aug;11(4):123-130. doi: 10.14740/jh1038. Epub 2022 Aug 30. PMID: 36118549; PMCID: PMC9451548.
3. Ramdane BA, Joseph J, Thomas M, O’Hara C, Barlogie B, Walker P, Joseph L. Cardiac nonamyloidotic immunoglobulin deposition disease. Mod Pathol. 2006;19:233–237.
4. Buxbaum JN, Genega EM, Lazowski P, Kumar A, Tunick PA, Kronzon I, Gallo GR. Infiltrative nonamyloidotic monoclonal immunoglobulin light chain cardiomyopathy: an underappreciated manifestation of plasma cell dyscrasias. Cardiology. 2000;93:220–228. doi: 10.1159/000007030
5. Manuel De Lazzari, Marny Fedrigo, Federico Migliore, Andrea Cianci, Luisa Cacciavillani, Giuseppe Tarantini, Benedetta Giorgi, Sabino Iliceto, Gaetano Thiene, Marialuisa Valente, Annalisa Angelini, Fausto Adami, Martina Perazzolo Marra. Nonamyloidotic Light Chain Cardiomyopathy: The Arrhythmogenic Magnetic Resonance Pattern. Circulation. 2016. 10.1161/CIRCULATIONAHA.115.019895