Tachicardia ventricolare da RVOT: il mappaggio elettroanatomico tridimensionale come chiave per la diagnosi differenziale tra forma idiopatica e cardiomiopatia aritmogena del ventricolo destro.
Linda Piras1, Raffaella Mistrulli1, Armando Ferrera1, Erika Pagannone1, Giuliano Tocci1, Roberta Falcetti1, Francesco Raffaele Spera1, Emanuele Barbato1
1U.O.C Cardiologia, Azienda Ospedaliero-Universitaria Sant’Andrea, Roma.
ABSTRACT
La cardiomiopatia aritmogena (ACM) è una cardiomiopatia ereditaria caratterizzata da una progressiva sostituzione fibroadiposa del miocardio che può colpire il ventricolo destro, quello sinistro o entrambi i ventricoli.
La ACM presenta un ampio spettro di manifestazioni cliniche, tra cui aritmie ventricolari, scompenso cardiaco e miocardite. Nonostante siano stati validati una serie di criteri elettrocardiografici, morfologici, istologici e genetici, la diagnosi di ACM rimane una sfida clinica, soprattutto nelle fasi precoci o forme lievi in cui le alterazioni strutturali sono minime, ma si associano ugualmente ad instabilità elettrica e rischio aritmico. In questo contesto, il mappaggio elettroanatomico tridimensionale (EAM) potrebbe offrire la possibilità di individuare le cicatrici elettroanatomiche che nella maggior parte dei casi si trovano nel tratto di efflusso ventricolare destro (RVOT) e sono predittive della sostituzione fibroadiposa, anche quando le alterazioni sono poco evidenti con altre tecniche.
CASO CLINICO
Presentiamo il caso di un uomo di 37 anni fumatore, privo di familiarità per cardiomiopatie o morte improvvisa ed altri fattori di rischio. Da circa un anno, aveva presentato saltuari episodi di cardiopalmo.
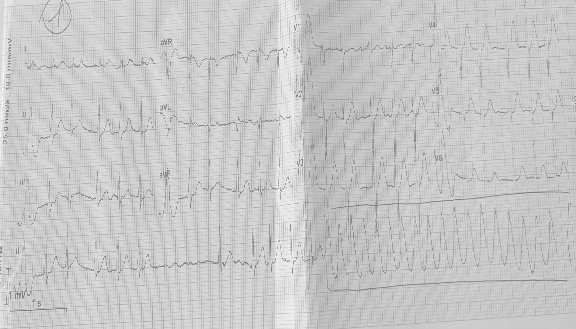
Per la comparsa di un episodio più intenso e di maggior durata, accedeva in Pronto Soccorso. L’elettrocardiogramma (Figura 1) mostrava fibrillazione atriale con FC media di 120 bpm con comparsa di una tachicardia a complessi larghi e FC di 200 bpm, emodinamicamente ben tollerata. Al secondo elettrocardiogramma, si evidenziava ripristino del ritmo sinusale e ritardo di conduzione intraventricolare destro. Gli esami ematici e l’ecocardiogramma non mostravano anomalie di rilievo. Il paziente veniva ricoverato e sottoposto a studio elettrofisiologico, che non mostrava presenza di vie accessorie, di doppia fisiologia nodale o pattern di Brugada al test all’ajmalina.
Si decideva dunque di procedere ad isolamento delle vene polmonari con crioablazione. Nel postoperatorio, si documentavano al monitoraggio telemetrico frequenti extrasistoli ventricolari e brevi run di tachicardia ventricolare non sostenuta (TVNS) monomorfa, ad apparente origine dal RVOT. Il paziente veniva sottoposto a cardio-TC, risultata nella norma, e risonanza magnetica cardiaca, che evidenziava una sottile stria di late gadolinium enhancement subepicardico a carico del segmento basale della parete laterale e inferiore del ventricolo sinistro, in assenza di segni di sostituzione fibroadiposa. Si decideva di ripetere lo studio elettrofisiologico, inducendo, dopo singolo extrastimolo (drive 600/210 msec), di una TV monomorfa alla FC di 240 bpm emodinamicamente ben tollerata e a verosimile partenza dal RVOT.
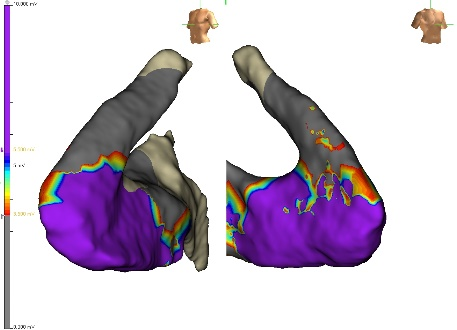
In considerazione del mismtach tra il risultato della risonanza e l’origine della TV, si decideva di eseguire un EAM di substrato del ventricolo destro e mappa di attivazione dell’extrasistolia ventricolare, con evidenza di origine dalla porzione anterolaterale del RVOT. Si procedeva dunque ad ablazione del focus mediante radiofrequenza con scomparsa dell’extrasistolia dopo sei secondi.
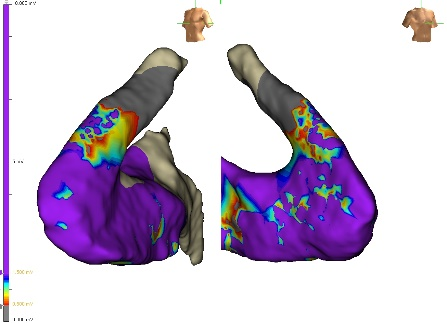
Mediante catetere multipolare ad alta definizione (HD Grid, Abbott) si evidenziavano aree di bassi voltaggi bipolari a livello della parete anterolaterale e un’ampia zona di bassi voltaggi unipolari a livello di tutto il RVOT (Figure 2 e 3) confermati con il catetere ablatore con sensore di contatto. Veniva eseguita infusione di isoprotenerolo senza induzione di aritmie.
In considerazione del buon risultato dell’ablazione e della necessità di uno stretto follow-up, veniva impiantato un loop recorder (Biomonitor III m, Biotronik) e il paziente veniva dimesso in terapia betabloccante ed anticoagulante. All’ultimo follow-up, si è mostrato asintomatico, con assenza di anomalie significative all’elettrocardiogramma ed ecocardiogramma. Il loop recorder non ha evidenziato aritmie significative. È stato inoltre eseguito un prelievo per l’analisi genetica, tuttora in corso.
DISCUSSIONE
La TV ad origine dal RVOT costituisce un’aritmia comune, attribuibile a due principali cause: 1) forma idiopatica; 2) secondaria alla ACM, con coinvolgimento del ventricolo destro.
La forma idiopatica è generalmente benigna, non ereditaria, che si manifesta tipicamente in giovani senza alcuna cardiopatia strutturale. Al contrario, la forma legata alla ACM predispone all’insorgenza di morte improvvisa [1][2]. Sebbene sia cruciale distinguere queste due condizioni, spesso la diagnosi differenziale può essere complessa, specialmente nel caso di forme precoci o lievi di ACM, difficilmente rilevabili dalle tecniche di imaging convenzionali [2][3][4]. In questo contesto, la dimostrazione istopatologica della sostituzione fibroadiposa tramite biopsia rappresenterebbe l’unico metodo per una diagnosi certa [5]. Tuttavia, tale tecnica è limitata dalla sua invasività, dalla natura segmentale della patologia e incapacità di valutare le variazioni transmurali della parete del ventricolo destro, dalla difficoltà nel distinguere il tessuto adiposo patologico dal tessuto subepicardico o da altre cardiomiopatie [5][6]. Recentemente, l’utilizzo dell’EAM è emerso come un metodo affidabile per identificare e caratterizzare le regioni a basso voltaggio, note come “cicatrici elettroanatomiche”, che nei pazienti con ACM corrispondono a zone di deplezione miocardica e correlano con l’aspetto istopatologico di atrofia e sostituzione fibroadiposa [5][7][8][9]. Questa tecnica è dunque utile per la diagnosi differenziale della TV da RVOT, dove nel caso di forme idiopatiche si hanno voltaggi normali mentre nel caso della ACM si osservano aree di basso voltaggio [1][5][7].
La presentazione iniziale del nostro paziente, con la fibrillazione atriale, non è rara nei pazienti con ACM. Una recente meta-analisi comprendente 16 studi con 1986 pazienti affetti da ACM ha riportato una prevalenza complessiva del 12,9% [10]. Dai dati attualmente a disposizione, la fibrillazione atriale si verifica prevalentemente nella fase iniziale di malattia in assenza di alterazioni strutturali conclamate e riflette la presenza di instabilità elettrica [11].
CONCLUSIONI
Nonostante l’elevato sospetto clinico, in assenza dei risultati dell’analisi genetica non possiamo porre una diagnosi definitiva di ACM [12]. Tuttavia, le caratteristiche cliniche sembrerebbe confermare l’esistenza di una fase precoce “occulta”, caratterizzata da sottili modificazioni strutturali, che possono limitarsi a una specifica zona del cosiddetto “triangolo di displasia” e manifestarsi esclusivamente con TV da RVOT. Inoltre, la descrizione di tale caso fornisce un contributo alla validazione dell’EAM come strumento diagnostico in questo contesto. Questo approccio, focalizzato sugli effetti elettrici – piuttosto che meccanici – della sostituzione fibroadiposa, potrebbe infatti superare alcune delle limitazioni dell’analisi istologica.
BIBLIOGRAFIA
[1] D. Corrado et al., “Three-Dimensional Electroanatomical Voltage Mapping and Histologic Evaluation of Myocardial Substrate in Right Ventricular Outflow Tract Tachycardia,” J. Am. Coll. Cardiol., vol. 51, no. 7, pp. 731–739, 2008, doi: 10.1016/j.jacc.2007.11.027.
[2] A. E. Buxton, H. L. Waxman, F. E. Marchlinski, M. B. Simson, D. Cassidy, and M. E. Josephson, “Right ventricular tachycardia: Clinical and electrophysiologic characteristics,” Circulation, vol. 68, no. 5, pp. 917–927, 1983, doi: 10.1161/01.CIR.68.5.917.
[3] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: an update,” Heart, 2009.
[4] D. Corrado et al., “Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: A multicenter study,” J. Am. Coll. Cardiol., vol. 30, no. 6, pp. 1512–1520, 1997, doi: 10.1016/S0735-1097(97)00332-X.
[5] D. Corrado et al., “Three-dimensional electroanatomic voltage mapping increases accuracy of diagnosing arrhythmogenic right ventricular cardiomyopathy/dysplasia,” Circulation, vol. 111, no. 23, pp. 3042–3050, 2005, doi: 10.1161/CIRCULATIONAHA.104.486977.
[6] G. T. Domenico Corrado, Cristina Basso, “Arrhythmogenic right ventricular cardiomyopathy: diagnosis, prognosis, and treatment,” Heart, 2000.
[7] M. Boulos, I. Lashevsky, S. Reisner, and L. Gepstein, “Electroanatomic mapping of arrhythmogenic right ventricular dysplasia,” J. Am. Coll. Cardiol., vol. 38, no. 7, pp. 2020–2027, 2001, doi: 10.1016/S0735-1097(01)01625-4.
[8] F. E. Marchlinski et al., “Electroanatomic substrate and outcome of catheter ablative therapy for ventricular tachycardia in setting of right ventricular cardiomyopathy,” Circulation, vol. 110, no. 16, pp. 2293–2298, 2004, doi: 10.1161/01.CIR.0000145154.02436.90.
[9] A. Verma et al., “Short- and long-term success of substrate-based mapping and ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia,” Circulation, vol. 111, no. 24, pp. 3209–3216, 2005, doi: 10.1161/CIRCULATIONAHA.104.510503.
[10] Rujirachun P, Wattanachayakul P, Charoenngam N, Winijkul A, Ungprasert P. Prevalence of atrial arrhythmia in patients with arrhythmogenic right ventricular cardiomyopathy: a systematic review and meta-analysis. J Cardiovasc Med (Hagerstown). 2020 May;21(5):368-376
[11] Peters S. Atrial arrhythmias in arrhythmogenic cardiomyopathy: at the beginning or at the end of the disease story? Circ J. 2015;79(2):446
[12] Corrado D, Perazzolo Marra M, Zorzi A, Beffagna G, Cipriani A, Lazzari M, Migliore F, Pilichou K, Rampazzo A, Rigato I, Rizzo S, Thiene G, Anastasakis A, Asimaki A, Bucciarelli-Ducci C, Haugaa KH, Marchlinski FE, Mazzanti A, McKenna WJ, Pantazis A, Pelliccia A, Schmied C, Sharma S, Wichter T, Bauce B, Basso C. Diagnosis of arrhythmogenic cardiomyopathy: The Padua criteria. Int J Cardiol. 2020 Nov 15;319:106-114.
Info sull'autore