Cardiomiopatia infiammatoria cronica: dalla presentazione clinica all’interpretazione della risonanza magnetica e della biopsia cardiaca
Elisa Cesarano, Maria Luisa Carbone, Emanuela Frau, Edoardo Carugi, Bianca Noli, Luca Fazzini, Enrico Mulargia, Roberta Montisci
Clinical Cardiology Unit, University Hospital of Cagliari, Italy
ABSTRACT
La cardiomiopatia infiammatoria cronica è una condizione di persistente infiammazione miocardica che esita in una disfunzione ventricolare. La diagnosi definitiva rappresenta ancora oggi una sfida, considerate l’assenza di segni e sintomi patognomonici.
La risonanza magnetica cardiaca e la biopsia endomiocardica sono esami diagnostici essenziali per giungere ad una diagnosi corretta. Talora l’interpretazione non è univoca, soprattutto nei casi di presentazione clinica tardiva. È questo il caso della nostra paziente, presentatasi in Pronto Soccorso con un quadro di shock cardiogeno conclamato.
CASO CLINICO
Una paziente di 57 anni affetta da sindrome di Kartagener, situs viscerum inversus, ipertensione arteriosa e storia di tachicardia parossistica sopraventricolare, accedeva in Pronto Soccorso per dispnea e plurimi episodi presincopali nelle ultime ore. Lamentava da circa due mesi febbricola, sintomi simil-influenzali, ortopnea, dispnea parossistica notturna e comparsa di edemi declivi.
All’ingresso si presentava marcatamente ipotesa (PA 60/40 mmHg), tachipnoica, lievemente tachicardica e anurica; all’elettrocardiogramma non evidenza di alterazioni suggestive di ischemia. Agli esami ematochimici, modesto rialzo degli indici di flogosi e degli enzimi di miocardiocitolisi ad andamento non fasico, pro-BNP marcatamente elevato (13882 pg/mL) e danno epato-renale. All’emogasanalisi acidosi metabolica con iperlattacidemia (12 mmol/L).
All’ecocardiogramma riscontro di atrio e ventricolo sinistri dilatati con grave disfunzione biventricolare da ipocinesia diffusa (frazione d’eiezione ventricolo sinistro 15%) e insufficienza mitralica funzionale di grado severo. In considerazione del sospetto di miocardite presentatasi con un quadro di shock cardiogeno veniva avviato sostegno al circolo con inotropi (dobutamina 10 mcg/kg/min) e successivo supporto meccanico con posizionamento di contropulsatore aortico (IABP).
La paziente veniva quindi ricoverata presso l’UTIC, vigile, in respiro spontaneo (ossigenoterapia FiO2 40%), con terapia diuretica endovenosa in infusione continua e sostegno al circolo mediante dobutamina ridotta a 7.5 mcg/kg/min e IABP 1:1. Al monitoraggio pressorio PA 125/70 mmHg, SpO2 99%, progressiva ripresa della diuresi. Dopo circa 36 ore veniva svezzata dalla terapia inotropa e da IABP e, una volta superata la fase acuta, si assisteva a miglioramento clinico-laboratoristico con sospensione dell’ossigenoterapia e progressiva titolazione della terapia per lo scompenso, con progressivo miglioramento della funzione sistolica biventricolare.
A completamento diagnostico, veniva eseguita risonanza magnetica cardiaca (CMR) che evidenziava frazione d’eiezione ventricolo sinistro (FEVS) 17% e ventricolo destro 25%; nelle sequenze STIR e per il T2 mapping area di alterato segnale nei segmenti infero-laterale basale e medio da riferire a edema miocardico e, nelle sequenze acquisite tardivamente dopo somministrazione di mezzo di contrasto, area di late gadolinium enhancement (LGE) subepicardico, compatibili con un quadro di miocardite. Si decideva inoltre di indagare il quadro coronarico mediante angio-TC, risultata negativa per lesioni stenosanti.
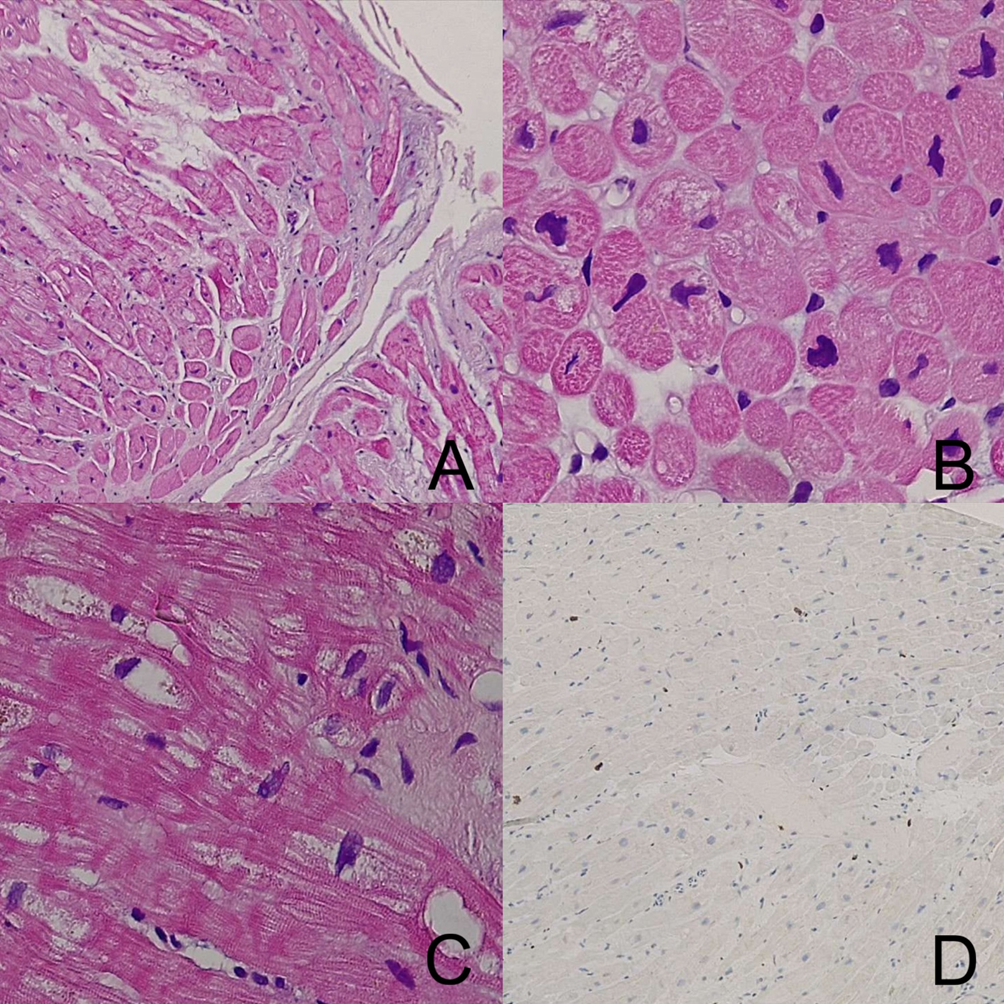
Sette giorni dopo la paziente veniva trasferita presso un altro Presidio per eseguire biopsia endomiocardica: venivano prelevati quattro frammenti caratterizzati da focale edema, lieve ipertrofia nucleare dei cardiomiociti e aspetti di degenerazione sarcoplasmatica con aloni perinucleari e tralci di sostituzione fibrosa, ma solo modesta presenza di infiltrati infiammatori aspecifici per miocardite (Figura 1).
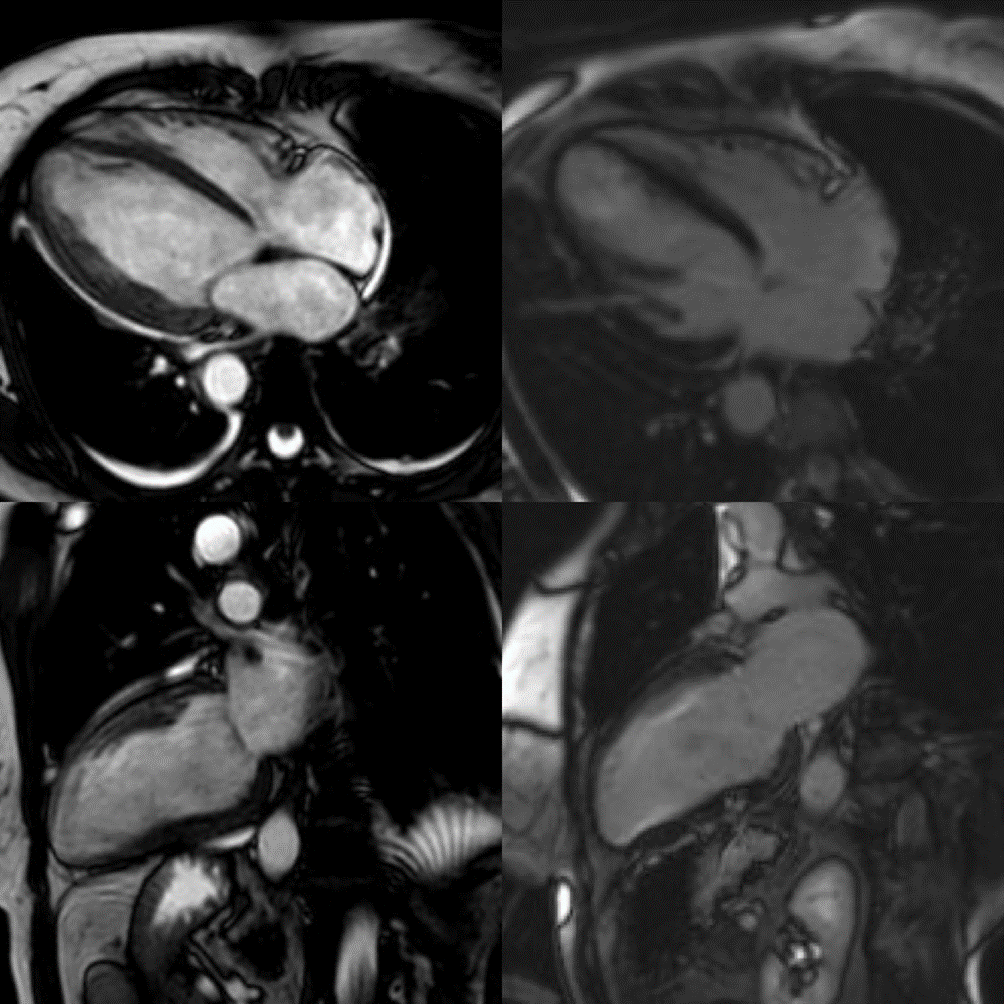
Alla CMR eseguita a un mese dalla dimissione, parziale recupero della funzione biventricolare (FEVS 36%) con risoluzione dell’edema miocardico senza aree di LGE (Figura 2).
DISCUSSIONE
La cardiomiopatia infiammatoria cronica è causata da un persistente stimolo infiammatorio, generalmente associato a un substrato genetico, e può rappresentare l’evoluzione di una miocardite clinicamente diagnosticata o silente. Presenta tipicamente segni e sintomi dell’insufficienza cardiaca fino allo shock cardiogeno, sindrome caratterizzata da una grave compromissione della contrattilità miocardica con riduzione della portata cardiaca, che si può manifestare con diversi fenotipi clinici, la cui diagnosi si basa sul riscontro di ipotensione associata a segni di ipoperfusione periferica.
Il caso presentato è suggestivo di una miocardite subacuta evoluta in cardiomiopatia infiammatoria cronica presentatasi all’esordio come uno shock cardiogeno in bassa portata (SCAI C). A supporto della nostra ipotesi diagnostica vi sono la storia clinica di durata superiore a 30 giorni, la dilatazione delle sezioni sinistre, il minimo incremento della troponina discordante rispetto alla severa disfunzione ventricolare e l’aspecifico infiltrato infiammatorio alla biopsia. Nonostante la presenza di modesta fibrosi all’esame istologico, è peculiare il riscontro di cambiamenti dinamici del LGE alla CMR. Al follow-up, la risoluzione dell’edema è di frequente riscontro, mentre l’estensione del LGE è un processo dinamico principalmente relato all’edema tissutale nella fase acuta che progressivamente si risolve nel tempo, contrariamente al riscontro di LGE al controllo che riflette la sostituzione fibrosa post-infiammatoria [1,2].
Se la miocardite acuta si presenta maggiormente con dolore toracico (“infarct-like”) [3], la cardiomiopatia infiammatoria cronica rientra nello spettro dell’insufficienza cardiaca (“cardiomyopathic”) fino allo shock cardiogeno fenotipicamente sovrapponibile ad uno scenario di “acute decompensated heart failure”. Il repentino ricorso a dispositivi di assistenza meccanica al circolo come il IABP può risultare vincente per interrompere la spirale dello shock cardiogeno migliorando l’accoppiamento ventricolo-arterioso e conseguentemente la performance cardiaca e la perfusione d’organo.
La caratterizzazione eziologica del nostro quadro non può prescindere da una definizione istologica. La biopsia endomiocardica risulta comunque gravata da bassa sensibilità e non si può escludere la difficoltà della metodica di fronte a una destrocardia per cui la sua aspecificità non esclude una malattia infiammatoria del miocardio, soprattutto a distanza di due settimane rispetto all’esordio dei sintomi [4]. Inoltre, nella cardiomiopatia infiammatoria cronica, sia la CMR che la biopsia endomiocardica possono repertare un’infiammazione meno florida rispetto alla gravità della presentazione clinica [1].
Il nostro caso clinico ci ricorda come la prima presentazione di una cardiomiopatia infiammatoria cronica può essere un’urgenza e richiedere immediata assistenza farmacologica e meccanica al circolo. Certamente la CMR e la biopsia endomiocardica rappresentano gli esami diagnostici principali seppur necessitino di una notevole esperienza nell’interpretazione dei risultati, talora non univoci. La determinazione dei fattori responsabili della transizione da miocardite acuta a cardiomiopatia infiammatoria cronica rimane oggetto di studio [1].
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405
- Aquaro GD, Ghebru Habtemicael Y, Camastra G, Monti L, Dellegrottaglie S, Moro C, Lanzillo C, Scatteia A, Di Roma M, Pontone G, Perazzolo Marra M, Barison A, Di Bella G; “Cardiac Magnetic Resonance” Working Group of the Italian Society of Cardiology. Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J Am Coll Cardiol. 2019 Nov 19;74(20):2439-2448. doi: 10.1016/j.jacc.2019.08.1061.
- Francone M, Chimenti C, Galea N, Scopelliti F, Verardo R, Galea R, Carbone I, Catalano C, Fedele F, Frustaci A. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis. JACC Cardiovasc Imaging. 2014 Mar;7(3):254-63. doi: 10.1016/j.jcmg.2013.10.011.
- Basso C. Myocarditis. N Engl J Med. 2022 Oct 20;387(16):1488-1500. doi: 10.1056/NEJMra2114478. PMID: 36260793.







Related Posts