Cardiotossicità da immune checkpoint inhibitors: non solo miocardite.
Daniela Di Lisi1,2, Francesca Castro2, Domenico Scelfo2, Luca Ganci2, Vincenzo Sucato1,2, Egle Corrado1,2, Giuseppina Novo1,2, Alfredo Ruggero Galassi1,2
1 Dipartimento di Cardiologia, Ospedale Universitario Paolo Giaccone, Palermo
2 Dipartimento ProMISE, Università di Palermo
ABSTRACT
Gli inibitori dei checkpoint immunitari (ICI) possono provocare effetti tossici cardiovascolari: miocardite, pericardite, vasculite, aterosclerosi accelerata, aritmie, ictus, blocchi atrio-ventricolare. La miocardite rappresenta la complicanza più frequente e temibile e, talora, può associarsi a sintomi neurologici e miosite. La diagnosi e il trattamento delle tossicità da ICI non sempre sono facili. Una diagnosi precoce e un trattamento tempestivo sono dunque essenziali per prevenire lo sviluppo di complicanze cardiovascolari severe. Descriviamo il caso di una paziente di 76 anni trattata con Pembrolizumab/Nivolumab, complicata dallo sviluppo di miocardite associata a miosite/miastenia.
INTRODUZIONE
La miocardite correlata alla terapia con inibitori dei checkpoint immunitari (ICI) è un evento avverso immuno-correlato poco comune (incidenza 0.04-1.14%), ma gravato da un alto tasso di mortalità (25-50%). Sia l’incidenza che la mortalità raddoppiano nel caso di terapia di combinazione con ICI (1). Frequentemente, la miocardite si associa a forme di miastenia-gravis e miosite. Lo spettro clinico di presentazione è assai variabile, da forme lievi con sole alterazioni ECG e laboratoristiche, a forme severe con scompenso cardiaco e danno d’organo, fino a forme fulminanti, con un quadro di instabilità emodinamica e/o aritmie fatali (1).
Descriviamo dunque il caso di una forma severa di miocardite ICI-correlata associata a miastenia gravis/miosite, paradigma di quanto la diagnosi e il trattamento di queste forme rappresenti una sfida per il cardiologo clinico.
CASO CLINICO
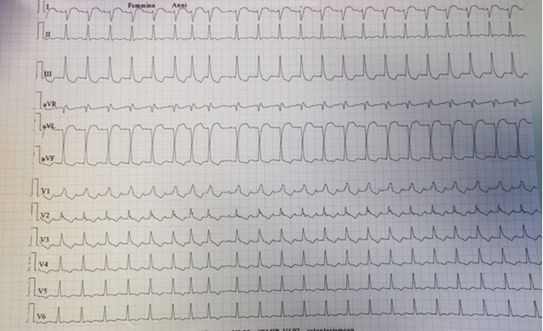
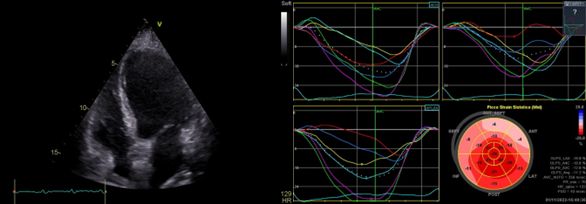
Una donna di 76 anni affetta da melanoma ulcerato al I dito del piede sinistro metastatico è stata ricoverata presso la nostra U.O di Cardiologia, a seguito dell’insorgenza di severa astenia, dispnea, edemi declivi e periorbitario con ptosi palpebrale bilaterale venti giorni dopo la somministrazione del primo ciclo di Pembrolizumab-Nivolumab. All’ECG si documentava fibrillazione atriale, emiblocco posteriore sinistro e blocco di branca destra (Figura 1). Agli esami ematochimici: aumento significativo degli indici di citolisi epatica, LDH, CPK, Troponina T ad alta sensibilità, mioglobina ed NT-proBNP. All’ecocardiogramma color-Doppler: ventricolo sinistro di dimensioni endocavitarie ai limiti superiori di norma, ipocinesia della parete inferiore basale e media; funzione sistolica ventricolare sinistra lievemente ridotta (FE biplana 44%); riduzione degli indici di deformazione miocardica del ventricolo sinistro (GLS -17,2% con picco sistolico di strain maggiormente ridotto a livello dei segmenti inferiori) (Figura 2). Al monitoraggio ECG-grafico si osservavano episodi di tachicardia ventricolare non sostenuta. La paziente lamentava inoltre diffuse algie muscolari per cui veniva eseguito dosaggio degli anticorpi anti-AchR e anti-Musk, risultati negativi. Nel sospetto clinico-strumentale di miocardite e miosite periferica da ICI, la paziente veniva trattata con metilprednisolone ad alte dosi (1000 mg/die) con scarso beneficio. Infatti, durante la degenza si assisteva a progressivo deterioramento delle condizioni cliniche (ipotensione, oligo-anuria, insufficienza respiratoria) con conseguente necessità di supporto inotropo e ,ventilazione non invasiva. Il quadro di instabilità emodinamica non consentiva, pertanto, il ricorso a test diagnostici di conferma, quali la risonanza magnetica cardiaca, e rendeva necessario il trasferimento in terapia intensiva, dove veniva eseguita terapia immunosoppressiva di II linea in associazione a plasmaferesi. Tuttavia, la paziente andava incontro ad exitus.
DISCUSSIONE
La miocardite ICI-correlata insorge frequentemente nelle prime 12 settimane dalla somministrazione del farmaco. Il sospetto iniziale è basato sulla valutazione dei sintomi (dispnea, astenia, dolore toracico), sull’incremento dei valori di troponina e sulla comparsa di alterazioni ECG (per es. sotto-slivellamento del segmento ST, inversione diffusa delle onde T, frequenti extrasistoli e aritmie ventricolari, disturbi di conduzione di nuova insorgenza, etc.), ecocardiografiche (riduzione della frazione d’eiezione e anomalie della cinesi segmentaria) e presenza alla risonanza magnetica cuore dei criteri di Lake Louise modificati. (1) (2) (3) Spesso tale forma di miocardite si associa a concomitante presenza di miosite/miastenia gravis, con sieronegatività anticorpale (4). In letteratura casi similari di sovrapposizione della miocardite da ICI con miosite/miastenia sono stati documentati. Il trattamento della tossicità neurologica non sempre è facile. Il nostro caso sottolinea l’importanza di una valutazione globale (cardiologica e neurologica) e di una diagnosi e trattamento tempestivi. L’ecocardiogramma e la risonanza magnetica cardiaca rappresentano il gold standard nella diagnosi non invasiva di miocardite. Il global longitudinal strain (GLS) del ventricolo sinistro può fornire importanti dati prognostici nei pazienti con miocardite (5). Il trattamento si basa sull’uso tempestivo di immunosoppressori. Le recenti linee guida europee (6) raccomandano di iniziare quanto prima il trattamento con alte dosi di metilpredinisolone per almeno 3-5 giorni e di valutare la risposta clinica. In caso di mancato miglioramento (miocardite refrattaria) viene suggerito di intraprendere un trattamento con immunosoppressori di II linea (micofenolato mofetitile, abatacept, alemtuzumab, etc.) o con altre metodiche quali la plasmaferesi. Il nostro caso evidenzia quanto sia necessario durante terapia con ICI il monitoraggio ECG e dei livelli di troponina per poter diagnosticare precocemente l’eventuale insorgenza di effetti tossici cardiovascolari, in quanto anche una singola dose di tali farmaci può avere conseguenze severe.
In conclusione, sebbene la terapia con ICI stia rivoluzionando la storia naturale di molti tumori, la coesistenza di effetti benefici e cardiotossici anche fulminanti, pone ogni cardiologo nelle condizioni di dover risolvere “il mistero diagnostico” legato a tali farmaci, soprattutto nei casi di overlap miocardite/miosite periferica e/o altri sintomi neurologici.
BIBLIOGRAFIA
- Palaskas N, Lopez-Mattei J, Durand JB, et al. Immune Checkpoint Inhibitor Myocarditis: Pathophysiological Characteristics, Diagnosis, and Treatment. J Am Heart Assoc. 2020;9(2): e013757.
- Ferreira VM, Schulz-Menger J, Holmvang G, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018;72(24):3158-3176.
- Luetkens JA, Faron A, Isaak A, et al. Comparison of original and 2018 Lake Louise criteria for diagnosis of acute myocarditis: results of a validation cohort. Radiology: Cardiothoracic Imaging. 2019;1: e190010.
- Huang YT, Chen YP, Lin WC, et al. Immune Checkpoint Inhibitor-Induced Myasthenia Gravis. Front Neurol. 2020 Jul 16; 11:634.
- Awadalla M, Mahmood SS, Groarke JD, et al. Global Longitudinal Strain and Cardiac Events in Patients with Immune Checkpoint Inhibitor-Related Myocarditis. J Am Coll Cardiol. 2020; 75:467-478
- Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-4361.
Info sull'autore