Navacchi Rebecca, Signoretta Gianluca, Grassi Francesca, Paoli Giorgia, Notarangelo Maria Francesca
1 Unità operativa di Cardiologia, Dipartimento cardio-toraco-vascolare, Azienda Ospedaliera Universitaria di Parma, Parma
ABSTRACT
Diversi sono ancora i punti insoluti in ambito di miocardite e variano dall’eziopatogenesi agli strumenti diagnostici fino alle strategie terapeutiche. Le infezioni virali ne sono generalmente la causa principale, ma sono state descritte anche forme su base autoimmune o tossica.
La risonanza magnetica nucleare (RMN) costituisce sicuramente l’esame diagnostico fondamentale, sufficiente di solito ad un corretto inquadramento clinico. In una minoranza di casi però essa non basta e occorre ricorrere a una procedura invasiva come la biopsia endomiocardica per giungere a una diagnosi definitiva e di conseguenza alla migliore terapia possibile.
Presentiamo il caso di un giovane paziente con un quadro di miocardite subacuta condizionante una severa disfunzione ventricolare, presentatasi clinicamente in associazione a trombosi cardiaca e a multiple embolizzazioni polmonari, risultata responsiva esclusivamente a terapia immunosoppressiva.
INTRODUZIONE
La miocardite riconosce diversi possibili meccanismi eziopatogenetici (infettivi, autoimmuni, farmacologici, reazioni da ipersensibilità, disordini sistemici, altre forme rare), ma predominano indubbiamente le infezioni virali, il più delle volte clinicamente misconosciute [1].
Una variante meno comune è la miocardite eosinofila. Questo sottotipo, che rimane ampiamente sottodiagnosticato probabilmente anche in relazione allo scarso impiego della biopsia endomiocardica, si riscontra maggiormente nei pazienti affetti da mielodisplasia, tumori solidi o parassitosi. L’infiltrato eosinofilico può mediare direttamente il danno cellulare, ma si verifica anche un’iperattivazione del sistema immunitario e della cascata della coagulazione, con esponenziale aumento del rischio trombotico. [1].
Nel complesso gli esperti concordano infine nel considerare due possibili scenari clinici d’esordio:
- Miocardite acuta (entro 30 giorni dall’insorgenza): senza dilatazione o disfunzione ventricolare sinistra, ma con un esordio clinico improvviso, talvolta necessitante di supporto emodinamico. E’ caratterizzata istologicamente da abbondante infiltrato infiammatorio.
- Cardiomiopatia infiammatoria cronica (> 30 giorni): contraddistinta da grave disfunzione ventricolare e da una sintomatologia clinica da scompenso cardiaco. Si caratterizza dal punto di vista istologico per la relativa scarsità dell’infiltrato infiammatorio [1].
CASO CLINICO
Presentiamo il caso di un ragazzo di 27 anni originario della Costa d’Avorio, in Italia da circa 4/5 anni, con anamnesi patologica e familiare muta per patologie di rilievo.
Nell’ambito di una visita cardiologica effettuata in previsione di un intervento urologico venivano riscontrate all’elettrocardiogramma (ECG) alterazioni della ripolarizzazione di tipo sovraccarico-ischemico. Il paziente inoltre riferiva dispnea da sforzo da circa un mese con associata tosse secca scarsamente responsiva alla terapia antibiotica impostata in precedenza dal Curante. L’iter diagnostico ambulatoriale proseguiva pertanto con esecuzione di ecocardiogramma che evidenziava un ventricolo sinistro severamente dilatato e globoso, con grave disfunzione sistolica (FEVSn 20%) ed aumentate pressioni polmonari stimate. Gli ECG successivi mostravano un’evoluzione con sviluppo di onde T negative nelle derivazioni precordiali. Il dosaggio delle troponine risultava significativamente aumentato (TnI Hs 8750 ng/dl). Alla luce del quadro di scompenso cardiaco in severa cardiopatia ipocinetica-dilatativa di nuovo riscontro il paziente veniva centralizzato presso il nostro centro per il proseguimento del dépistage diagnostico.
All’ingresso in reparto il paziente si presentava profusamente astenico, con dispnea da minimi sforzi (Classe NYHA III-IV), epigastralgia sfumata pressochè costante, disfagia e tosse secca esacerbata al momento dei pasti. Agli esami di laboratorio all’ingresso si riscontrava: TnI Hs 4800 ng/l, BNP 1188 pg/ml e PCR 4,9 mg/dl.
Una volta ottimizzato il quadro emodinamico si è proceduto a titolare la terapia anti-scompenso.
Nei giorni seguenti sono state effettuate ulteriori indagini, quali:
- Esami ematochimici di secondo livello, con pannelli infettivologici, di autoimmunità e trombofilia, risultati tutti sostanzialmente negativi ma con rialzo marcato delle IgE (2110 IU/mL, 5 volte la norma)
- TC torace e coronaro-TC che escludevano coronaropatie ma rilevavano un quadro di TEP con una piccola consolidazione a livello del parenchima basale-posteriore destro, con cercine a densità ground-glass, compatibile con infarto polmonare. Venivano segnalate inoltre trombosi intracavitarie in auricola destra e a livello apicale del ventricolo sinistro (immagine 1).Si avviava pertanto terapia anticoagulante con eparina a basso peso molecolare (EBPM).
- RM cuore, che confermava una severa dilatazione ed ipocinesia biventricolare (FEVSn 21% e FEVDx 31%) evidenziando positività al LGE oltre che alle sequenze T2 pesate con edema a carico della parete antero-laterale, a distribuzione subepicardica, compatibile con miocardite.
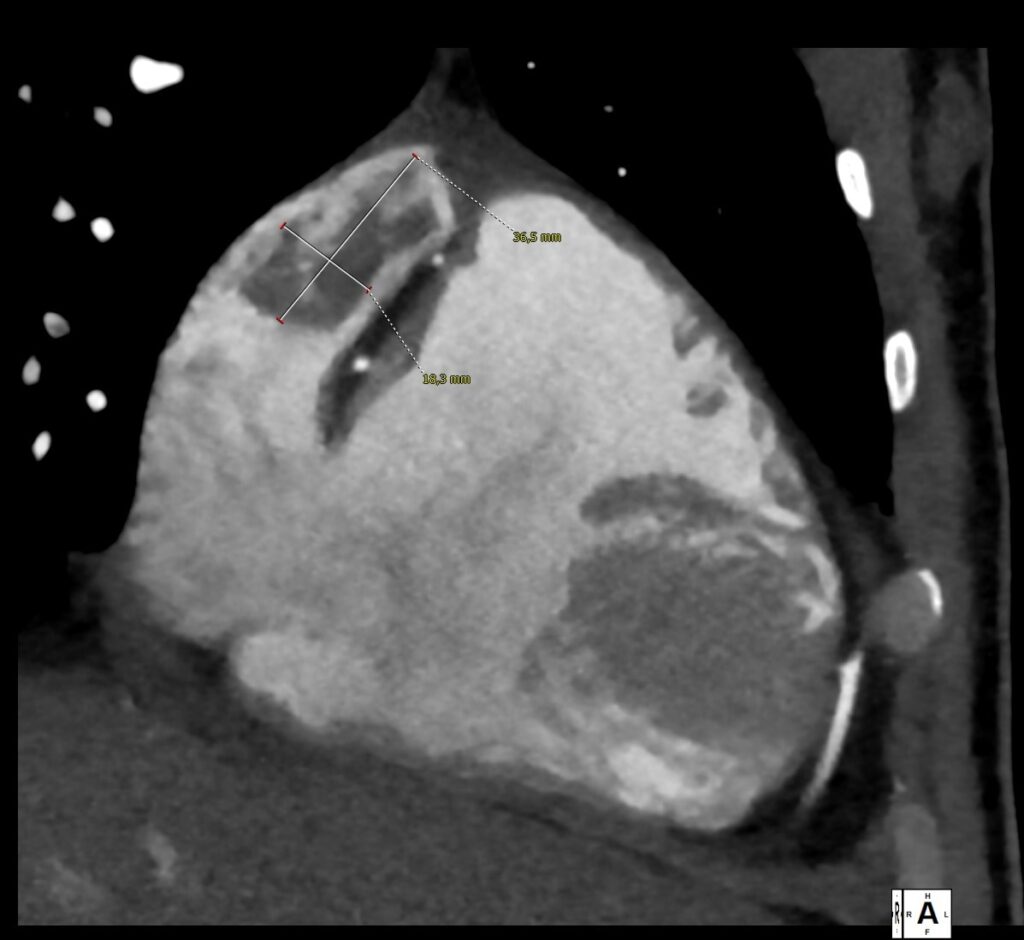
Sebbene in tale contesto la biopsia cardiaca sarebbe risultata di estrema utilità, la presenza di multiple formazioni trombotiche ha rappresentato in questa fase una controindicazione assoluta a qualunque procedura invasiva.
Ci siamo pertanto interrogati sulle varie possibili alternative diagnostiche: data la negatività degli esami microbiologici ma alla luce della spiccata tendenza alla trombosi e all’aumentato valore di IgE, pur in presenza di una normale conta eosinofilica, il nostro primo sospetto è stata la miocardite eosinofila.
Dopo una progressiva normalizzazione degli indici di flogosi e in assenza di elementi clinici suggestivi di infezione, si è avviata una terapia corticosteroidea a dosaggio immunosoppressivo, con metilprednisolone come da protocollo: 1gr per 3 giorni, 70 gr per 7 giorni, 50 gr per 6 giorni, 45 gr per 4 giorni e in seguito a scalare 5 gr ogni 4 giorni fino a sospensione [2].
Nel sospetto di esofagite eosinofila che potesse giustificare il quadro di disfagia e contemporaneamente confermare il nostro sospetto di miocardite eosinofila, è stata inoltre eseguita un’EGDS con biopsia, risultata però negativa per la presenza di inclusi eosinofili.
In corso di ricovero si è osservato un episodio di dolore toracico urente con tosse incessante, associato a un aumento degli indici di flogosi (PCR fino a 141 mg/dl) e significativo rialzo troponinico (TnI Hs 17655 ng/dl). Alla TC torace eseguita in urgenza si è evidenziato l’espansione dell’area di consolidamento polmonare e la formazione di una nuova trombosi a livello della parete inferiore ventricolare sinistra, con regressione delle trombosi precedentemente evidenziate.
Si proseguiva pertanto la terapia anticoagulante embricando Coumadin con EBPM. fino a raggiungimento del target INR 2-3.
Una volta ottenuta la regressione completa della trombosi endoventricolare si è potuto eseguire una biopsia endomiocardica, avvenuta a livello del setto interventricolare destro. Sul campione bioptico è stato identificato il Parvovirus B19, con aree di fibrosi perivascolare in assenza di florido infiltrato infiammatorio.
Tale dato purtroppo non è risultato clinicamente diagnostico: la presenza di Parvovirus alla biopsia infatti non è significativa se non è associata alla positività della sierologia e ad un infiltrato infiammatorio alla biopsia, visto che la presenza di tale virus è stata descritta in casi di miocardite in cui però non ha alcun ruolo causale [3].
Non ci è stato possibile escludere che il mancato isolamento nel siero del virus e l’assenza di infiltrazione infiammatoria siano in realtà dei falsi negativi, dovuti alla terapia immunosoppressiva intrapresa: quest’ultima però si era d’altro canto resa necessaria alla luce della scarsa risposta del paziente alla terapia convenzionale.
Durante la successiva degenza, dopo circa tre mesi di terapia antirimodellamento, il paziente ha eseguito una RMN cuore di rivalutazione, con evidenza di mancato recupero della contrattilità sinistra (FEVSn 27%) con un discreto miglioramento della contrattilità destra (FEVDx 45%). All’LGE veniva descritta nuova area di edema con lesione a livello subepicardio/transmurale a carico della parete inferiore medio-basale sinistra. Permaneva invariato il focolaio di edema e LGE della parete antero-laterale (immagine 2).
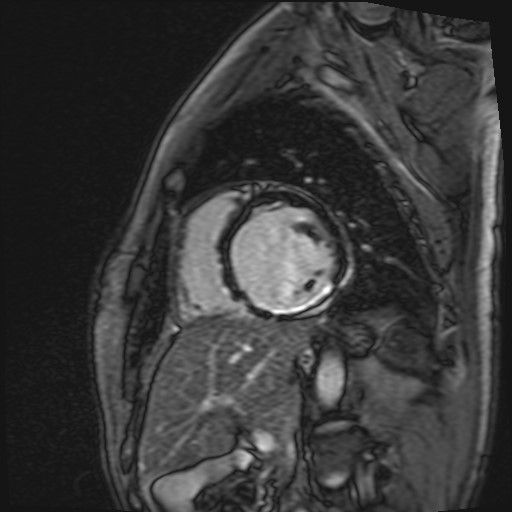
Si procedeva pertanto a impianto di ICD in prevenzione primaria, anche alla luce delle frequenti TVNS scarsamente responsive al betabloccante evidenziate al monitoraggio telemetrico.
In considerazione della stabilità clinica il paziente veniva trasferito presso altra struttura per un breve ciclo riabilitativo. Si rendeva necessaria però dopo qualche settimana nuova centralizzazione per scarica del device su FV (immagine 3), verosimilmente innescata da una subottimale titolazione della terapia antiaritmica.
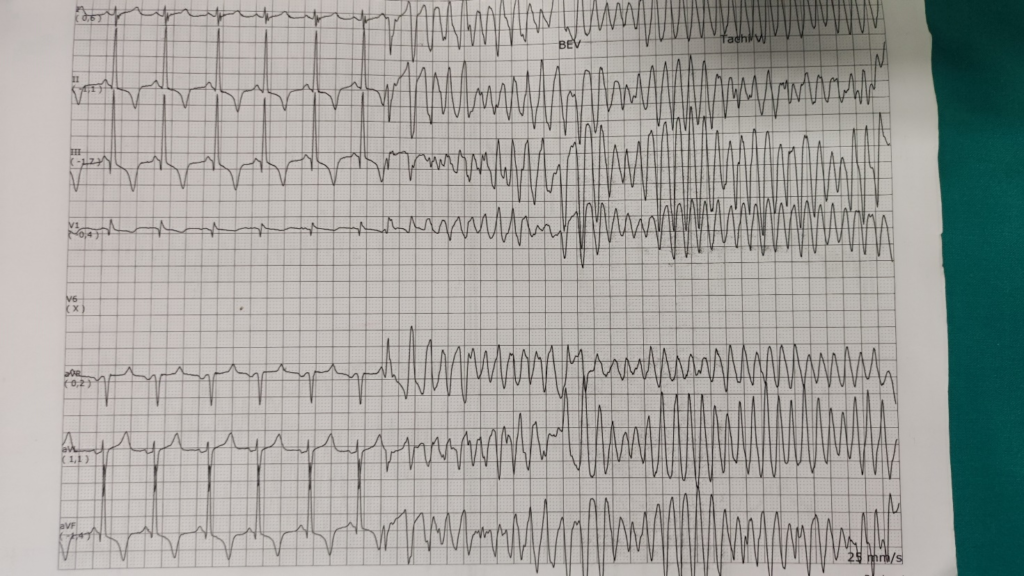
Previa stabilizzazione clinica il paziente veniva dimesso con la seguente prescrizione terapeutica: ARNI a basso dosaggio, SGLT2i, MRA, betabloccante a basso dosaggio, AVK e amiodarone.
Attualmente il paziente è in follow up presso il centro di III livello di Bologna per esecuzione di ulteriori accertamenti, inclusi screening trapiantologico e studi genetici per cardiomiopatie (ancora in corso). E’ stata inoltre eseguita una nuova biopsia endomiocardica, risultata anch’essa negativa per miocardite attiva e con lieve/moderata fibrosi interstiziale.
DISCUSSIONE
Una diffusa trombosi può essere riscontrata in corso di miocardite, più tipicamente nel caso della miocardite eosinofila, ma anche in caso di infezione mediata da Parvovirus B19 [4, 5, 6]. Per quanto riguarda la gestione farmacologica della complicanza trombotica, iniziano a comparire studi sul ruolo della terapia anticoagulante nelle miocarditi eosinofile, oltre che proposte di protocolli immunosoppressivi [2, 4, 5]. Per quanto riguarda la diagnostica invece, per questo sottotipo di patologia, in letteratura sono stati riportati casi in cui la miocardite eosinofila può presentarsi senza eosinofilia periferica, mentre il quadro istologico caratteristico è di infiltrato eosinofilo con presenza di cellule giganti multinucleate [7]. Importante resta la diagnosi differenziale con le altre varianti, tra cui quella descritta nel nostro caso; in corso di miocardite da Parvovirus B19 infatti l’infiammazione tende piuttosto a concentrarsi in sede perivascolare [3].
Questo caso clinico ci ha posto davanti a un bivio: da un lato avevamo una condizione clinica precaria, con episodi recidivanti di embolia polmonare e il contemporaneo rischio di embolizzazione sistemica massiva, e la necessità di ricorrere a una terapia immunosoppressiva ad alti dosaggi; dall’altro vi era la consapevolezza che quest’ultima avrebbe però potuto influenzare negativamente ulteriori importanti accertamenti, tra cui la biopsia endomiocardica, che non si sarebbe potuta comunque eseguire senza risoluzione del quadro trombotico.
Alla fine ha prevalso la necessità di curare al meglio nell’immediato il paziente, anche a costo di rinunciare ad arrivare a una diagnosi definitiva.
BIBLIOGRAFIA
- Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405. Epub 2020 Nov 12. PMID: 33176455; PMCID: PMC7673642.
- Frustaci A, Chimenti C. Immunosuppressive therapy in myocarditis. Circ J. 2015;79(1):4-7. doi: 10.1253/circj.CJ-14-1192. Epub 2014 Dec 2. PMID: 25452202.
- Gun E, Bugra A. Eosinophilic myocarditis from a forensic histopathological perspective. J Forensic Sci. 2023 Mar;68(2):500-508. doi: 10.1111/1556-4029.15197. Epub 2023 Jan 12. PMID: 36633063.
- Pagura L, Imazio M, Merlo M, Sinagra G. Dieci quesiti in tema di miocardite eosinofila [Ten questions about eosinophilic myocarditis]. G Ital Cardiol (Rome). 2022 Apr;23(4):259-267. Italian. doi: 10.1714/3766.37535. PMID: 35343477.
- Bondue A, Carpentier C, Roufosse F. Hypereosinophilic syndrome: considerations for the cardiologist. Heart. 2022 Feb;108(3):164-171. doi: 10.1136/heartjnl-2020-317202. Epub 2021 Jun 25. PMID: 34172539.
- Whitehead NJ, Murch S, Leitch JW, Hackworthy RA. Acute myocarditis with thrombus near left ventricular outflow tract. Echocardiography. 2018 Apr;35(4):575-577. doi: 10.1111/echo.13840. Epub 2018 Feb 19. PMID: 29457263.
- Sugiyama E, Takenaka T, Kato M, Minoshima A, Muto H, Fujita M, Sato M, Inoue H, Nakamura H, Hasebe N. Eosinophilic myocarditis without hypereosinophilia accompanied by giant cell infiltration. J Cardiol Cases. 2015 Aug 4;12(5):169-171. doi: 10.1016/j.jccase.2015.07.004. PMID: 30546587; PMCID: PMC6281835.