Staged protected percutaneous coronary intervention with Impella CP® device in patient with recent acute coronary syndrome, arrhythmic storm, and severe left ventricular dysfunction: sometimes waiting is better!
Domenico Simone Castiello1, Domenico Angellotti1, Fiorenzo Simonetti1, Andrea Mariani1, Rachele Manzo1, Maddalena Immobile Molaro1, Dalila Nappa1
1Dipartimento di Scienze Biomediche Avanzate, Università Federico II di Napoli
ABSTRACT
Negli ultimi anni si è assistito ad un significativo aumento dell’uso dei dispositivi percutanei di assistenza ventricolare (pVADs, Percutaneous Ventricular Assist Devices) come supporto emodinamico nello shock cardiogeno e durante le procedure interventistiche, incluse le procedure di angioplastica coronarica percutanea (PCI, Percutaneous Coronary Intervention) ad alto rischio, che, supportata dai pVADs, viene attualmente definita “Protected” PCI. In questo report presentiamo il caso clinico di un paziente di 67 anni con diagnosi di sindrome coronarica acuta con sopraslivellamento del tratto ST (STE-ACS, ST-elevation Acute Coronary Syndrome) che, data la complessità anaatomica coronarica, la disfunzione ventricolare sinistra, le severe co-morbidità ed il burden aritmico, in seguito alla PCI primaria in urgenza, veniva candidato a staged Protected PCI con il dispositivo Impella CP® per il trattamento di una stenosi sub-occlusiva calcifica di Tronco Comune non protetto dell’Arteria Coronaria Sinistra.
CASO CLINICO
Presentiamo il caso clinico di un paziente di 67 anni con i seguenti fattori di rischio cardiovascolare: ipertensione arteriosa, diabete mellito di tipo II in trattamento insulinico dislipidemia e pregressa abitudine tabagica. In anamnesi, inoltre, il paziente presenta malattia renale cronica (CKD, Chronic Kidney Disease) in trattamento dialitico dal 2008 e sottoposta a trapianto renale nel 2011, ipotiroidismo e BPCO. Il paziente si reca in pronto soccorso per l’insorgenza, da circa due ore, di dolore epigastrico oppressivo, palpitazioni e sudorazione algica. Viene quindi eseguito un elettrocardiogramma che evidenzia un sopraslivellamento del tratto ST nelle derivazioni AVR e V1 con associato sottoslivellamento diffuso (in 8 derivazioni). Viene quindi posta diagnosi di infarto miocardico con sopraslivellamento del tratto ST (STEMI, ST-elevation Myocardial Infarction) dato che un simile quadro elettrocardiografico va considerato come uno STEMI-equivalente [1]. Per tale motivo il paziente viene trasferito presso il nostro centro Hub per essere sottoposto ad angiografia coronarica in urgenza.
Il quadro angiografico mostra una malattia aterosclerotica coronarica (CAD, Coronary Artery Disease) multivasale e complessa: si evidenzia infatti un’occlusione cronica totale (CTO, Chronic Total Occlusion) del Ramo Circonflesso dell’Arteria Coronaria Sinistra, ben riabitata per via etero-coronarica dall’Arteria Coronaria Destra che appare ateromasica, esente da stenosi angiograficamente significative. Si riscontra altresì una stenosi subocclusiva, trombotica al tratto prossimale e medio del Primo Ramo Diagonale dell’Arteria Coronaria Sinistra e soprattutto una stenosi subocclusiva e calcifica al tratto medio del Tronco Comune dell’Arteria Coronaria Sinistra coinvolgente l’ostio del Ramo Interventricolare Anteriore (Figura 1).
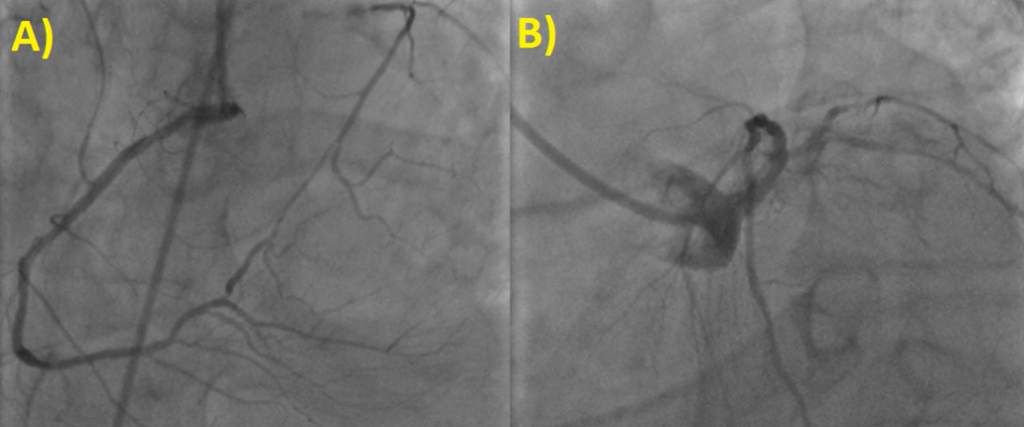
A) CTO del Ramo Circonflesso con buona riabitazione per via etero-coronarica dall’Arteria Coronaria Destra. B) Stenosi subocclusiva e calcifica al tratto medio-distale del Tronco Comune dell’Arteria Coronaria Sinistra coinvolgente l’ostio del Ramo Interventricolare Anteriore.
Si decide di procedere a PCI primaria con impianto di due stent medicati (DES, Drug-Eluting Stent) in overlap al tratto prossimale e medio del Primo Ramo Diagonale ottenendo un ottimo risultato angiografico finale con flusso anterogrado coronarico TIMI 3 (Figura 2).
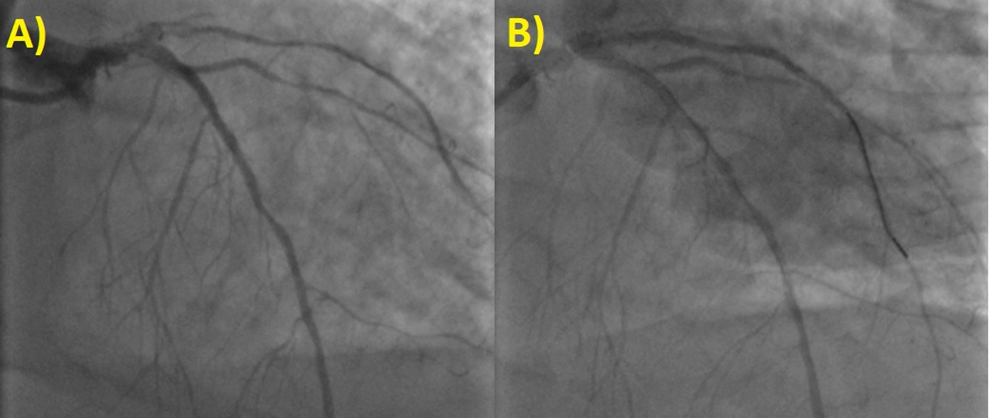
A) Stenosi subocclusiva, trombotica al tratto prossimale e medio del Primo Ramo Diagonale dell’Arteria Coronaria Sinistra. B) PCI con impianto di due DES al tratto prossimale e medio del Primo Ramo Diagonale con ottimo risultato angiografico finale.
Il paziente si presentava in condizioni di stabilità emodinamica, per cui si decideva di discutere successivamente in Heart Team la strategia ottimale di rivascolarizzazione per il Tronco Comune non protetto. In UTIC il paziente veniva sottoposto ad ecocolorDoppler cardiaco transtoracico che evidenziava una severa disfunzione ventricolare sinistra con acinesia dell’apice in toto ed ipocinesia diffusa determinanti una Frazione di Eiezione (EF, Ejection Fraction) del 30%. Il giorno seguente il paziente sviluppava fibrillazione atriale ad alta risposta ventricolare determinante un quadro di instabilità emodinamica, trattato con cardioversione elettrica ed infusione endovenosa di amiodarone. Poche ore dopo si assisteva all’insorgenza di un quadro di Storm Aritmico, con sei episodi di tachicardia ventricolare sostenuta che venivano trattati con infusione endovenosa di amiodarone, metoprololo e lidocaina, dopo un tentativo infruttuoso di cardioversione elettrica, ottenendo il ripristino del ritmo sinusale (Figura 3).
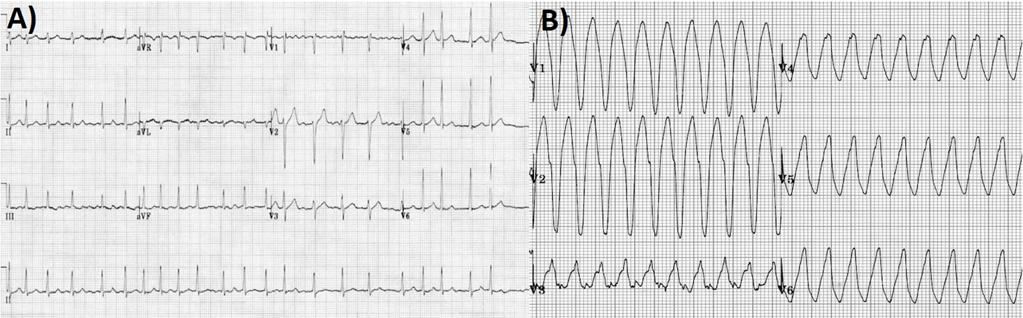
In Heart Team si decretava che il paziente non era candidabile alla rivascolarizzazione chirurgica, data la severa disfunzione ventricolare sinistra, l’elevato burden aritmico, la lunga storia di CKD severa e l’anatomia coronarica favorevole per la rivascolarizzazione percutanea [2]. Si poneva quindi indicazione all’esecuzione di staged Protected PCI con il dispositivo di supporto al circolo Impella CP, una pompa micro-assiale intravascolare che viene posizionata per via retrograda in posizione trans-valvolare aortica che, aspirando il sangue dal ventricolo sinistro per espellerlo direttamente in aorta ascendente, permette l’unloading ventricolare offrendo un flusso continuo, non pulsatile, fino a 4 L/min. Tre giorni dopo la PCI primaria, il paziente viene quindi condotto nuovamente nel Laboratorio di Emodinamica per essere sottoposto alla procedura. Il device veniva impiantato per via percutanea arteriosa femorale sinistra, attraverso un introduttore di 14 Fr. Il Tronco Comune veniva quindi sottoposto a multiple predilatazioni e successivamente trattato con l’impianto di un DES con un ottimo risultato angiografico finale (Figura 4).
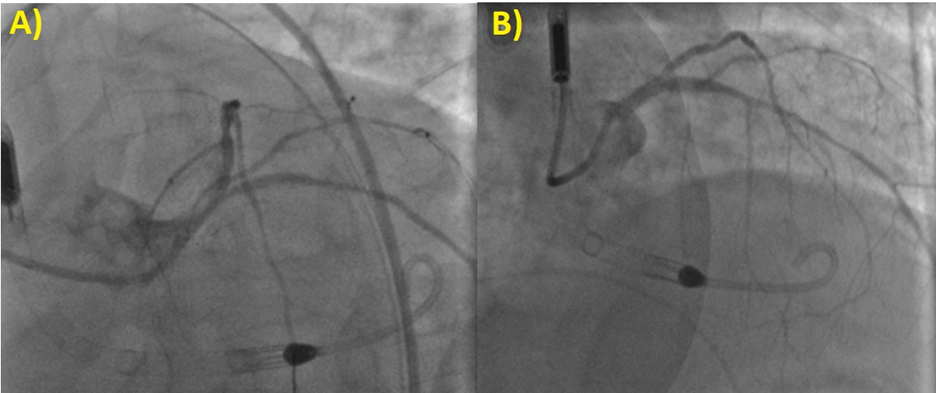
Al termine della procedura il paziente veniva condotto nuovamente in UTIC dove l’ecocolorDoppler cardiaco transtoracico evidenziava un corretto posizionamento dell’Impella con l’aliasing visibile oltre il piano valvolare aortico, in aorta ascendente e con il marker dell’inlet localizzato 4 cm al di sotto dell’anulus aortico (Figura 5).

Due giorni dopo la procedura si intraprendeva lo svezzamento del paziente dal device che veniva quindi rimosso con l’utilizzo del sistema di chiusura Manta® 14 Fr. Il resto della degenza trascorreva senza complicanze ed il paziente veniva dimesso in buone condizioni cliniche ed in stabilità emodinamica in decima giornata dalla Protected PCI.
DISCUSSIONE
Nei pazienti candidati a PCI ad alto rischio, l’Impella fornisce un supporto emodinamico e protegge dall’ischemia miocardica. Infatti, determinando un unloading diretto del ventricolo sinistro, consente un’immediata riduzione del lavoro miocardico e della richiesta di ossigeno. Simultaneamente il flusso coronarico aumenta con un miglioramento della perfusione sistemica attraverso un aumento della pressione arteriosa media e una riduzione della pressione tele-diastolica del ventricolo sinistro. L’Impella è inoltre un device dipendente dal precarico, ma non ritmo dipendente e garantisce un’azione continua, non pulsatile determinando quindi una gittata cardiaca e una pressione arteriosa media stabili. Grazie a queste caratteristiche, permette il mantenimento della stabilità emodinamica garantendo il tempo necessario per raggiungere la rivascolarizzazione completa. Solitamente andrebbe considerata ad alto rischio una PCI in presenza di specifici criteri clinici (disfunzione ventricolare sinistra con EF ≤35%, instabilità emodinamica, diabete mellito, ACS, CKD, pregressa chirurgia cardiaca) ed anatomici (CAD multivasale, malattia di Tronco Comune non protetto, malattia di biforcazione, presenza di CTO, lesioni severamente calcifiche) [3].
L’impiego dell’Impella nelle PCI ad alto rischio è stato valutato nella serie di studi PROTECT. Il PROTECT I ha evidenziato che il dispositivo Impella 2.5 è sicuro, facile da impiantare e garantisce un eccellente supporto emodinamico durante PCI ad alto rischio [4]. Successivamente il PROTECT II trial, uno studio prospettico multicentrico randomizzato ha confrontato IABP e Impella 2.5 nel setting di PCI elettiva ad alto rischio. Nel follow-up a 90 giorni, l’Impella è risultato associato ad una significativa riduzione degli eventi cardiovascolari maggiori (MACEs, Major Adverse Cardiovascular Events) rispetto all’IABP (p=0.023) con una riduzione del rischio relativo pari al 22% [5]. Infine, il successivo PROTECT III trial ha evidenziato una riduzione dei MACEs a 90 giorni con Protected PCI con Impella (2.5 and CP), comparato con i pazienti sottoposti a Protected PCI con Impella 2.5 arruolati nello studio PROTECT II [6]. Per quanto riguarda le raccomandazioni delle linee guida, un consensus document Europeo congiunto EAPCI/ACVC sull’impiego dei pVADs enuncia che l’impiego delle pompe micro-assiali, come l’Impella CP, potrebbe essere considerato in pazienti altamente selezionati candidati a PCI ad alto rischio secondo criteri clinici ed anatomici in caso di accessi femorali adeguati (diametro dell’arteria femorale comune >6 mm, in assenza di severe tortuosità) [7]. Una simile raccomandazione viene fornita dalle linee guida Americane ACC/AHA/SCAI riguardo la rivascolarizzazione miocardica (Classe IIb, livello di evidenza C) [8].
CONCLUSIONE
Le pompe micro-assiali (come l’Impella CP) rappresentano degli eccellenti devices per supportare le procedure di PCI ad alto rischio. Questi dispositivi garantiscono un supporto emodinamico durante la procedura, prevengono episodi di ipoperfusione e consentono un tempo sufficiente per raggiungere la rivascolarizzazione miocardica completa. Il PROTECT IV trial, attualmente in fase di arruolamento, fornirà probabilmente l’evidenza necessaria per ottenere in futuro una raccomandazione di Classe I nelle linee guida per l’impiego dell’Impella nelle PCI ad alto rischio.
BIBLIOGRAFIA
[1] Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD; Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018 Nov 13;138(20):e618-e651.
[2] Park DW, Park SJ. Percutaneous Coronary Intervention of Left Main Disease: Pre- and Post-EXCEL (Evaluation of XIENCE Everolimus Eluting Stent Versus Coronary Artery Bypass Surgery for Effectiveness of Left Main Revascularization) and NOBLE (Nordic-Baltic-British Left Main Revascularization Study) Era. Circ Cardiovasc Interv. 2017 Jun;10(6):e004792.
[3] Leick J, Werner N, Mangner N, Panoulas V, Aurigemma C. Optimized patient selection in high-risk protected percutaneous coronary intervention. Eur Heart J Suppl. 2022 Dec 8;24(Suppl J):J4-J10.
[4] Dixon SR, Henriques JP, Mauri L, Sjauw K, Civitello A, Kar B, Loyalka P, Resnic FS, Teirstein P, Makkar R, Palacios IF, Collins M, Moses J, Benali K, O’Neill WW. A prospective feasibility trial investigating the use of the Impella 2.5 system in patients undergoing high-risk percutaneous coronary intervention (The PROTECT I Trial): initial U.S. experience. JACC Cardiovasc Interv. 2009 Feb;2(2):91-6.
[5] O’Neill WW, Kleiman NS, Moses J, Henriques JP, Dixon S, Massaro J, Palacios I, Maini B, Mulukutla S, Dzavík V, Popma J, Douglas PS, Ohman M. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intra-aortic balloon pump in patients undergoing high-risk percutaneous coronary intervention: the PROTECT II study. Circulation. 2012 Oct 2;126(14):1717-27.
[6] O’Neill WW, Anderson M, Burkhoff D, Grines CL, Kapur NK, Lansky AJ, Mannino S, McCabe JM, Alaswad K, Daggubati R, Wohns D, Meraj PM, Pinto DS, Popma JJ, Moses JW, Schreiber TL, Magnus Ohman E. Improved outcomes in patients with severely depressed LVEF undergoing percutaneous coronary intervention with contemporary practices. Am Heart J. 2022 Jun;248:139-149.
[7] Chieffo A, Dudek D, Hassager C, Combes A, Gramegna M, Halvorsen S, Huber K, Kunadian V, Maly J, Møller JE, Pappalardo F, Tarantini G, Tavazzi G, Thiele H, Vandenbriele C, Van Mieghem N, Vranckx P, Werner N, Price S. Joint EAPCI/ACVC expert consensus document on percutaneous ventricular assist devices. EuroIntervention. 2021 Jul 20;17(4):e274-e286.
[8] Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. Circulation 2022;145:e18–e114.
Info sull'autore