Dario Fabiani1, Andrea Vergara1, Fabrizia Terracciano1, Antonio De Pasquale1, Paolo Calabrò1
1. Dipartimento di Scienze Mediche Traslazionali, Università degli Studi della Campania “Luigi Vanvitelli”, A.O.R.N. Sant’Anna e San Sebastiano, Caserta
ABSTRACT
L’endocardite infettiva (EI) su protesi valvolare costituisce la forma più severa di EI e si verifica nell’1-6% dei pazienti portatori di protesi valvolare (1). Rappresenta il 10-30% di tutti i casi di EI e colpisce in egual misura sia le protesi meccaniche che biologiche, provocando solitamente la comparsa di insufficienza protesica, e più raramente anche all’ostruzione di protesi. La conoscenza delle indicazioni all’intervento cardochirurgico, il timing dell’intervento e il ruolo dell’ “Endocarditis Team”, risultano fondamentali ai fini terapeutici. Riportiamo il caso clinico di un paziente di 75 anni in cui è stato riscontrato un blocco atrioventricolare di III grado secondario a un’EI della protesi biologica aortica con estensione perivalvolare. Il corretto inquadramento anamnestico-laboratoristico associato all’accuratezza diagnostica delle tecniche di imaging (ecocardiogramma transesofageo, TEE), sono risultati fondamentali ai fini prognostici.
CASO CLINICO
Presentiamo il caso clinico di un uomo di 75 anni, affetto da ipertensione arteriosa sistemica, dislipidemia, diabete mellito di tipo 2, portatore di protesi biologica aortica da circa 7 anni. Il paziente in questione si è presentato al nostro Dipartimento di Emergenza e Accettazione riferendo storia di febbricola intermittente (T 37.5°C) da qualche settimana, associata ad astenia marcata e bradicardia. A domicilio era stato trattato empiricamente con farmaci antibiotici e anti-infiammatori senza ottenere una franca risoluzione della sintomatologia. Al momento della nostra valutazione, le condizioni generali del paziente erano scadute.
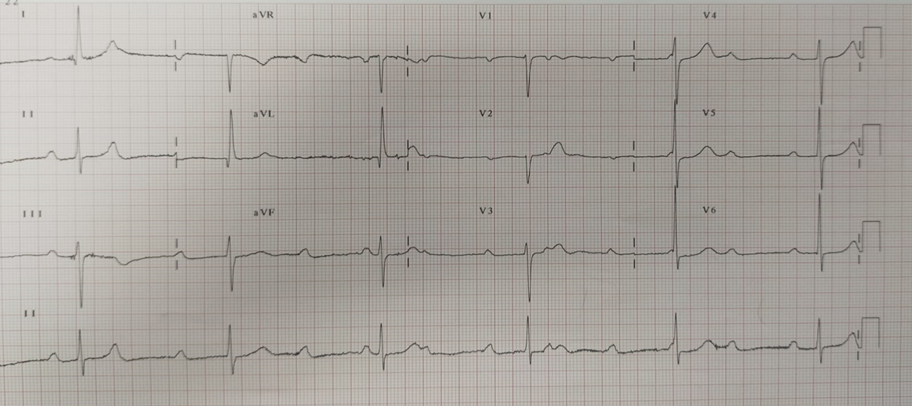
Obiettivamente presentava ipotensione (PA 90/50 mmHg), bradicardia marcata (Fc 35 bpm), SpO2 90% in aria ambiente e temperatura corporea pari a 38°C. All’ECG di superficie a 12 derivazioni si diagnosticava un BAV di III grado a frequenza ventricolare di 35 bpm (Figura 1). Dopo aver escluso disionie e altre cause reversibili di blocco atrio-ventricolare, veniva posizionato un PMK temporaneo per via venosa transfemorale con stabilizzazione del quadro clinico-emodinamico. Gli esami di laboratorio eseguiti in urgenza, mostravano una leucocitosi neutrofila (GB 19.000/mm3 con 90% di neutrofili) associata ad anemia (Hg 8.6 g/dL) e ad incremento degli indici di flogosi (VES, PCR e pro calcitonina). Considerando la storia anamnestica del paziente e gli esami di laboratorio, entrambi suggestivi di endocardite infettiva, veniva posta indicazione all’ esecuzione di TEE a completamento diagnostico.
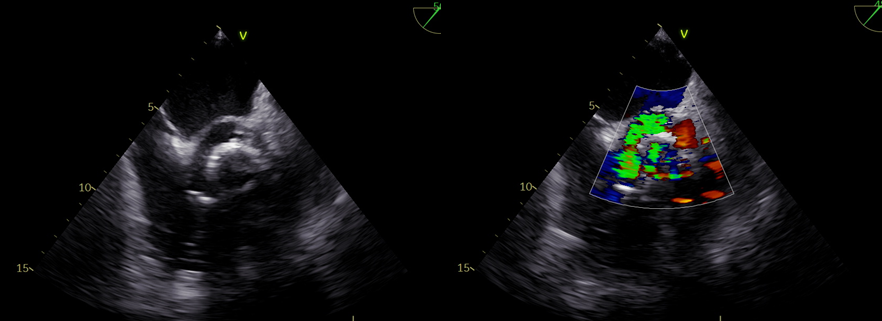
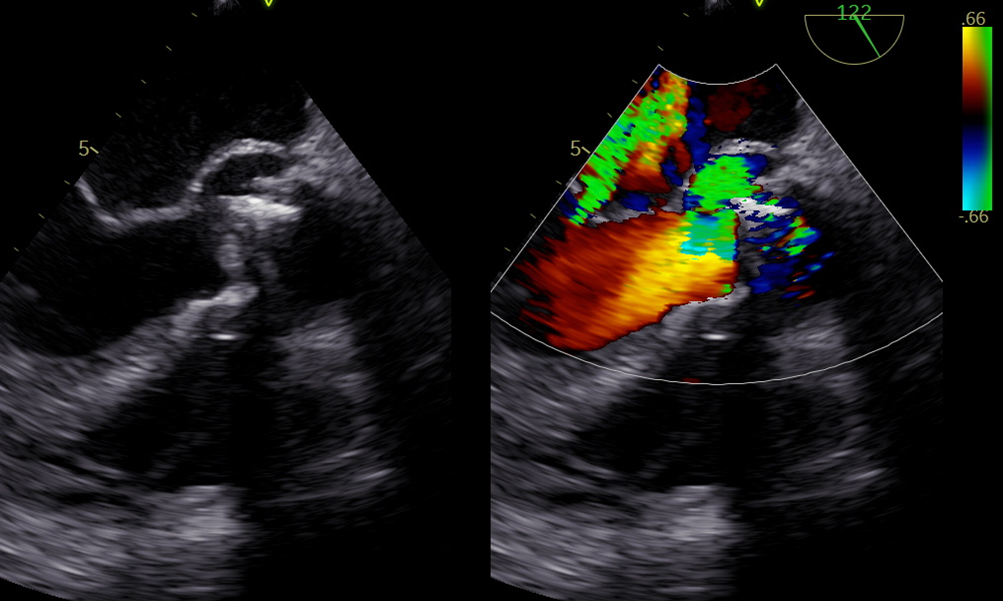
Si evidenziava, pertanto, la presenza di una cavità a contenuto anecogeno a sede periprotesica, con estensione alla fibrosa intervalvolare mitro-aortica, fistolizzata nel tratto di efflusso del ventricolo sinistro con presenza di flusso color-Doppler al suo interno (Figura 2 e Figura 3). Il reperto ecocardiografico descritto era quindi compatibile con la diagnosi di pseudoaneurisma periprotesico aortico. Si associava a questo, l’evidenza di deiscenza totale ed instabilità della protesi biologica aortica.
Il paziente veniva, quindi, trasferito presso la nostra terapia intensiva cardiologica dove si praticavano emocolture seriate e veniva impostata terapia antibiotica empirica ad ampio spettro. In terza giornata di degenza, il laboratorio comunicava il risultato dell’esame colturale, con l’isolamento di Staphilococco Aureo meticillino-resistente (MRSA) per cui veniva posta diagnosi di endocardite infettiva in base ai criteri di Duke modificati (1). Il caso veniva sottoposto a discussione da parte dell’ “Endocarditis Team”, che poneva indicazione ad effettuare l’intervento cardochirurgico urgente in accordo con le ultime linee guida ESC in tema di EI (1). Il paziente veniva quindi sottoposto, con successo, ad intervento cardochirurgico di ricostruzione della fibrosi mitro-aortica con patch e sostituzione della bioprotesi aortica con nuova protesi. Il decorso post-operatorio è stato regolare. La terapia antibiotica endovena è stata proseguita per ulteriori 4 settimane. A negativizzazione ottenuta degli esami colturali, il paziente è stato sottoposto ad impianto di pace-maker definitivo. Al follow-up a 6 mesi, il paziente si presentava apiretico e in buone condizioni cliniche generali.
DISCUSSIONE
Un’EI viene definita “non controllata” nel caso di persistenza dell’agente patogeno nonostante antibioticoterapia o, in alternativa, in presenza di un’infezione ad estensione locale perivalvolare. Le infezioni non controllate rappresentano una delle complicanze più temibili dell’EI e generalmente sono causate da microrganismi resistenti alla terapia antibiotica oppure particolarmente virulenti. La formazione di ascessi, pseudoaneurismi e fistole, rappresenta la causa più comune di EI “non controllata” (1). Essi sono associati ad una prognosi sfavorevole e il loro riscontro costituisce un’indicazione ad un intervento cardochirurgico urgente.
La formazione di ascessi perivalvolari è comune nei portatori di protesi valvolari aortiche (56-100%) e la localizzazione più frequente è a livello della fibrosa intervalvolare mitro-aortica (2). Nonostante i tassi di ricorso alla chirurgia in questa popolazione siano elevati (87%), la mortalità intraospedaliera rimane alta (41%). Altre complicanze correlate ad una significativa estensione locale dell’infezione, soprattutto a livello aortico, sono l’insorgenza di difetti del setto interventricolare, di blocchi atrioventricolari e, più raramente, le sindromi coronariche acute (3). La persistenza di febbre di origine sconosciuta associata allo sviluppo di blocchi atrioventricolari devono indurre a sospettare un’ EI con insorgenza di complicanze periprotesiche, soprattutto se l’infezione è localizzata a livello aortico. Dopo la diagnosi, in caso di iniziale strategia conservativa, è importante l’esecuzione di controlli TEE seriati, eseguiti in corso di terapia antibiotica mirata, specialmente nei casi di EI su protesi valvolare aortica. Tuttavia ascessi di piccole dimensioni, soprattutto se localizzati in sede mitralica con coesistente calcificazione dell’anulus, posso risultare misdiagnosticati con tale metodica. Il ricorso all’imaging multimodale, mediante l’integrazione di vantaggi e svantaggi di varie metodiche come TEE, TAC cardiaca e PET/TC, consente una migliore accuratezza diagnostica (4).
Bibliografia
- Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, Dulgheru R, El Khoury G, Erba PA, Iung B, Miro JM, Mulder BJ, Plonska-Gosciniak E, Price S, Roos-Hesselink J, Snygg-Martin U, Thuny F, Tornos Mas P, Vilacosta I, Zamorano JL; ESC Scientific Document Group. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015 Nov 21;36(44):3075-3128
- Graupner C, Vilacosta I, SanRomán J, Ronderos R, Sarriá C, Fernández C, Mújica R, Sanz O, Sanmartín JV, Pinto AG. Periannular extension of infective endocarditis. J Am Coll Cardiol. 2002 Apr 3;39(7):1204-11.
- Anguera I, Miro JM, San Roman JA, de Alarcon A, Anguita M, Almirante B, Evangelista A, Cabell CH, Vilacosta I, Ripoll T, Munoz P, Navas E, Gonzalez-Juanatey C, Sarria C, Garcia-Bolao I, Farinas MC, Rufi G, Miralles F, Pare C, Fowler VG Jr, Mestres CA, de Lazzari E, Guma JR, del Rio A, Corey GR. Periannular complications in infective endocarditis involving prosthetic aortic valves. Am J Cardiol 2006;98:1261–1268.
- Thuny F, Gaubert JY, Jacquier A, Tessonnier L, Cammilleri S, Raoult D, Habib G. Imaging investigations in infective endocarditis: current approach and perspectives. Arch Cardiovasc Dis 2013;106:52–62.
