Riscontro occasionale di trombo in auricola atriale destra in un giovane paziente con scompenso cardiaco congestizio e in ritmo sinusale
Cinzia Pece1,2, Denisa Muraru1,2, Michele Tomaselli1,2, Francesco Paolo Perelli1,2, Noela Radu3
1 University of Milano-Bicocca, Milan, Italy
2 Istituto Auxologico Italiano, IRCCS, San Luca Hospital, Milan, Italy
3 Carol Davila University of Medicine and Pharmacy, Prof. Dr. C. C. Iliescu Institute, Bucharest, Romania
ABSTRACT
L’ amiloidosi cardiaca (CA) è una malattia infiltrativa caratterizzata dalla deposizione di aggregati di fibrille amiloidi nel miocardio. La diagnosi di CA richiede un approccio completo basato su esame fisico, esami di laboratorio, imaging multimodale e istologia. La CA è associata ad un aumento del rischio tromboembolico (TE), anche nei pazienti con ritmo sinusale. La particolarità del nostro caso è il riscontro incidentale di un trombo in auricola atriale destra in un paziente con amiloidosi cardiaca estesa e insufficienza cardiaca senza alcuna evidenza di aritmia atriale, ma con segni all’imaging suggestivi di una “miopatia” atriale bilaterale e disfunzione biventricolare.
PRESENTAZIONE CASO CLINICO
Il protagonista del caso clinico è un uomo di 47 anni con una recente storia clinica di scompenso cardiaco congestizio trattato con diuretici presso un Presidio Ospedaliero periferico, il quale giungeva alla nostra attenzione per eseguire una TC coronarica. La CCT mostrava assenza di malattia aterosclerotica coronarica significativa e rilevava una regione ipodensa in corrispondenza dell’auricola atriale destra (RAA), sollevando il sospetto di un trombo. Il paziente pertanto è stato ricoverato presso il reparto di Cardiologia Acuti dell’Ospedale Auxologico San Luca di Milano per eseguire maggiori accertamenti.
WORK UP DIAGNOSTICO INIZIALE
Alla visita il paziente era sintomatico per dispnea ai minimi sforzi e dolore toracico e presentava edemi declivi e turgore giugulare. L’elettrocardiogramma (ECG) mostrava tachicardia sinusale, assente progressione dell’onda R nelle derivazioni precordiali e onde T negative in sede inferolaterale. I primi test di laboratorio hanno mostrato aumento dei livelli di BNP (766 ng/L), troponina (hsTnT 19 ng/L) e ALT (94 U/L). L’ecocardiogramma transtoracico (TTE) ha rivelato un’ipertrofia concentrica significativa del ventricolo sinistro (massimo spessore del setto interventricolare 20 mm, spessore relativo della parete 0,74, massa LV 177 g/m 2) con aspetto del miocardio a ‘’granular-sparkling’’ e FEVS lievemente ridotta. La deformazione miocardica longitudinale del ventricolo sinistro era gravemente compromessa (GLS = -9,5%), con aumento del rapporto di deformazione apice-base (4,4) indicativo di pattern “apical sparing “. Per quanto riguarda la funzione diastolica si registrava un pattern transmitralico di tipo restrittivo (E/A = 2,1, E/e’ = 20), dilatazione bi-atriale con reservoir strain atriale ridotto, setto interatriale ispessito e valvole atrio-ventricolari anch’esse ispessite senza rigurgiti significativi (Figura 1). Infine, anche il ventricolo destro aveva pareti ispessite e segni di disfunzione sistolica (deformazione della parete libera del RV, RVFWS = -15,2%; EF 3D = 40,9%; TAPSE = 11 mm). Il 3DTTe ha mostrato anche una valvola tricuspide con morfologia quadricuspide (tipo IIIb – due lembi posteriori) (Figura 2).
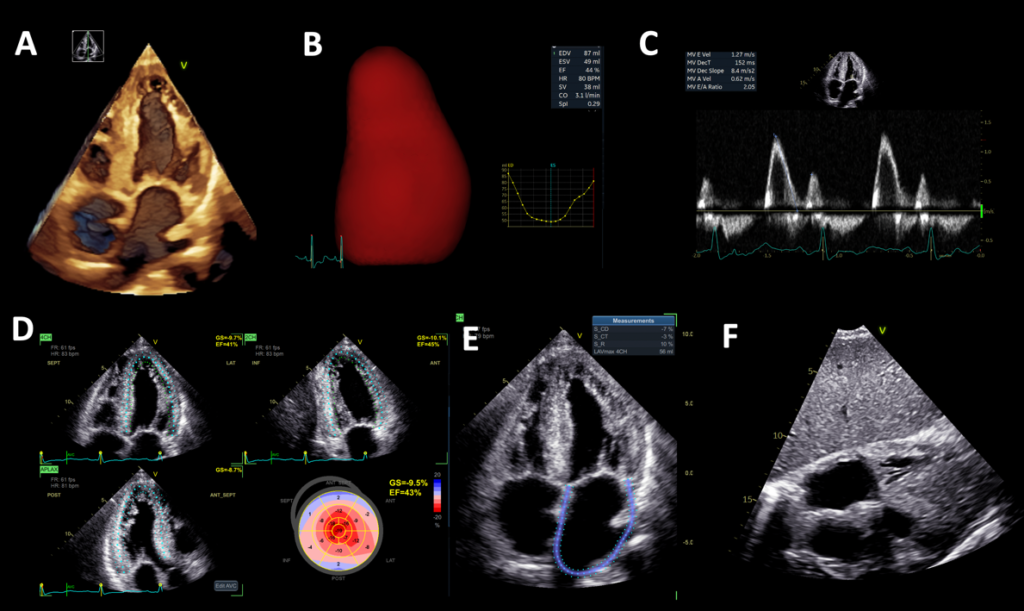
Figura 1. Panel A, 3DTTE sezione apicale 4 camere che mostra aumento diffuso dello spessore del ventricolo sinistro, ingrandimento biatriale e aumentato spessore dei lembi mitralici.
Panel B, TTE quantificazione volumetrica 3D del ventricolo sinistro, che mostra una piccola cavità ventricolare con ridotto stroke volume e LVEF lievemente ridotta (44%).
Panel C, Pattern di flusso transmitralico restrittivo.
Panel D, GLS ridotto (-9,5%) con pattern di risparmio apicale.
Panel E, Atrio sinistro dilatato con marcata riduzione dei parametri di deformazione longitudinale (reservoir strain serbatoio 10%).
Panel F, TTE sezione sottocostale, ispessimento del setto interatriale.
L’ecocardiogramma transesofageo (TEE) ha confermato la presenza di una massa mobile rotondeggiante di 14 x 12 mm in RAA compatibile con formazione trombotica (Figura 2). L’appendice atriale sinistra invece era priva di trombi, con contrazione ritmica e ridotta velocità di svuotamento (37 cm/s).
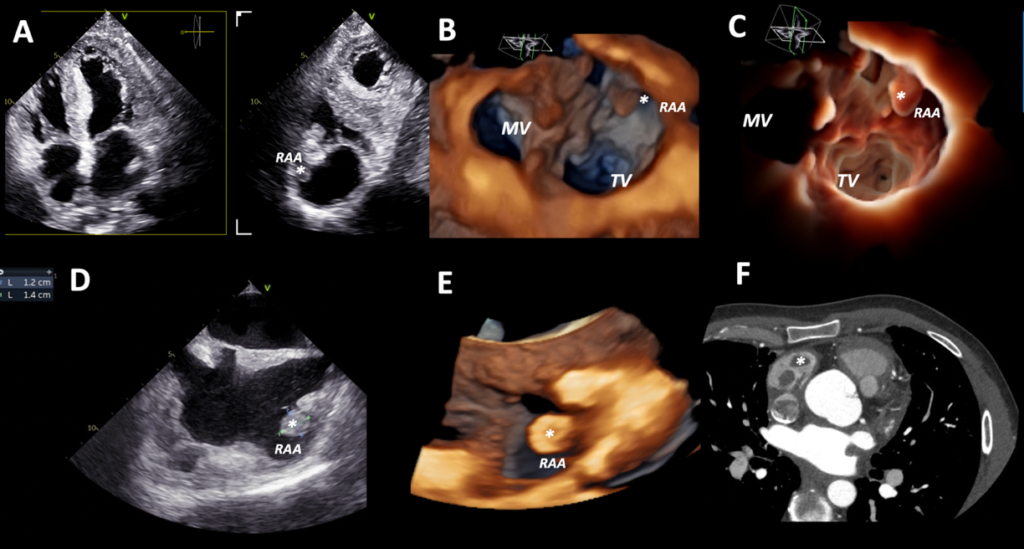
Figura 2. Panel A, 2DTTE (sezioni apicale 4-camere e 2-camere ortogonale) che mostra una massa suggestiva per trombo (asterisco) al livello di RAA nella sezione 2-camere.
Panel B, 3DTTE visione chirurgica dell’atrio destro che mostra una massa sporgente nella cavità atriale destra proveniente dall’auricola destra (asterisco).
Panel C, 3DTTE visione chirurgica atrio destro ottenuta con nuovo filtro ‘transillumination’ in flexi-light focalizzato su atrio destro, che mostra in modo più netto la morfologia della massa e la sua localizzazione spaziele in RAA (asterisco).
Panel D, massa in RAA visualizzata in TEE sezione bicavale; si nota il marcato ispessimento del setto interatriale che risparmia la fossa ovale.
Panel E, trombo visualizzato in 3DTEE.
Panel F, trombo visualizzato alla CCT.
DIAGNOSI E GESTIONE
Dato l’alto sospetto di malattia infiltrativa, è stata eseguita la Risonanza Magnetica Cardiaca (CMR) per la caratterizzazione tissutale, come raccomandato dal Position Statement del 2021 dell’ESC Working Group sulle malattie del Miocardio e del Pericardio (1). L’esame ha confermato lo spessore diffusamente aumentato di entrambi i ventricoli e una lieve disfunzione biventricolare (LVEF per CMR 48%, RVEF per CMR 46%). Inoltre, l’indagine ha mostrato un diffuso LGE, un marcato aumento del volume extracellulare (49%) e dei valori di T1 mapping (valori globali 1110 ± 76 ms) (Figura 3). Inoltre, si riscontravano versamento pleurico bilaterale e minimo versamento pericardico. Questi reperti sono altamente indicativi di CA, per cui, al fine di determinarne il fenotipo, abbiamo deciso di eseguire la scintigrafia con bifosfonati, che ha mostrato una captazione miocardica di radiotracciante di grado inferiore rispetto a quello osseo (Perugini Grado 1): pattern non specifico per l’amiloidosi ATTR ma che non ha escluso un’amiloidosi AL. Ulteriori test di laboratorio hanno mostrato catene leggere tipo lambda (FLC) aumentate con rapporto FLC kappa-lambda ridotto. A questo punto la biopsia extracardiaca si è rivelata decisiva per la diagnosi di amiloidosi AL, risultando positiva per sostanza amiloide. Per concludere, la biopsia del midollo osseo ha riscontrato un sottostante mieloma multiplo. Data l’evidenza di trombo RAA, è stata intrepresa la terapia anticoagulante con eparina a basso peso molecolare embricata con warfarin ed è stata impostata terapia medica con diuretici e beta-bloccante. Il paziente si è mantenuto in ritmo sinusale durante tutto il ricovero.
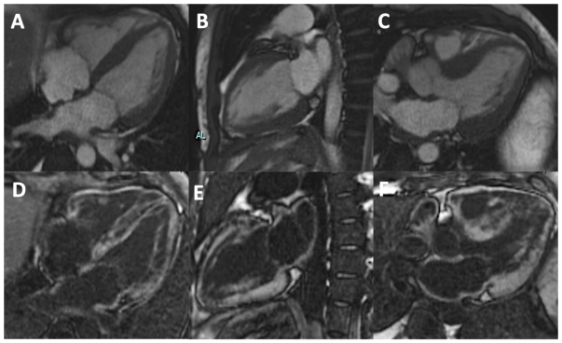
Figura 3. Cine CMR 4-camere, 2-camere, 3-camere (Panels A-C) e immagini PSIR MOCO LGE (Panels D-F) che mostrano segni caratteristici di CA: diffuso aumento dello spessore biventricolare, atri dilatati, esteso delayed enhancement (LGE) che coinvolge tutte le camere cardiache e minimo versamento pericardico.
FOLLOW UP
Il paziente è stato trasferito presso un centro specializzato in amiloidosi, in cui ha intrapreso trattamento chemioterapico dedicato.
CONCLUSIONI
La CA è una malattia infiltrative caratterizzata dalla deposizione di aggregate di fibrille amiloidi nel miocardio. É chiamata ‘il grande mimo’ per per le somiglianze con la cardiomiopatia ipertrofica geneticamente determinate e le malattie da accumulo (2). La diagnosi di CA richiede un alto indice di sospetto e, in quell caso, è relativamente semplice diagnosticarla grazie alla disponibilità di indagini diagnostiche di imaging multimodale.
La CA è associata ad aumentato rischio tromboembolico, anche in pazienti con ritmo sinusale. I fattori di rischio per trombi intracardiaci sono: il sottotipo AL, la disfunzione biventricolare, fibrillazione atriale, miopatia atriale, elevato volume extracellulare alla CMR (3).
Attualmente, le principali indicazioni per una terapia anticoagulante a lungo termine in questi pazienti sono la fibrillazione atriale (indipendentemente dal CHADS2-VaSC score), trombosi venosa profonda e/o embolia polmonare, sindrome nefrosica e trombi intracardiaci riscontrati accidentalmente durante un esame strumentale (4).
In ogni caso, bisogna considerare anche il rischio emorragico, che è aumentato nei pazienti con sottotipo AL con coinvolgimento epatico o gastrointestinale, disordini della coagulazione, insufficienza renale e in trattamento chemioterapico.
BIBLIOGRAFIA
- Garcia-Pavia P., Rapezzi C., Adler Y., Arad M., Basso C., Brucato A., et al. Diagnosis and treatment of cardiac amyloidosis. A position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur J Heart Fail. 2021 Apr; 23(4):512-526.
- Rapezzi, C., Lorenzini, M., Longhi, S., et al. Cardiac amyloidosis: the great pretender. Heart Failure Reviews 20, 117-124 (2015).
- Nicol M., Siguret V., Vergaro G., et al. Thromboembolism and bleeding in systemic amyloidosis: a review. ESC Heart Failure. 2022 Feb; 9(1): 11-20.
- Nicol M, Siguret V, Vergaro G, Aimo A, Emdin M, Dillinger JG, et al. Thromboembolism and bleeding in systemic amyloidosis: a review. ESC Heart Fail. 2022 Feb;9(1):11-20.
Info sull'autore