Procedura combinata di chiusura dell’auricola sinistra e crioablazione di fibrillazione atriale guidata da minimalistic approach imaging
Autori: Marco Legnazzi 1,2, Francesco Scardaci 2, Andrea Porto 2, Emanuela Di Simone 2, Alessandro Di Giorgio 2, Salvatore Azzarelli 2, Salvatore Davide Tomasello 2, Vincenzo Argentino 2, Francesco Amico 2
Affiliazioni:
1 Divisione di Cardiologia, AOU Policlinico “G. Rodolico – San Marco”, Scuola di Specializzazione in Malattie dell’Apparato Cardiovascolare, Università degli Studi di Catania, Catania
2 Unità Operativa Complessa di Cardiologia con Emodinamica ed UTIC, Azienda Ospedaliera per l’Emergenza Cannizzaro, Catania
ABSTRACT: La chiusura percutanea dell’auricola sinistra è emersa come sicura ed efficace alternativa alla terapia anticoagulante, fino a guadagnarsi, nelle linee guida, una raccomandazione di classe II B per la prevenzione dello stroke in pazienti affetti da fibrillazione atriale con controindicazione all’anticoagulazione. L’ablazione transcatetere della fibrillazione atriale rappresenta una strategia efficace di controllo del ritmo, con varie classi di raccomandazione in base alle caratteristiche cliniche. In questo caso clinico, presentiamo un paziente ad elevato rischio emorragico, con frequenti episodi di fibrillazione atriale parossistica, refrattari alla terapia antiaritmica, sottoposto ad una procedura combinata: chiusura percutanea dell’auricola sinistra e isolamento delle vene polmonari con crioenergia, sotto guida ecografica con sonda endocavitaria utilizzata per via transesofagea.
CASO CLINICO
Un paziente di 69 anni, iperteso, afferiva all’ambulatorio di Cardiologia del nostro ospedale. In anamnesi importante storia di turbe del ritmo: 3 anni addietro ablazione transcatetere di flutter atriale tipico comune, 6 mesi addietro sincopi recidivanti per bradicardia sinusale, per cui era stato sottoposto ad impianto di pacemaker bicamerale. Da allora lamentava frequenti episodi parossistici e fortemente sintomatici di fibrillazione atriale (FA), documentati da diverse registrazioni dinamiche dell’ECG secondo Holter. Nel follow-up ambulatoriale era stata impostata terapia anticoagulante con edoxaban e terapia antiaritmica massimale, dapprima con flecainide ed in seguito, data la scarsa risposta, con amiodarone, senza però ottenere beneficio in termini di riduzione numerica degli episodi di FA e di miglioramento della sintomatologia subiettiva.
All’ecocardiogramma, condotto in ritmo sinusale, si rilevava buona funzione contrattile globale e segmentaria con FEVS 55%, assenza di valvulopatie di rilievo, atrio sinistro ai limiti alti della norma (32 mL/mq). In considerazione della refrattarietà alla terapia medica e dell’assenza di evidenti alterazioni del substrato atriale, si programmava ablazione transcatetere con isolamento delle vene polmonari. Inoltre, il paziente presentava numerose comorbilità che delineavano un elevato rischio emorragico (HAS BLED score 4): linfoma a cellule B in fase di remissione post-splenectomia, epatopatia HBV-correlata, poliposi del colon con frequenti sanguinamenti e già sottoposta a polipectomia, 2 pregresse ospedalizzazioni per severa anemia in cui sono state necessarie trasfusioni di emazie concentrate. Sulla base del notevole rischio di sanguinamento, attribuibile a cause non reversibili, si è deciso di sottoporre il paziente anche a chiusura percutanea dell’auricola sinistra (LAAC – left atrial appendage closure), nella stessa seduta procedurale dell’ablazione di FA, per ridurre i tempi di ricovero e recupero.
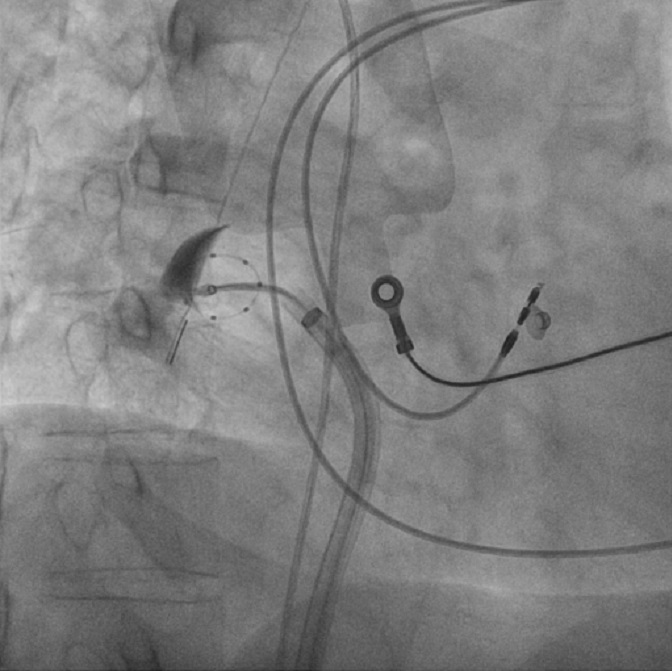
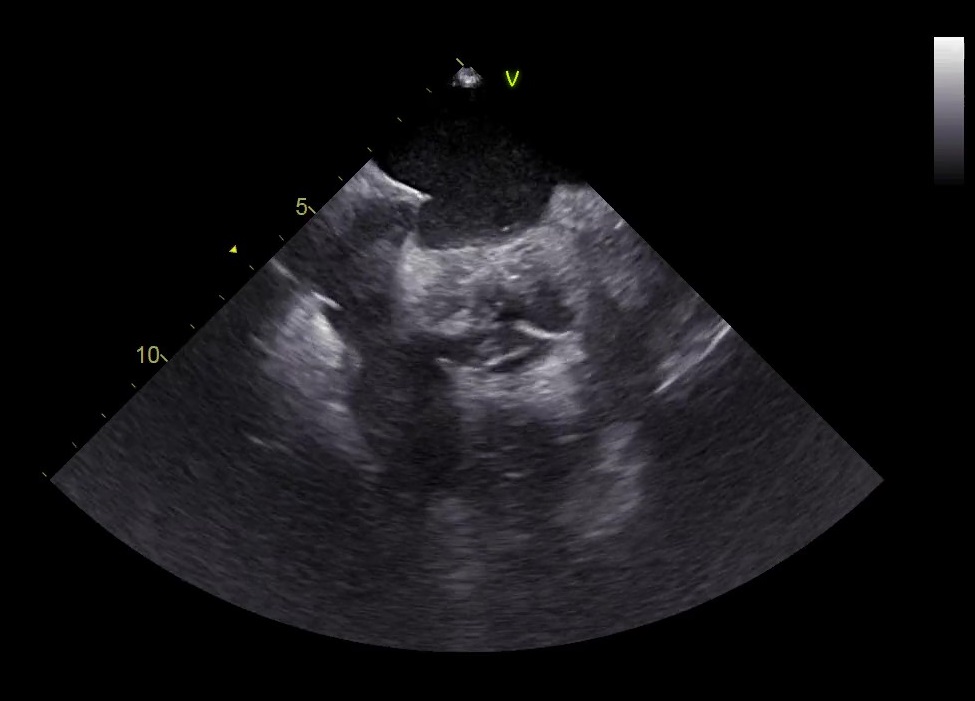
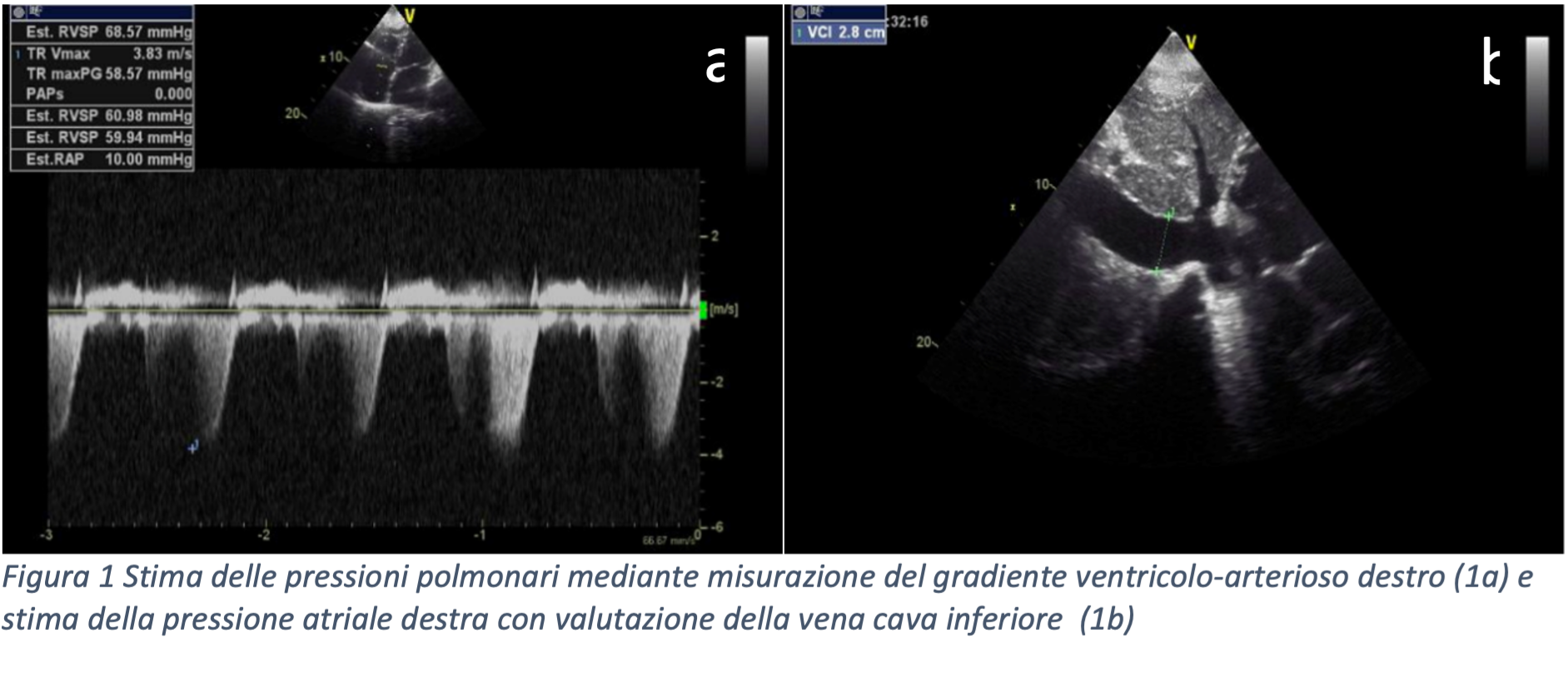
Previo accesso venoso femorale destro e sedazione con midazolam e fentanyl, è stato introdotto catetere Siemens® AcuNav ICE (Intra Cardiac Echocardiography) 8F in esofago. Puntura transettale con guida fluoroscopica ed ecografica (Figura 1) e inizio della procedura con la crioablazione: isolamento delle vene polmonari (PVI – pulmonary vein isolation) con erogazioni di crioenergia con tecnica “single-shot” (singola erogazione per vena polmonare, Figura 2), con tempo di erogazione totale di 14 minuti. Al termine dell’ablazione, ritmo sinusale a FC di 65 bpm, con evidenza di blocco di conduzione efficace in entrata ed uscita delle vene polmonari. Si procedeva dunque a studio dell’anatomia dell’auricola con guida angiografica ed ecografica e veniva scelta e impiantata una bioprotesi Boston Scientific® Watchman FLX 20 mm. La durata totale della procedura è stata di 1 ora e 44 minuti. Il paziente veniva dimesso dopo 4 giorni in buone condizioni cliniche generali. Sulla base dei dati disponibili, per minimizzare il rischio di sanguinamento mantenendo una bassa incidenza di trombosi device-correlata, è stato scelto di somministrare per 1 mese edoxaban 60 mg e poi acido acetilsalicilico 100 mg per ulteriori 3 mesi. Al follow-up a 2 mesi, il paziente risulta essere in ritmo sinusale, senza alcun episodio di cardiopalmo, con auricola priva di stratificazioni trombotiche e leak residui.
DISCUSSIONE
In letteratura, molti trial randomizzati e studi osservazionali hanno confrontato la PVI con radiofrequenza e con criopalloni, perlopiù nel contesto di una prima procedura per FA parossistica, con risultati largamente sovrapponibili in termini di efficacia e sicurezza, con durata della procedura più corta per la crioablazione ma al prezzo di tempi di fluoroscopia maggiori. Alcuni studi però riportano una più breve ospedalizzazione e un minor tasso di complicanze con la crioablazione. Nell’ottica di minimizzare le complicanze e i tempi della procedura, già di per sé lunga poiché combinata con la LAAC, è stata scelta questa modalità di ablazione.
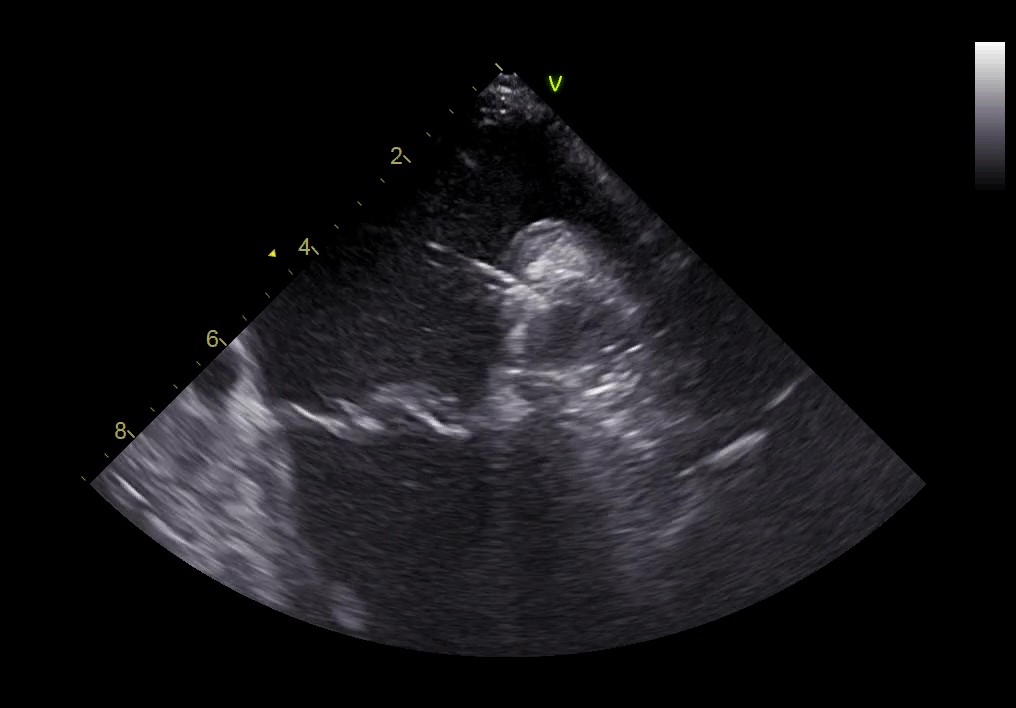
Il minimalistic approach, ovvero la guida ecografica della procedura attraverso sonda ICE endocavitaria inserita in esofago, è stato preferito perché il catetere dell’ICE, di 8 French di calibro, risulta molto più tollerabile rispetto alla sonda transesofagea classica e non impone l’anestesia generale, con possibilità di prediligere l’analgesia per aumentare la compliance del paziente, in una procedura combinata che per sua natura prevede una durata prolungata. L’uso “off-label” (transesofageo) dell’ICE non è stato ancora standardizzato e studiato su larga scala, non disponendo di dati randomizzati o di validi registri; esistono pochi case reports e case series con risultati promettenti in termini di efficacia e sicurezza. I limiti principali di tale approccio sono da riconoscere nell’elevato costo delle sonde monouso e nella variabilità della qualità delle immagini, non sempre comparabile a quella della sonda transesofagea classica, inoltre senza la possibilità di avere immagini biplanari o ricostruzioni 3D.
CONCLUSIONE
La procedura combinata di LAAC e crioablazione di FA è una strategia interessante, con il vantaggio di eseguire due interventi da singolo accesso e singola puntura transettale, con anestesia locale e blanda analgesia. Ha mostrato, in studi osservazionali e case series, buona efficacia, feasibility e sicurezza, in cui risulta fondamentale la selezione del paziente (indicazioni forti alla LAAC e all’ablazione). Il minimalistic approach da noi proposto per l’imaging ecografico procedurale, con sonda ICE utilizzata per via transesofagea, seppur off-label, aumenta la tollerabilità dell’intera procedura ed evita le possibili complicanze dell’anestesia generale, mantenendo spesso una buona qualità delle immagini per la guida della puntura transettale e per lo studio dell’anatomia dell’auricola.
BIBLIOGRAFIA
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC [published correction appears in Eur Heart J. 2021 Feb 1;42(5):507] [published correction appears in Eur Heart J. 2021 Feb 1;42(5):546-547] [published correction appears in Eur Heart J. 2021 Oct 21;42(40):4194]. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612
- Holmes DR Jr, Korsholm K, Rodés-Cabau J, Saw J, Berti S, Alkhouli MA. Left atrial appendage occlusion. EuroIntervention. 2023;18(13):e1038-e1065. Published 2023 Feb 6. doi:10.4244/EIJ-D-22-00627
- Asmarats L, O’Hara G, Champagne J, et al. Short-Term Oral Anticoagulation Versus Antiplatelet Therapy Following Transcatheter Left Atrial Appendage Closure. Circ Cardiovasc Interv. 2020;13(8):e009039. doi:10.1161/CIRCINTERVENTIONS.120.009039
- Duthoit G, Silvain J, Marijon E, et al. Reduced Rivaroxaban Dose Versus Dual Antiplatelet Therapy After Left Atrial Appendage Closure: ADRIFT a Randomized Pilot Study. Circ Cardiovasc Interv. 2020;13(7):e008481. doi:10.1161/CIRCINTERVENTIONS.119.008481
- Faroux L, Cruz-González I, Arzamendi D, et al. Short-term direct oral anticoagulation or dual antiplatelet therapy following left atrial appendage closure in patients with relative contraindications to chronic anticoagulation therapy. Int J Cardiol. 2021;333:77-82. doi:10.1016/j.ijcard.2021.02.054
- Wintgens L, Romanov A, Phillips K, et al. Combined atrial fibrillation ablation and left atrial appendage closure: long-term follow-up from a large multicentre registry. Europace. 2018;20(11):1783-1789. doi:10.1093/europace/euy025
- Andrade JG, Wazni OM, Kuniss M, et al. Cryoballoon Ablation as Initial Treatment for Atrial Fibrillation: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021;78(9):914-930. doi:10.1016/j.jacc.2021.06.038
- Orsini AN, Kolias TJ, Strelich KR, Armstrong WF. Feasibility of transesophageal echocardiography with a ten-French monoplane probe. J Am Soc Echocardiogr. 2003;16(6):682-687. doi:10.1016/s0894-7317(03)00177-9




Related Posts