Un particolare caso di Sindrome di Wolff-Parkinson-White: non solo un problema elettrico
Sofia Capocci1, Francesca Rubino1, Martina Setti1, Caterina Butturini1, Giacomo Mugnai1,
Flavio Luciano Ribichini1
1 Università di Verona, Sezione di Cardiologia, Dipartimento di Medicina, Italia
Abstract
La sindrome di Wolff-Parkinson-White (WPW) è una patologia congenita con una prevalenza di 1 su 450 nella popolazione generale; la sua manifestazione clinica è caratterizzata dalla presenza di tachicardie reciprocanti da rientro atrioventricolare dovute alla presenza di uno o più fasci accessori. Illustriamo il caso clinico di un giovane paziente affetto da WPW che ha rivelato una cardiomiopatia sottostante di complessa e non univoca interpretazione.
Presentazione iniziale
Un uomo di 35 anni accedeva al Pronto Soccorso (PS) del nostro Ospedale per cardiopalmo. All’elettrocardiogramma (ECG) di ingresso si documentava una tachicardia a QRS largo con morfologia a blocco di branca sinistra e presenza di onda delta. (Fig.1). Si eseguivano manovre vagali senza beneficio, quindi si somministravano due boli di adenosina (6+12 mg) con ripristino del ritmo sinusale, confermando l’ipotesi del rientro atrio-ventricolare alla base dell’aritmia1. Al tracciato elettrocardiografico basale (successivo al ripristino del ritmo sinusale) si documentava la presenza di pre-eccitazione ventricolare (Fig. 2).
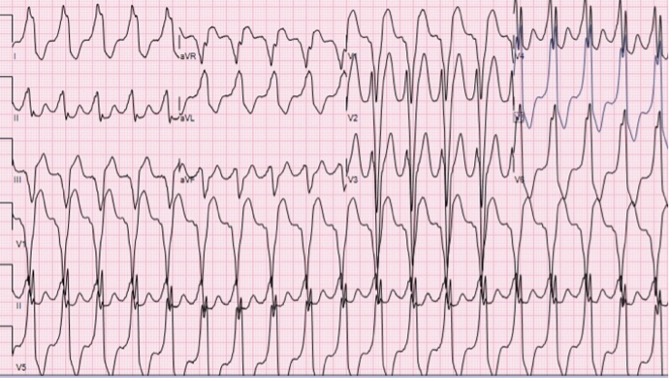
Fig. 1 ECG di presentazione in PS
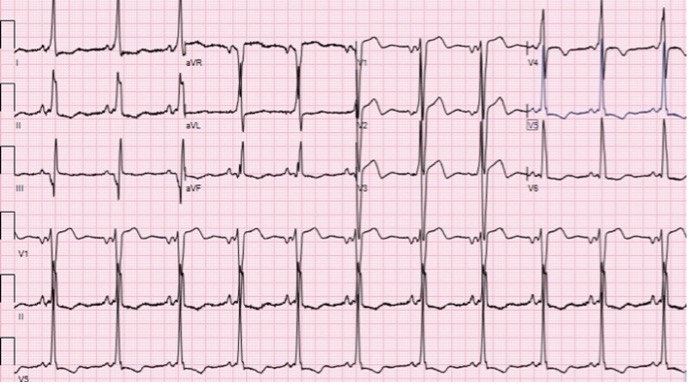
Fig. 2 ECG dopo ripristino di ritmo sinusale
Il paziente era affetto da sindrome di WPW già sottoposta in passato, presso altri centri, a due ablazioni di fascio di Kent occulto superoanteriore/anterolaterale destro con parziale successo (la prima all’età di 8 anni e la seconda all’età 20 anni). Non si segnalavano altre patologie in anamnesi e nessuna familiarità per problematiche cardiache.
Ad eccezione di un singolo episodio di tachicardia avvenuto nell’anno successivo all’ultima ablazione trattato con propafenone endovena, il paziente si era poi mantenuto in benessere soggettivo; aveva proseguito terapia antiaritmica per os con flecainide, eseguendo follow-up regolare. Nello specifico aveva eseguito ecocardiografie risultate sempre nella norma (l’ultima delle quali risalente a 5 anni prima rispetto all’accesso in PS) e test da sforzo al cicloergometro che segnalava scomparsa della pre-eccitazione ventricolare a frequenze cardiache elevate ed assenza di aritmie. Inoltre, agli ECG eseguiti durante le visite cardiologiche di controllo (l’ultimo dei quali risalente sempre a 5 anni prima rispetto all’accesso in PS) si evidenziava, talvolta, una minima pre-eccitazione ventricolare.
Il paziente lamentava però, negli ultimi mesi, sempre più frequenti episodi di cardiopalmo, circa 2-3 a settimana, di breve durata.
Il paziente si ricoverava pertanto nella Unità Operativa di Cardiologia per gli accertamenti del caso.
Iter diagnostico e trattamento
All’ingresso in reparto il paziente si presentava asintomatico; agli ematochimici si riscontrava un minimo incremento della Troponina T ed un rialzo dell’nt-pro-BNP (706 ng/L). Veniva eseguito ecocardiogramma trans-toracico che evidenziava una severa dilatazione e disfunzione del ventricolo sinistro con ipocinesia parietale diffusa (frazione di eiezione 26%), insufficienza mitralica di grado medio ed una iniziale disfunzione diastolica (E/A 1.2, E/e’12, dilatazione atriale sinistra di grado medio); la funzione ventricolare destra risultava nei limiti (Fig. 3).
In considerazione del quadro anamnestico e della presentazione clinica si poneva indicazione a nuovo studio elettrofisiologico con eventuale ablazione trans-catetere previa esecuzione di risonanza magnetica (RMN) cardiaca con gadolinio per il nuovo riscontro di disfunzione ventricolare sinistra.
La RMN confermava l’ipocinesia parietale diffusa del ventricolo sinistro con dissinergia settale e funzione sistolica globale severamente ridotta. Mostrava, inoltre, presenza di late gadolinium enhancement (LGE) a livello del setto anteriore basale, della parete inferiore medio-basale con distribuzione sub-epicardica e qualche più piccolo focus infero-laterale basale, con pattern fibrotico non ischemico; documentava assenza di aree di iper-intensità di segnale nelle sequenze T2 STIR ascrivibili ad edema intramiocardico ed assenza di aree di infiltrazione adiposa alle sequenze T1 dipendenti (Fig. 4).
Allo studio elettrofisiologico si evidenziava la presenza di due distinti fasci anomali di Kent, uno postero-settale destro (capace di conduzione anterograda e retrograda), e l’altro antero-laterale destro (capace solo di retrocondurre). In dettaglio, si inducevano due tipi di tachicardie atrio-ventricolari reciprocanti: una tachicardia da rientro atrioventricolare antidromica mediata da fascio di Kent postero-settale destro in senso anterogrado e da sistema nodo-hissiano in retrogrado; e l’altra ortodromica sostenuta in senso anterogrado da nodo-His e in senso retrogrado alternativamente da fascio di Kent antero-laterale destro e posterosettale destro. Il mappaggio mediante sistema elettro-anatomico non fluoroscopico (a raggi zero) permetteva di identificare ed eradicare il fascio di Kent postero-settale destro all’imbocco del seno coronarico, mentre il residuo fascio di Kent anterolaterale destro (sede di pregressa ablazione) veniva eradicato a ore 11 dell’anello tricuspidalico mediante mappaggio del segnale atriale retrogrado più precoce durante la tachicardia ortodromica. Eseguita pertanto ablazione efficace di entrambi i fascicoli anomali, residuava all’ECG blanda pre-eccitazione ventricolare che rimaneva invariata durante stimolazione atriale continua incrementale e programmata – con HV invariato – suggestiva di una connessione anomala di tipo atrio-hissiano (Fig 5). Al termine della procedura si documentava l’assenza di retroconduzione atriale durante stimolazione ventricolare. Non risultavano più inducibili tachicardie atrio-ventricolari reciprocanti.
Durante la restante degenza non si evidenziava alcun tipo di tachicardie rilevanti al monitoraggio telemetrico e si impostava terapia medica anti-neurormonale completa di ARNI, anti-aldosteronico, betabloccante e SGLT2 inibitore2.
Il paziente veniva dimesso con Life-Vest per salvaguardarlo da eventuali aritmie maligne, vista la severa disfunzione ventricolare e la giovane età, in attesa di rivalutazione clinica e strumentale dopo tre mesi di adeguata terapia anti-rimodellamento.
Il paziente verrà rivalutato presso il Day Hospital dello scompenso cardiaco con ecocardiografia di controllo e valutazione genetica (follow up in corso).
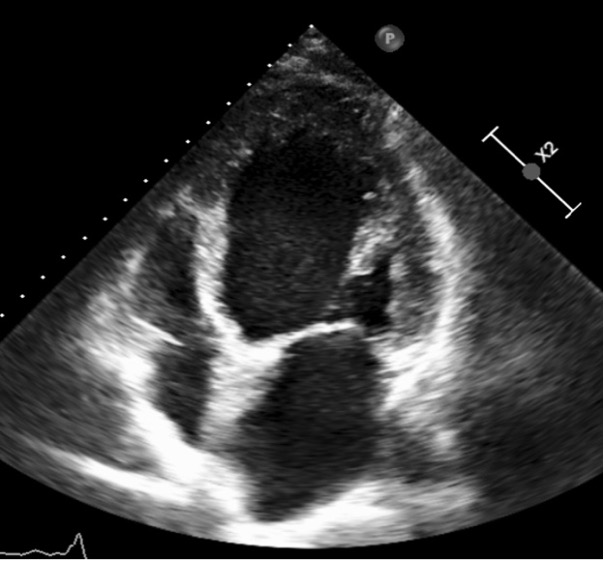
Fig. 3 Ecocardiografia (A4CH)
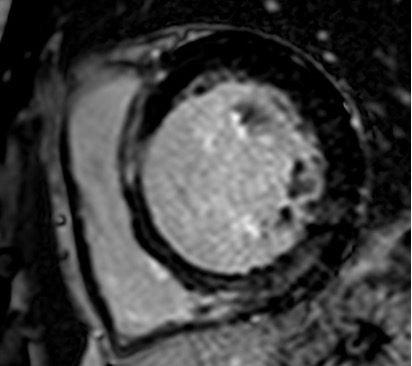
Fig. 4 RMN cuore (LGE
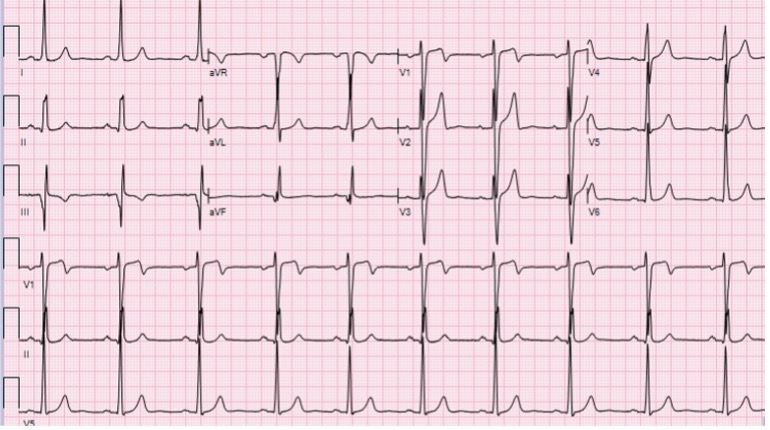
Fig. 5 ECG pre-dimissione
Discussione
La presenza di una cardiomiopatia dilatativa in un paziente giovane affetto da WPW è una sfida diagnostica. Ci sono almeno tre possibili condizioni patologiche da tenere presente, in particolare modo per quel che riguarda il caso da noi illustrato.
L’ipotesi diagnostica più immediata è quella di una cardiomiopatia dilatativa con associata una sindrome di WPW con plurime vie accessorie. Il pattern subepicardico di LGE alla risonanza magnetica rende, però, necessaria la diagnosi differenziale tra una cardiomiopatia post-infiammatoria3 (nonostante l’assenza di episodi infettivi e di recenti episodi di dolore toracico) ed una cardiomiopatia dilatativa geneticamente determinata (seppur l’anamnesi familiare muta).
A rendere più complesso il quadro è la presenza in letteratura di alcuni, seppur rari, casi di cardiomiopatia dilatativa indotta da pre-eccitazione ventricolare, anche in assenza di aritmie, in bambini e giovani adulti. In particolare, sono riportati casi di vie accessorie soprattutto settali e para-settali destre, completamente asintomatiche per quel che riguarda le aritmie, ma in cui il paziente sviluppa segni e sintomi di scompenso cardiaco con riscontro ecocardiografico di una cardiomiopatia dilatativa; in tali casi dopo ablazione della via anomala e talvolta introduzione di terapia antiscompenso e/o resincronizzazione cardiaca si ha recupero della funzione ventricolare sinistra e ripristino del volume ventricolare4. La patogenesi di tale cardiomiopatia non è del tutto chiara. E’ stato ipotizzato che i pazienti con conduzione anterograda manifesta della via accessoria abbiano un movimento asincrono della parete ventricolare a causa della propagazione anormale dell’impulso; questo avverrebbe soprattutto in caso di localizzazione settale o postero-settale della via anomala, in cui ci sarebbe una precoce attivazione del setto interventricolare ed una ritardata attivazione della parete libera del ventricolo sinistro. Tale meccanismo determinerebbe una dissinergia/ipocinesia settale, simile a quello che avviene nella stimolazione ventricolare destra da pace-maker o nel blocco di branca sinistra. Nel tempo tale dissinergia/discinesia settale indurrebbe un rimodellamento ventricolare e conseguente dilatazione. Nelle vie laterali sinistre, invece, la porzione di miocardio pre-eccitato è molto piccola a causa del lungo tempo di conduzione dello stimolo dal nodo seno-atriale all’inserzione atriale della via accessoria che porta ad una attivazione pressoché normale del ventricolo sinistro attraverso la conduzione del nodo atrioventricolare. In modo analogo, in caso di via laterali destre, l’attivazione del ventricolo sinistro avviene quasi del tutto attraverso la normale via di conduzione con un’area pre-eccitata limitata alla parete libera del ventricolo destro5-9. Rispetto ad una cardiomiopatia dilatativa primaria, quella secondaria a pre-eccitazione ventricolare tende a recuperare in 3-6 mesi dall’inizio della terapia anti-scompenso e dall’ablazione della via accessoria.
Nel caso clinico presentato, vi è una disfunzione ventricolare sinistra che è sicuramente comparsa dopo i 30 anni poiché le ecografie precedenti mostravano sempre una frazione d’eiezione del ventricolo sinistro superiore al 50%; gli ECG risalenti allo stesso periodo, inoltre, mostravano, talvolta, una minima pre-eccitazione ventricolare, analoga a quella che permane all’ECG basale dopo quest’ultima ablazione. Questo fa pensare che la conduzione anterograda tramite la via accessoria postero-settale destra abbia iniziato a manifestarsi successivamente e che abbia potuto determinare un rimodellamento ventricolare in questo lasso di tempo. Alla risonanza magnetica cardiaca è presente dissinergia settale (dovuta alla pre-eccitazione); meno chiara è la presenza di aree di LGE, anche per l’assenza di studi clinici in merito.
Nella diagnosi differenziale non dimentichiamo, inoltre, di considerare la tachicardiomiopatia; infatti, durante il ricovero, nei giorni precedenti all’ablazione, si segnalavano alcuni episodi di tachicardia documentati al monitoraggio telemetrico, solo a volte sintomatici. Inoltre, allo studio elettrofisiologico le tachicardie erano facilmente inducibili. Nelle tachicardiomiopatie, possono essere presenti, anche se non di frequente, aree di LGE alla risonanza magnetica, inversamente correlate ad un buon recupero della frazione d’eiezione ventricolare sinistra.10 Tuttavia, è difficile quantificare il numero di aritmie che il paziente possa aver avuto negli ultimi anni poiché non possediamo documentazione in merito.
L’eventuale reverse remodeling ventricolare sinistro e il risultato dell’analisi genetica aiuteranno a fare chiarezza sulla natura della cardiomiopatia e sul successivo iter diagnostico-terapeutico da intraprendere.
In futuro, un ruolo importante potrebbe essere ricoperto dalla risonanza magnetica cardiaca, un esame strumentale che è entrato nella pratica clinica negli ultimi anni; a tal proposito sarebbero necessari studi per valutare se la dilatazione ventricolare sinistra eventualmente determinata dalla conduzione anterograda attraverso la via anomala possa determinare sviluppo di LGE alla risonanza magnetica cardiaca.
Se tale ipotesi fosse confermata, diverrebbe fondamentale eseguire un’ablazione precoce, anche in assenza di tachicardie da rientro atrio-ventricolare e/o di rischio di aritmie ventricolari maggiori, soprattutto in caso di particolari localizzazioni della via accessoria.
Bibliografia
1. Zecchin M, Bianco E. [2019 ESC Guidelines on supraventricular tachycardias: what’s new?]. G Ital Cardiol (Rome) 2020;21(2):96-99. (In ita). DOI: 10.1714/3300.32701.
2. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2022;24(1):4-131. (In eng). DOI: 10.1002/ejhf.2333.
3. Mahrholdt H, Wagner A, Deluigi CC, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation 2006;114(15):1581-90. (In eng). DOI: 10.1161/CIRCULATIONAHA.105.606509.
4. Liu LB, Zhou CZ, Lin H, et al. Reversal of Wolff-Parkinson-White Syndrome induced dilated cardiomyopathy via resynchronization and subsequent accessory pathway ablation. J Geriatr Cardiol 2017;14(10):654-656. (In eng). DOI: 10.11909/j.issn.1671-5411.2017.10.008.
5. Ko J. Left ventricular dysfunction and dilated cardiomyopathy in infants and children with wolff-Parkinson-white syndrome in the absence of tachyarrhythmias. Korean Circ J 2012;42(12):803-8. (In eng). DOI: 10.4070/kcj.2012.42.12.803.
6. Fazio G, Mongiovi’ M, Sutera L, Novo G, Novo S, Pipitone S. Segmental dyskinesia in Wolff-Parkinson-White syndrome: a possible cause of dilatative cardiomyopathy. Int J Cardiol 2008;123(2):e31-4. (In eng). DOI: 10.1016/j.ijcard.2006.11.109.
7. Kwon BS, Bae EJ, Kim GB, Noh CI, Choi JY, Yun YS. Septal dyskinesia and global left ventricular dysfunction in pediatric Wolff-Parkinson-White syndrome with septal accessory pathway. J Cardiovasc Electrophysiol 2010;21(3):290-5. (In eng). DOI: 10.1111/j.1540-8167.2009.01612.x.
8. Dai CC, Guo BJ, Li WX, et al. Dyssynchronous ventricular contraction in Wolff-Parkinson-White syndrome: a risk factor for the development of dilated cardiomyopathy. Eur J Pediatr 2013;172(11):1491-500. (In eng). DOI: 10.1007/s00431-013-2070-z.
9. Tomaske M, Janousek J, Rázek V, et al. Adverse effects of Wolff-Parkinson-White syndrome with right septal or posteroseptal accessory pathways on cardiac function. Europace 2008;10(2):181-9. (In eng). DOI: 10.1093/europace/eun005.
10. Addison D, Farhad H, Shah RV, et al. Effect of Late Gadolinium Enhancement on the Recovery of Left Ventricular Systolic Function After Pulmonary Vein Isolation. J Am Heart Assoc 2016;5(9) (In eng). DOI: 10.1161/JAHA.116.003570.
Info sull'autore