F. Cribari1, C. Conte1, A. Ruggio2, M. Narducci2, A. D’Aiello2, D. Pedicino2, L. M. Biasucci2, G. Liuzzo2
1 Università Cattolica del Sacro Cuore, Roma, Italia
2 Dipartimento di Scienze Cardiovascolari e Toraciche, Fondazione Policlinico Universitario A. Gemelli IRCCS, Roma, Italia
ABSTRACT
L’infezione da Sars-CoV 2 è stata associata ad un aumentato rischio di insufficienza acuta del ventricolo destro (VD). In questo setting dal punto di vista terapeutico sembra interessante l’impiego del levosimendan, verosimilmente grazie alle proprietà anti-infiammatorie, anti-apoptotiche e anti-ossidanti che lo caratterizzano. Un uomo di 72 anni con infezione attiva da Sars-CoV 2 a lieve interessamento pneumonico bilaterale arrivava alla nostra attenzione per, ha accusato segni clinici di scompenso cardiaco destro. Il paziente è stato sottoposto ad un ciclo di Levosimendan, poiché mal responsivo alla terapia diuretica massimale, con netto beneficio in termini di sintomi e segni clinici e concomitante riduzione degli indici laboratoristici di infiammazione sistemica (IL-6 e PCR). In tale setting, pertanto, il Levosimendan, grazie ad i suoi effetti pleiotropici aggiuntivi, potrebbe aiutare ad attenuare l’infiammazione sistemica.
CASO CLINICO
Un uomo di 72 anni accedeva presso il Pronto Soccorso (PS) per astenia, dispnea ingravescente e distensione addominale.
In anamnesi patologica remota erano descritti: storia di BPCO, cardiopatia ischemica cronica sottoposta a numerose rivascolarizzazioni coronariche per via percutanea, pregresso impianto di pacemaker (PMK) monocamerale per fibrillazione atriale a lenta risposta ventricolare media.
Il controllo ecocardiografico precedente mostrava normale funzione contrattile bi-ventricolare in assenza di valvulopatie significative; al controllo strumentale del PMK emergeva una percentuale di stimolazione ventricolare destra del 30%.
All’ingresso in PS il paziente è stato sottoposto a tampone nasofaringeo, risultato positivo per la ricerca di Sars-Cov 2; è stata eseguita una TC del torace-addome senza e con mezzo di contrasto , che ha mostrato lieve interessamento pneumonico bilaterale, significativo ingrandimento delle camere cardiache destre senza segni di embolia polmonare in atto, versamento ascitico diffuso, epatomegalia e segni radiografici compatibili con cirrosi cardiogena; altre possibili cause di congestione e cirrosi epatica venivano escluse.
All’EGA arterioso (eseguito con FiO2 al 21%) si rilevava un rapporto P/F > 200 e Lattati 1.5 mmol/H; l’ECG evidenziava ritmo da fibrillazione atriale, blocco di branca destro, onde Q in sede inferiore.
Veniva iniziata terapia diuretica infusionale e terapia tromboprofilattica con enoxaparina (PADUA Score 5), quindi il paziente veniva ospedalizzato.
Durante la degenza, il paziente non ha mai necessitato di supporto di ossigeno erogato mediato da HFNC e/o ventilazione non invasiva. Gli esami ematochimici eseguiti durante la degenza sono riportati in Tabella I.
L’ecocardiogramma transtoracico di ingresso mostrava importante dilatazione e disfunzione globale del ventricolo destro con insufficienza tricuspidalica massiva da gap di coaptazione (circa 20 mm) ed alterata geometria settale con D-shape del setto interventricolare, indicativa del sovraccarico volumetrico e pressorio del ventricolo destro (VD), vena cava inferiore pletorica con segni di stasi epato-cavale e significativo reflow sistolico nelle vene sovraepatiche al PW-Doppler; a sinistra lieve riduzione della funzione contrattile globale (FEVS 52%), in assenza di valvulopatie significative.
Non veniva eseguito il cateterismo cardiaco destro alla luce del quadro clinico (labilità dell’equilibrio emodinamico, paziente sintomatico) ed infettivo.
Inizialmente si è deciso di massimizzare la terapia diuretica infusionale; tuttavia, per persistenza dei sintomi, il paziente è stato sottoposto ad un ciclo di Levosimendan.
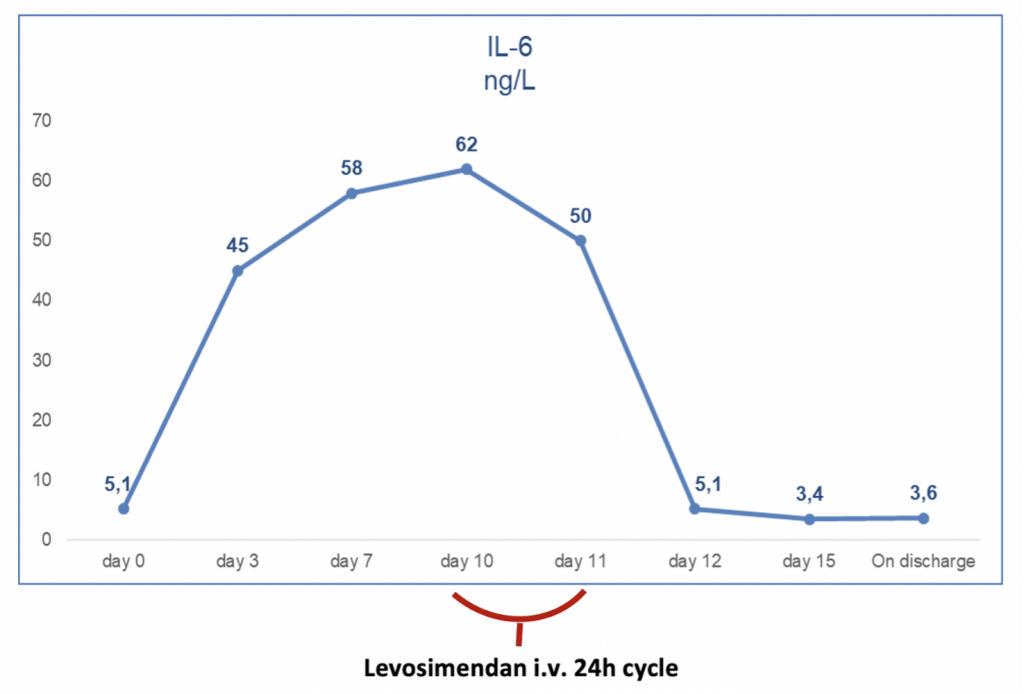
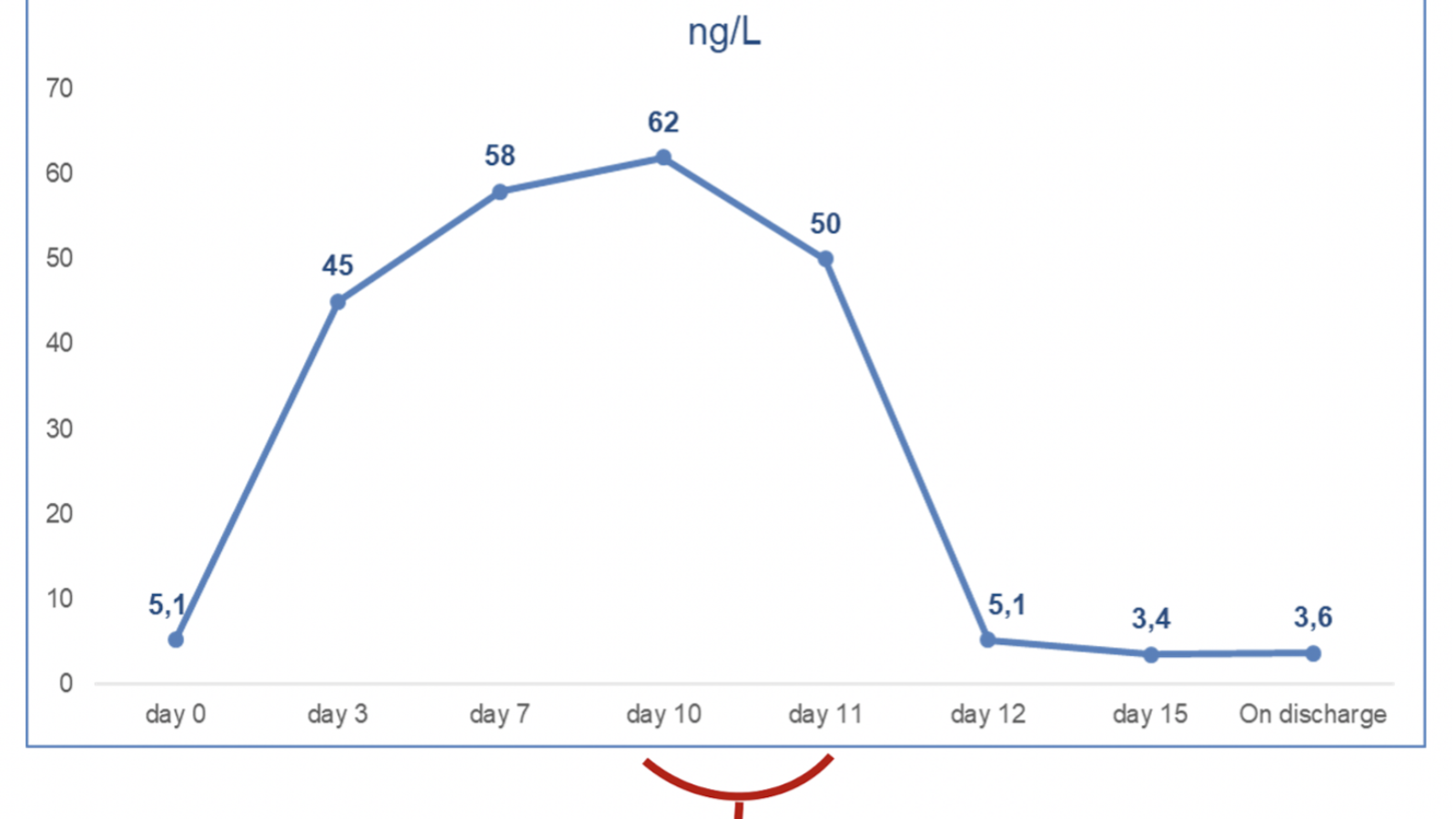
L’ecocardiogramma transtoracico di controllo (eseguito tre giorni dopo l’ingresso) confermava la dilatazione del ventricolo destro e l’insufficienza tricuspidalica massiva, tuttavia, la funzione sistolica radiale e longitudinale del ventricolo destro risultavano significativamente migliorate (lieve-media disfunzione vs precedente severa disfunzione) rispetto al precedente esame. Da un punto di vista laboratoristico, si è assistito al calo degli indici di flogosi e contestuale riduzione dei livelli di IL-6 (Figura I).
Progressivamente i segni clinici di congestione periferica ed i sintomi del paziente sono migliorati; è stato possibile scalare il dosaggio della terapia diuretica e la frazione inalata durante ossigenoterapia, sino a sospensione della stessa. Il paziente è stato, quindi, dimesso a domicilio.
DISCUSSIONE
Il caso riportato riguarda un paziente con isolata insufficienza del cuore destro di neo-riscontro durante infezione da Sars-CoV 2 a lieve coinvolgimento polmonare, trattata con beneficio mediante un ciclo di levosimendan in relazione verosimilmente alle pleiotropiche azioni anti-infiammatorie, anti-ossidative ed anti-rimodellamento negativo del farmacostesso1.
Recenti evidenze enfatizzano come lo scompenso cardiaco acuto rientri ormai in una vera e propria sindrome caratterizzata da una risposta infiammatoria sistemica iperattivata: il miocardio che progressivamente diventa disfunzionante rappresenta esso stesso una fonte di citochine pro-infiammatorie (TNF-α, IL-1β, IL-6), le quali perpetuano il danno miocardico ed il rimodellamento negativo ventricolare, sino alla transizione clinica (dalla forma asintomatica alla forma sintomatica) di scompenso2,3.
Durante la pandemia COVID-19 relata, il rialzo anomalo di biomarcatori di danno miocardico è stato un riscontro frequente; in particolare l’infezione da Sars-CoV 2 è stata associata ad un aumentato rischio di insufficienza acuta del VD a causa di fragile equilibrio cardio-polmonare conseguente alla vasocostrizione ipossica durante polmonite e/o tromboembolismo polmonare. Tuttavia, è stata successivamente descritta anche una dilatazione e disfunzione del VD nei pazienti affetti da COVID-19 primitiva, ovvero senza un significativo impegno polmonare 4.
I meccanismi patogenetici sottesi a tale coinvolgimento primitivo includono l’effetto inotropo-negativo e la disfunzione micro- e macro-vascolare mediati dallo storm citochinico e dallo stress ossidativo, a cui si aggiungono il danno cardiaco diretto mediato dall’ enzima angiotensin-converting enzyme 2 (ACE2) e la conseguente perdita delle sue proprietà cardio-protettive 4.
I benefici derivanti dall’utilizzo del levosimendan nella disfunzione sisto-diastolica del VD sono ben noti in letteratura, ma i suoi effetti in altri scenari clinici tra cui lo scompenso cardiaco acuto durante infezione da Sars-CoV 2 rimangono ancora inesplorati 5. Il levosimendan possiede, infatti, proprietà anti-infiammatorie, anti-apoptotiche e anti-ossidanti, che lo rendono particolarmente interessante in questo setting.
Èstato infatti osservato che esplica un effetto anti-infiammatorio, agendo sia sui cardiomiociti che sulle cellule endoteliali, attenuando l’espressione IL-1β- indotta dell’IL-6 e dell’IL-8 e riducendo l’espressione di proteine di adesione espresse sulle cellule endoteliali6.
Il levosimendan è in grado di attenuare, inoltre, il rimodellamento negativo spegnendo la produzione di specie reattive dell’ossigeno (ROS) IL-1β indotte, silenziando l’attivazione del nuclear factor-kappa B (NF kB) con conseguente capacità anti-apoptotica e modulando l’espressione proteica di molteplici geni, inclusi quelli coinvolti nel sistema renina-angiotensina-aldosterone7,8.
In aggiunta, sembra che il levosimendan sia in grado di agire anche sul metabolismo della matrice extracellulare attraverso la riduzione dei livelli di IL-6 locali, dell’espressione di proteine chemoattraenti i monociti, dei fattori di crescita del tessuto connettivo e, infine, delle metalloproteinase coinvolte nel catabolismo della stessa7,8.
BIBLIOGRAFIA
- Poelzl G, Auer J. Cardiohepatic syndrome. Curr Heart Fail Rep 2015; 12: 68-78.
- Gullestad L, Ueland T, Vinge LE, Finsen A, Yndestad A, Aukrust P. Inflammatory cytokines in heart failure: mediators and markers. Cardiology 2012; 122: 23-35.
- Narula J, Haider N, Virmani R, DiSalvo TG, Kolodgie FD, Hajjar RJ et AlBA. Apoptosis in myocytes in end-stage heart failure. N Engl J Med 1996; 335: 1182-1189
- Park JF, Banerjee S, Umar S. In the eye of the storm: the right ventricle in COVID-19. Pulm Circ 2020; 10: 2045894020936660
- Camilli M, Ciampi P, Pedicino D, D’Aiello A, Mazza A, Montone RA et Al. Use of Levosimendan as bridge therapy to surgical correction of post-infarction ventricular septal defect: a case report. Eur Rev Med Pharmacol Sci 2021; 25:3296-3299
- Krychtiuk KA, Watzke L, Kaun C, Buchberger E, Hofer-Warbinek R, Demyanets S, et Al. Levosimendan exerts anti-inflammatory effects on cardiac myocytes and endothelial cells in vitro. Thromb Haemost. 2015; 113: 350-362
- Trikas A, Antoniades C, Latsios G, Vasiliadou K, Karamitros I, Tousoulis D et Al. Long-term effects of levosimendan infusion on inflammatory processes and sFas in patients with severe heart failure. Eur J Heart Fail 2006; 8: 804-809.
- Farmakis D, Alvarez J, Gal TB, Brito D, Fedele F, Fonseca C, Gordon AC, et Al. Levosimendan beyond inotropy and acute heart failure: Evidence of pleiotropic effects on the heart and other organs: An expert panel position paper. Int J Cardiol 2016; 222: 303-312.
TABELLA 1. Valori di laboratorio riscontrati durante l’ospedalizzazione
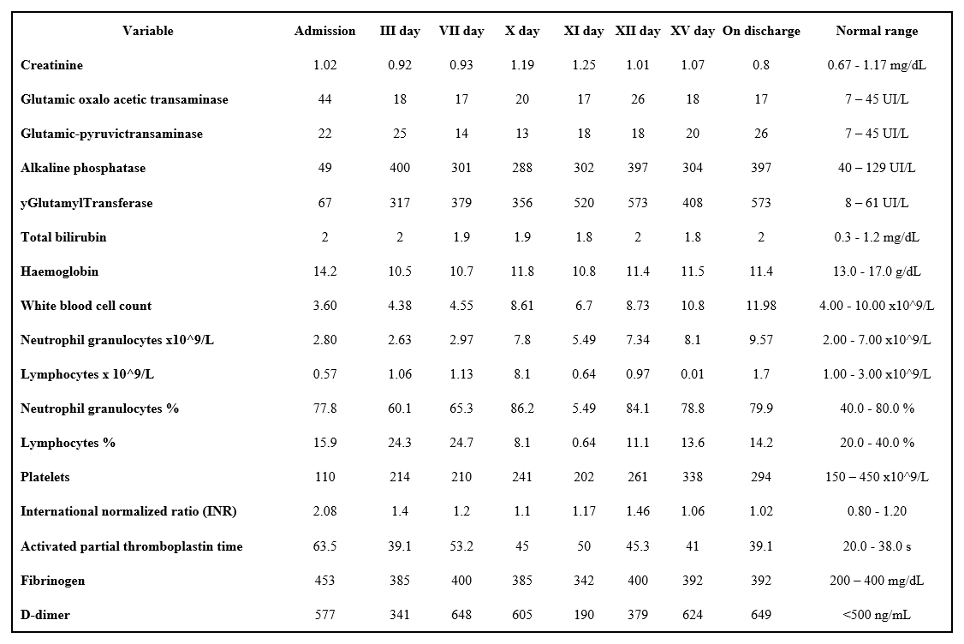
FIGURA 1. Trend dell’IL-6 durante l’ospedalizzazione