Un Caso di Cardiomiopatia Ipertrofica Ostruttiva del Ventricolo Destro
Martina Settia, Luca Maritana, Caterina Butturinia, Annachiara Beninia, Mariantonietta Cicoiraa
a University of Verona, Section of Cardiology, Department of Medicine, Italy
ABSTRACT
La varietà di espressione fenotipica della cardiomiopatia ipertrofica (CMPI) richiede un’interpretazione integrata di sintomi clinici ed indagini strumentali. Il ruolo dell’interessamento del ventricolo destro nella CMPI dal punto di vista clinico, prognostico e terapeutico rimane ad oggi ancora da definire, data la casistica limitata, in assenza di linee guida specifiche. In questo caso clinico presentiamo una paziente con CMPI ostruttiva del ventricolo destro e l’iter diagnostico-terapeutico intrapreso.
Presentazione del paziente
Una donna di 57 anni con diagnosi di cardiomiopatia ipertrofica (CMPI) non ostruttiva accedeva al nostro ambulatorio di Scompenso Cardiaco Avanzato. La patologia le era stata diagnosticata da circa dieci anni, grazie ad uno screening cardiologico, intrapreso dopo la diagnosi di difetto del setto interventricolare del figlio in età pediatrica e il successivo sviluppo di CMPI. Inoltre, la prima figlia della donna era deceduta per ventricolo unico.
La paziente non aveva fattori di rischio cardiovascolari o altre patologie rilevanti. A livello sintomatologico lamentava astenia ingravescente, palpitazioni e occasionale dolore toracico sotto sforzo, in assenza di storia di sincopi. All’esame obiettivo, si notava un soffio sistolico di intensità 3/6 in focolaio mesocardico.
Work-up iniziale
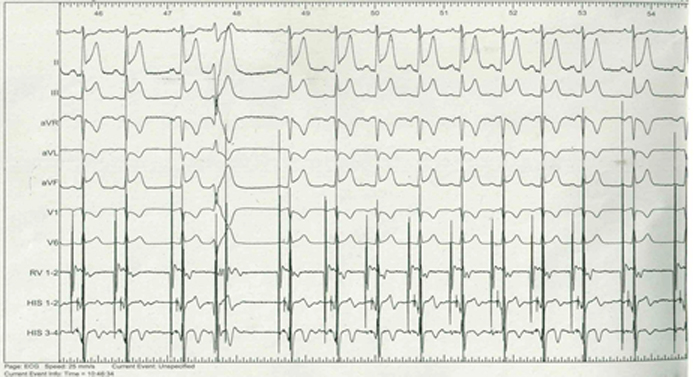
Al tracciato elettrocardiografico (Figura 1) si documentava ritmo sinusale a 62 battiti per minuto, con ingrandimento bi-atriale ed onde Q nelle derivazioni inferiori e onde T negative in quelle antero-laterali.
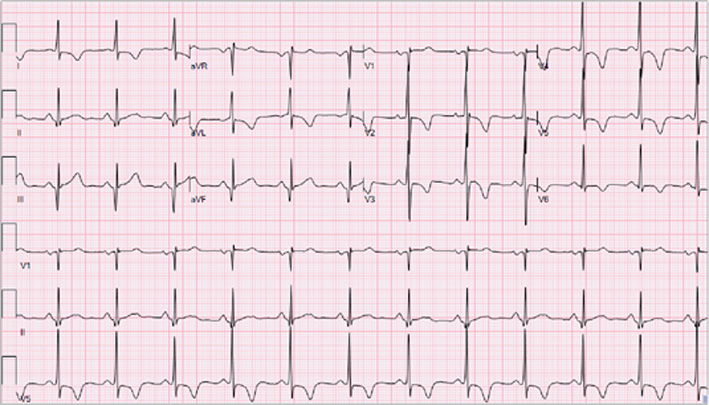
Ritmo sinusale, 62 battiti per minuto, allargamento dell’atrio sinistro e destro, onde Q patologiche in DII e DIII, onde T negative nelle derivazioni antero-laterali.
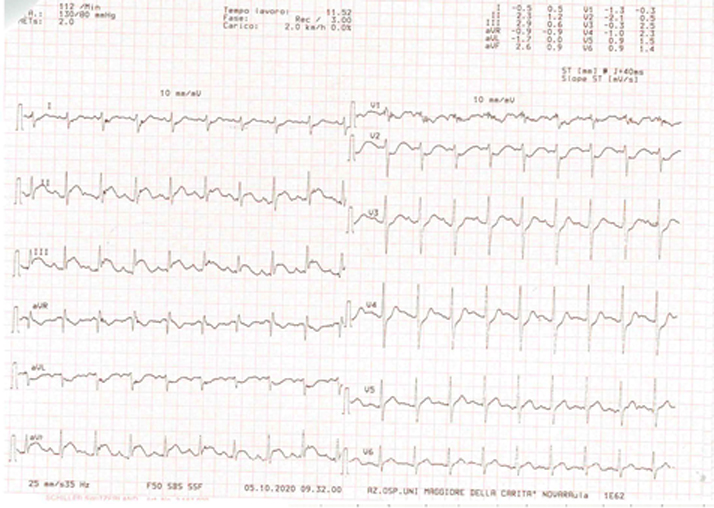
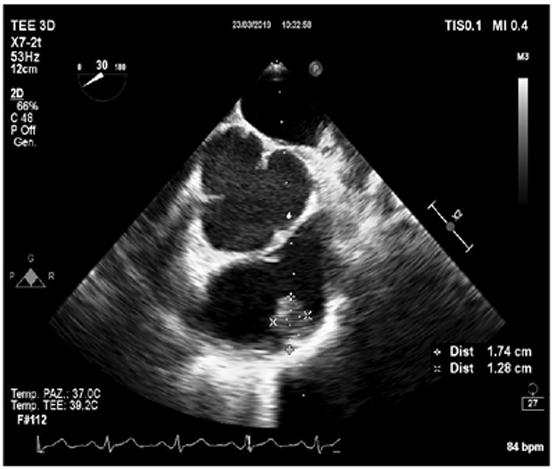
Veniva inoltre eseguito un ecocardiogramma transtoracico (Figura 2), che rivelava un’ipertrofia asimmetrica (spessore massimo 22 mm) del setto anteriore, della parete antero-laterale e dell’apice con funzione contrattile del ventricolo sinistro aumentata (frazione d’eiezione 78%). Il diametro antero-laterale dell’atrio sinistro risultava 33 mm. Al doppler, non si registrava alcun segno di ostruzione del tratto di efflusso del ventricolo sinistro, in condizioni basali, dopo manovra di Valsalva e squatting-standing. Al contrario, si evidenziava un’ostruzione del tratto di efflusso del ventricolo destro (gradiente di picco di 39 mmHg).
Veniva pertanto eseguito una valutazione ecocardiografica durante sforzo su letto-ergometro (ecostress), che confermava l’assenza di gradiente del tratto di efflusso del ventricolo sinistro e mostrava un significativo aumento del gradiente pressorio del tratto di efflusso destro (da 40 a 80 mmHg).
Al referto dell’Holter ECG delle 48 ore, eseguito il mese precedente, si notavano complessi ventricolari prematuri e un episodio di tachicardia ventricolare non sostenuta (4 battiti, a 135 battiti per minuto).
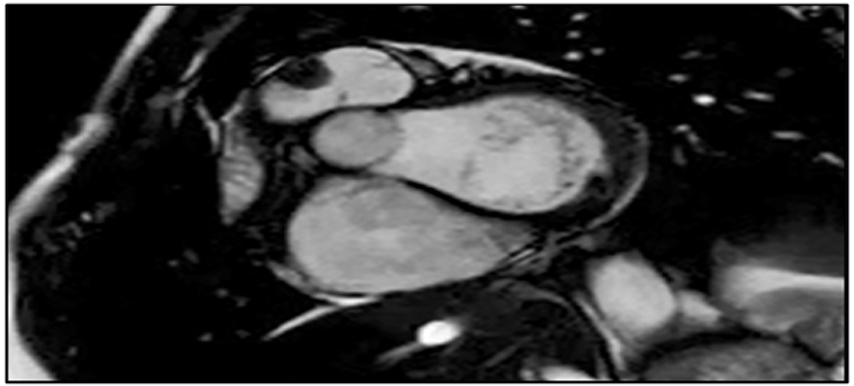
Veniva anche richiesta una risonanza magnetica cardiaca (RMC, Figura 3), che mostrava zone di late-gadolinium-enhancement (LGE) con pattern intramurale, nelle aree ipertrofiche di entrambi i ventricoli.
Era infine programmato un test cardiopolmonare, in cui si dimostrava una moderata riduzione della capacità funzionale, per limitazione cardiogenica (VO2 picco 13.8 ml/kg/min, corrispondente al 57% del predetto, AT 39% del predetto, RQ 1.06) e sovraccarico polmonare vascolare (VE/VCO2 slope 33.9), in assenza di aritmie indotte dall’esercizio.
Diagnosi e trattamento
Alla valutazione iniziale, la paziente era in terapia con beta-bloccante (nadololo, 40 mg al giorno), con persistenza dei sintomi. Veniva, pertanto, aggiunta disopiramide (125 mg due volte al giorno), con parziale beneficio. Non è stata titolata ulteriormente la disopiramide, anche visto il riscontro di QTc pari a 455 ms all’ECG di controllo, eseguito ad una settimana dall’inizio della terapia.
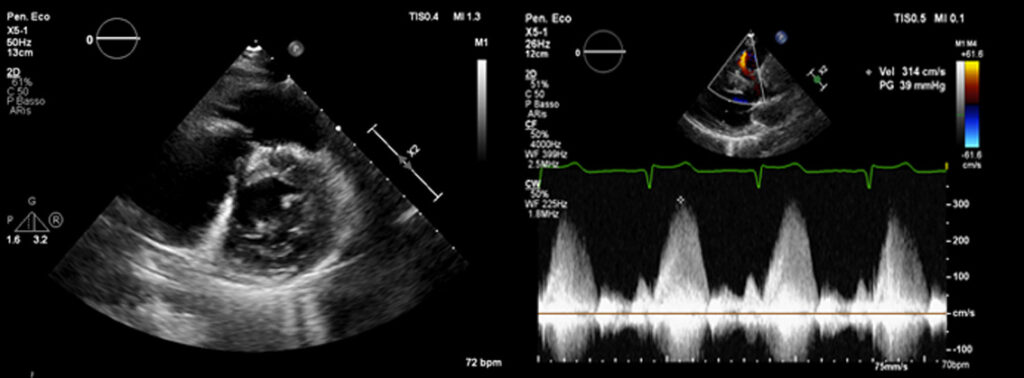
Sinistra) Parasternale asse corto, ipertrofia del tratto di efflusso del ventricolo destro
Destra) Parasternale asse corto, gradiente pressorio del tratto di efflusso del ventricolo destro (gradiente di picco 39 mmHg).
Al controllo successivo, dopo un mese, la paziente riferiva miglioramento dell’astenia e degli episodi di dolore toracico, nonostante il persistere di gradiente del ventricolo destro.
Il figlio della nostra paziente non era ancora stato sottoposto a test genetico nel centro di riferimento, pertanto è stata richiesta l’analisi genetica delle mutazioni comunemente associate a CMPI per la donna, risultata però negativa.
In assenza di specifiche indicazioni per questo raro fenotipo di CMPI nelle linee guida della Società Europea di Cardiologia, che precludeva la mera applicazione dello score di rischio ESC per morte cardiaca improvvisa, abbiamo scelto un approccio ad hoc. Tenuti in considerazione l’età della paziente, lo spessore massimo miocardico, la presenza di ostruzione del tratto di efflusso del destro e la tachicardia ventricolare non sostenuta ventricolare e l’evidenza di LGE nelle aree ipertrofiche, abbiamo considerato la paziente a elevato rischio di morte improvvisa. Dopo esserci consultati con i colleghi elettrofisiologi e aver condiviso la scelta con la paziente, si è deciso di impiantare un defibrillatore sottocutaneo.
Discussione
Il coinvolgimento del ventricolo destro nella CMPI dovrebbe essere sempre ricercato, valutandone sia la struttura sia la funzione.
L’ecocardiogramma rappresenta l’esame di prima linea per porre il sospetto e poi la diagnosi di CMPI (1), ma non sono ancora stati stabiliti criteri universali per definire il coinvolgimento e l’ostruzione del ventricolo destro (2). Gli indici ecocardiografici tradizionali spesso non risultano efficaci nel dimostrare precocemente una disfunzione del ventricolo destro ipertrofico di questi pazienti. La RMC rappresenta la metodica non invasiva con maggiore potenzialità per lo studio di morfologia, funzione e substrato miocardico dei ventricoli, in particolare quello destro. Ci sono, inoltre, alcune evidenze che la RMC possa aggiungere informazioni sulla quantificazione della fibrosi miocardica e sulla sua distribuzione in entrambi i ventricoli, con possibili risvolti sulla stratificazione prognostica (3,4).
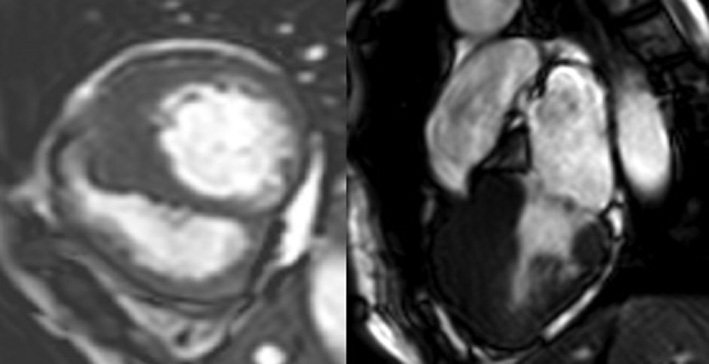
Sinistra) proiezione del tratto di efflusso del ventricolo destro
Destra) asse corto, ipertrofia asimmetrica
In generale, l’ipertrofia del ventricolo destro della CMPI è associata con peggioramento della presentazione clinica e della prognosi in pazienti in classe funzionale NYHA III o IV, aumentato rischio di aritmie ventricolari e sopraventricolari, dispnea severa (4) e tromboembolismo polmonare (5). Inoltre, risulta esserci correlazione tra lo spessore della parete del ventricolo destro e un aumentato rischio di aritmie ventricolari maligne e morte cardiaca improvvisa (5).
Non è ancora stato identificato alcun trattamento standardizzato della CMPI con coinvolgimento del ventricolo destro (3). Come nella CMPI ostruttiva del tratto di efflusso del ventricolo sinistro, la terapia si basa sull’utilizzo di farmaci beta-bloccanti e, in assenza di miglioramento dello stato clinico, si dovrebbe aggiungere la disopiramide (4). La persistenza dell’ostruzione del ventricolo destro in pazienti sintomatici può richiedere la miectomia chirurgica, per ridurre il gradiente e migliorare la sintomatologia (4, 6,7).
Per stratificare il rischio aritmico delle CMPI e decidere se è necessario impiantare il defibrillatore in profilassi primaria, è stato sviluppato uno score, che include parametri inerenti soltanto al ventricolo sinistro. Dato il numero limitato di studi nei pazienti con ipertrofia del ventricolo destro ed ostruzione, è difficile quantificare in modo preciso il rischio di morte improvvisa ad essa connessa. Il nostro caso sottolinea come siano pertanto necessari altri studi per valutare pazienti con CMPI e coinvolgimento del ventricolo destro, così come il loro eventuale rischio di morte improvvisa.
Bibliografia
1. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, Hagege A, Lafont A, Limongelli G, Mahrholdt H, McKenna WJ, Mogensen, Nihoyannopoulos P, Nistri S, Pieper PG, Pieske B, Rapezzi C, Rutten FH, Tillmanns C, Watkins H. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 35 (2014), pp. 2733-2779, doi:10.1093/euheartj/ehu284.
2. Maron MS, Hauser TH, Dubrow E et al.,Right ventricular involvement in hypertrophic cardiomyopathy, Am J Cardiol, 100 (2007), pp. 1293-1298.
3. Keramida K et al ., Right ventricular involvement in hypertrophic cardiomyopathy: Patterns and implications, Hellenic Journal of Cardiology, https://doi.org/10.1016/j.hjc.2018.11.009.
4. McKenna WJ, Kleinebenne A, Nihoyannopoulos P, Foale R, Echocardiographic measurement of right ventricular wall thickness in hypertrophic cardiomyopathy: relation to clinical and prognostic features, J Am Coll Cardiol, 11 (1988), pp. 351-358.
5. Roşca M, Călin A, Beladan CC et al., Right ventricular remodeling, its correlates, and its clinical impact in hypertrophic cardiomyopathy. J Am Soc Echocardiogr, 28 (11) (2015 Nov), pp. 1329- 1338.
6. Maron BJ, McIntosh CL, Klues HG, Cannon III RO, Roberts WC, Morphologic basis for obstruction to right ventricular outflow in hypertrophic cardiomyopathy, Am J Cardiol, 71 (1993), pp. 1089- 1094.
7. Butz T, Horstkotte D, Langer C et al., Significant obstruction of the right and left ventricular outflow tract in a patient with biventricular hypertrophic cardiomyopathy, Eur J Echocardiogr, 9 (2008), pp. 344-345.
UN CASO DI AMILOIDOSI CARDIACA: CHI CERCA TROVA
Sinigiani G [1], Giordani AS [1], Cecchetto A [1], Sarais C [1], Napodano M [1], Rizzo S [2], Berno T [3], Brunello G [1].
[1] Dipartimento di Scienze Cardiache, Toraciche, Vascolari e Sanità Pubblica, Università degli Studi di Padova. [2] Patologia cardiovascolare, Dipartimento di Scienze Cardiache, Toraciche, Vascolari e Sanità Pubblica, Università degli Studi di Padova. [3] Dipartimento di medicina, unità di ematologia e immunologia clinica, Università degli Studi di Padova.
Abstract
Un uomo di 53 anni, senza precedenti cardiologici, veniva ricoverato per scompenso cardiaco. All’ecocardiogramma e a RM cuore venivano documentati ventricolo sinistro ipertrofico, di normali dimensioni e funzione, versamento pericardico non tamponante. L’elettroforesi sieroproteica, la biopsia del grasso periombelicale e la scintigrafia ossea risultavano negative. Ricompensato, il paziente veniva dimesso. Tuttavia, il quadro clinico recidivava quattro mesi dopo, per cui veniva ricoverato nuovamente e trasferito presso il nostro reparto. Qui gli esami laboratoristici e strumentali permettevano la diagnosi di amiloidosi cardiaca in mieloma multiplo e veniva impostata terapia con Bortezomib e Desametasone. Il paziente tuttavia decedeva due mesi dopo.
Caso Clinico
Un uomo di 53 anni, senza precedenti cardiologici, veniva ricoverato presso un reparto di cardiologia per edemi declivi e dispnea da sforzo. All’ecocardiogramma veniva documentato versamento pericardico non tamponante, ventricolo sinistro ipertrofico, di normali dimensioni e funzione di pompa con aumentata pressione telediastolica; una TAC del torace e dell’addome inoltre documentava versamento pleurico bilaterale. Venivano eseguite elettroforesi sieroproteica e dosaggio degli autoanticorpi, risultati negativi, ed impostata terapia diuretica ed antinfiammatoria. Il paziente veniva dimesso, dopo aver ottenuto un soddisfacente compenso emodinamico. Una successiva risonanza magnetica cardiaca documentava unicamente ipertrofia concentrica del ventricolo sinistro. Nel sospetto di amiloidosi si eseguivano una biopsia del grasso periombelicale ed una scintigrafia ossea, risultate negative. Quattro mesi dopo, per recidiva della sintomatologia, veniva nuovamente ricoverato, con reperti strumentali sovrapponibili ai precedenti; il dosaggio dell’alfa galattosidasi ematica escludeva malattia di Fabry. Il paziente veniva trasferito presso il nostro reparto. Si ripeteva ecocardiogramma, che documentava moderata riduzione della frazione di eiezione ventricolare sinistra, lieve versamento pericardico, ispessimento delle valvole atrioventricolari, aspetto a “granular sparkling” del miocardio ventricolare ed aspetto “apicalsparing” all’analisi del global longitudinal strain. Una risonanza magnetica cardiaca documentava inoltre difficile reperimento del tempo di inversione nelle sequenze T1 scout e LGE a “zebra pattern”. L’elettroforesi sieroproteica e la proteinuria di Bence Jones risultavano nella norma; veniva però documentato un aumento considerevole delle catene leggere libere lambda, mai dosate in precedenza.
I valori di NT-proBNP e troponina risultavano essere rispettivamente di 10.800 ng/L e 180 ng/L. Alla luce di ciò e della scintigrafia ossea negativa effettuata nel ricovero precedente, nel sospetto di amiloidosi AL veniva ricercata una neoplasia ematologica, ed eseguita quindi biopsia osteomidollare che documentava mieloma multiplo. Il paziente veniva sottopostoper diagnosi di certezza di amiloidosi cardiaca AL a biopsia endomiocardica, che confermava la diagnosi. Pertanto, successivamente all’ottenimento di buon compenso emodinamico con terapia diuretica, si iniziava terapia con Bortezomib e Desametasone. La prognosi del paziente si prospettava tuttavia infausta (Stadio IV del Revised Staging System, mediana di sopravvivenza 6 mesi); a due mesi dalla dimissione dal nostro reparto, il paziente andava incontro ad arresto cardiaco e decesso.
Discussione
L’amiloidosi cardiaca è una patologia da accumulo, caratterizzata dal deposito di fibrille amiloide nel miocardio, che si originano a partire da un precursore proteico, a seconda del quale si distinguono diverse forme di amiloidosi, tra cui l’amiloidosi AL, ATTRwt e ATTRm. La prima ha come precursore una catena leggera di immunoglobulina; l’ATTRwt e ATTRm condividono il precursore, la transtiretina, ma nella prima è nativa, mentre nella seconda è mutata. Clinicamente sono caratterizzate, nelle prime fasi di malattia, da un quadro di scompenso cardiaco a frazione di eiezione preservata, e solo successivamente, si osserva uno scadimento della frazione di eiezione. Fondamentali per il sospetto di malattia sono le metodiche di imaging, ecocardiografia e risonanza magnetica cardiaca senza e con mezzo di contrasto. All’ecocardiogramma si osserva tipicamente ventricolo sinistro ipertrofico, con conservata funzione di pompa e disfunzione diastolica (finanche alla fisiologia restrittiva), dilatazione atriale sinistra, ispessimento del setto interatriale e delle valvole atrioventricolari, aspetto “granular sparkling” del miocardio e aspetto ad “apical sparing” dell’analisi del global longitudinal strain. Alla RM cuore caratteristiche sono la difficoltà a reperire il tempo di inversione nelle sequenze T1 scout, un valore di T1 nativo elevato al mapping T1, il pattern di LGE subendocardico diffuso o a “zebra pattern”. Se a seguito il sospetto è elevato, è indicata l’esecuzione di elettroforesi sieroproteica con immunofissazione su siero ed urine, ricerca della proteinuria di Bence Jones e dosaggio delle catene leggere libere sieriche e di scintigrafia ossea, la quale documenta intensa captazione del tracciante in caso di amiloidosi cardiaca da TTR. Sulla base degli esiti di questi esami, è possibile porre diagnosi di amiloidosi TTR, con successiva analisi genetica. Per la diagnosi di amiloidosi AL generalmente è indicata la biopsia cardiaca o extracardiaca. Una volta confermata la diagnosi di amiloidosi AL, è possibile in questo contesto stimare la prognosi mediante il Revised Staging System, che utilizza i valori di TnT, NT-proBNP e catene leggere libere. Per quanto riguarda la terapia, è essenziale giungere ad una diagnosi della discrasia ematologica alla base per poter intraprendere la terapia più appropriata, che, anche in riferimento al rischio clinico del paziente (stimato anche sul sistema di prognosi), può comprendere il trapianto e l’autotrapianto di midollo, farmaci inibitori del proteasoma, o chemioterapia classica.
Il caso in esame evidenza come l’amiloidosi cardiaca sia una patologia spesso misconosciuta, rapidamente ingravescente con prognosi infausta. Fondamentali sono il sospetto di malattia, metodo sistematico di ricerca ed esperienza.
ST-elevation Myocardial Infarction diagnosed in non-paced fascicular extra-beats.
Giulio Falasconi1 MD, Luigi Pannone1 MD, Carlo Gaspardone1 MD, Lorenzo Cianfanelli1 MD, Marco Bruno Ancona2 MD, Matteo Montorfano2 MD, Alberto Margonato1,3 MD, Massimo Slavich1 MD
1 Cardiologia clinica, IRCCS San Raffaele, Milano, Italia
2 Cardiologia interventistica Unit, IRCCS San Raffaele, Milano, Italia
3 Università Vita-Salute San Raffaele, Milano, Italia
Abstract
La diagnosi di infarto acuto del miocardio (IMA) in presenza di pacing ventricolare può dimostrarsi complessa. In questo case report presentiamo un caso di IMA diagnosticato sulla base di un sopraslivellamento del tratto ST visibile esclusivamente in corrispondenza di extrasistoli fascicolari con alterazioni del tratto ST non diagnostiche in presenza di pacing ventricolare.
Caso Clinico
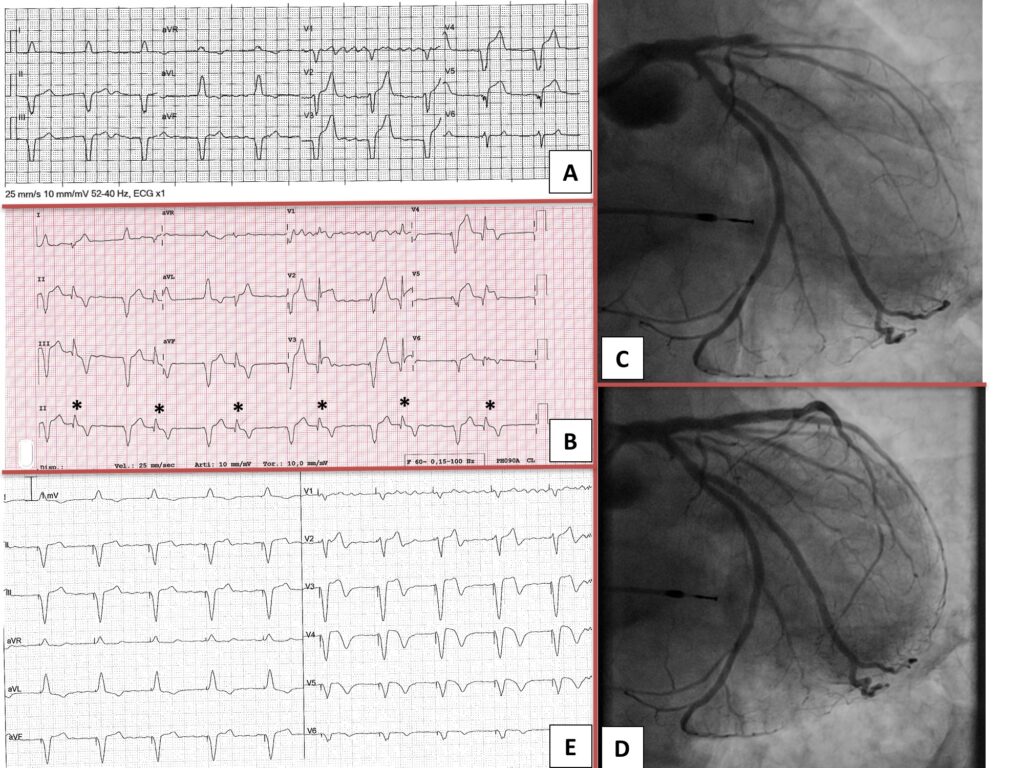
Un uomo di 81 anni si è presentato in Pronto Soccorso (PS) del nostro Istituto per dolore toracico. L’anamnesi patologica remota era significativa per impianto di pacemaker monocamerale nel contesto di fibrillazione atriale con bassa risposta ventricolare. L’ECG in ambulanza mostrava fibrillazione atriale e pacing ventricolare (VPR); inoltre si osservava un sopraslivellamento del tratto ST di 3 mm nelle derivazioni anteriori che non raggiungeva i criteri di Sgarbossa per IMA in presenza di VPR (Figura centrale – 1, pannello A). Al secondo ECG in PS si osservava un bigeminismo ventricolare. Le extrasistoli ventricolari (BEV) erano più strette dei battiti da pacing ventricolare e avevano morfologia a blocco di branca destra più emiblocco posteriore sinistro compatibile con un’origine dal fascicolo anteriore (Figura centrale – 1, pannello B, asterisco). Un sopraslivellamento del tratto ST era evidente esclusivamente nelle PVC permettendo di concludere con diagnosi di STEMI. La coronarografia in urgenza mostrava un’occlusione trombotica acuta della discendente anteriore prossimale (Figura centrale – 1, pannello C, video 1) trattata con successo mediante angioplastica primaria e impianto di uno stent medicato (Figura centrale – 1, pannello D, video 2). Il giorno dopo la procedura, un ECG tipico per STEMI sub-acuto era evidente anche nei battiti con pacing ventricolare come dimostrato dalle onde T difasiche e negative nelle derivazioni precordiali V2-V6 (Figura centrale – 1, pannello E). Al follow up il paziente non ha avuto ulteriori eventi cardiovascolari o ospedalizzazioni. La diagnosi di IMA nel contesto di pacing ventricolare può essere difficile. In presenza di VPR, le alterazioni ischemiche possono essere riconosciute quando l’ECG è comparato con uno precedente; sfortunatamente spesso non si ha disponibilità di un tale ECG. Inoltre le aritmie ventricolari sono frequenti nella fase precoce dell’IMA (1). Questo case report dimostra la difficoltà della diagnosi di STEMI in presenza di VPR. La diagnosi è stata possibile esclusivamente in presenza di alterazioni del tratto ST nei BEV fascicolari mentre nei battiti con pacing la diagnosi di AMI non è stata possibile in quanto non venivano raggiunti i criteri di Sgarbossa. È possibile che l’ischemia della parete anteriore sia stata il trigger per i BEV dal fascicolo anteriore: in questi battiti la corrente di lesione è evidente da V2 a V5 permettendo la diagnosi di STEMI anteriore. I criteri di Sgarbossa sono stati derivati in pazienti con blocco di branca sinistra all’ECG di base nel trial GUSTO I. Nonostante la specificità riportata sia relativamente alta (>90% per ciascun criterio), la sensibilità è relativamente bassa (meno del 75% per il criterio più sensibile) e anche inferiore per il sottogruppo con VPR (meno del 55% per il criterio più sensibile), (2)(3).
In conclusione nella pratica clinica quotidiana bisogna considerare i limiti della valutazione ECGrafica in presenza di VPR ed è necessario valutare sempre l’ECG nel contesto clinico.
References
1. Bhar-Amato J, Davies W, Agarwal S. Ventricular arrhythmia after acute myocardial infarction: “The perfect storm.” Arrhythmia Electrophysiol. Rev. 2017;6:134–139.
2. Sgarbossa EB, Pinski SL, Barbagelata A, et al. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. N. Engl. J. Med. 1996;334:481–487.
3. Sgarbossa EB, Pinski SL, Gates KB, Wagner GS. Early electrocardiographic diagnosis of acute myocardial infarction in the presence of ventricular paced rhythm. Am. J. Cardiol. 1996;77:423–424.
Video
Angina in assenza di coronaropatia ostruttiva: caso clinico di vasospasmo coronarico
Enrico Guido Spinoni 1,2, Rocco Gioscia 1,2, Leonardo Grisafi 1,2, Andrea Rognoni 1, Marco Mennuni 1, Giuseppe Patti 1,2.
1 Università del Piemonte Orientale, Novara
2 AOU Maggiore della Carità, Novara
Abstract
Uomo di 52 anni ricoverato per episodio sincopale ed angina a riposo, veniva sottoposto a studio coronarografico documentante arterie coronarie esenti da stenosi critiche. Successivamente, veniva sottoposto a studio elettrofisiologico endocavitario che documentava comparsa di angor e di sopraslivellamento del tratto ST in sede inferiore in seguito ad infusione di isoproterenolo, totalmente regrediti in seguito ad infusione di verapamil. La prova da sforzo eseguita evidenziava comparsa di transitorio sopraslivellamento del tratto ST a riposo, regredito con nitrato spray. Veniva quindi posta diagnosi di angina vasospastica ed il paziente veniva dimesso con indicazione a terapia farmacologica con calcio-antagonista (diltiazem) e nitrato transdermico.
Caso Clinico
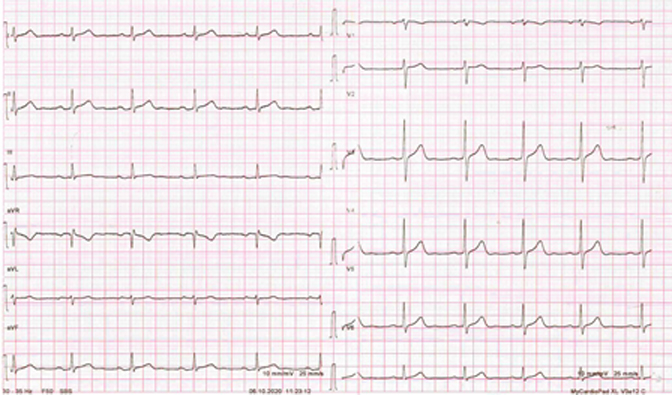
Un uomo di 52 anni, con familiarità per cardiopatia ischemica, in assenza di ulteriori fattori di rischio cardiovascolare, accedeva presso il pronto soccorso del nostro Nosocomio in seguito a comparsa di dolore toracico associato a malessere e successiva improvvisa perdita di coscienza testimoniata dalla moglie, in assenza di prodromi, con successivo rapido risveglio spontaneo dopo pochi secondi. Il paziente riferiva la persistenza da anni di episodi mattutini di dolore toracico tipico non correlati allo sforzo, per cui non aveva effettuato successivi accertamenti cardiologici. L’anno precedente era stata posta diagnosi di gastroduodenite con screzio pancreatico esordita con dolore toracico atipico (TnI negativa in quella occasione), per cui aveva iniziato terapia con gastroprotettore.
In pronto soccorso si eseguiva tracciato elettrocardiografico in paziente in quel momento asintomatico che documentava ritmo sinusale con atipie diffuse della ripolarizzazione, più marcate in sede inferiore (Figura 1). Agli esami ematici i markers di miocardiocitonecrosi risultavano ripetutamente negativi (TnI-hs primo punto 14 ng/L; secondo punto 19 ng/L). Eseguiva inoltre TC encefalo che risultava negativa per acuzie. In considerazione della tipicità della sintomatologia e del concomitante episodio sincopale, si ricoverava presso il reparto di Cardiologia con monitoraggio telemetrico 24 h nell’ipotesi diagnostica di angina instabile. L’ecocardiogramma eseguito al ricovero mostrava sfumata ipocinesia inferiore basale e postero-laterale distale; FE 55%; non valvulopatie di rilievo. Il giorno successivo, il paziente veniva sottoposto a studio coronarografico mediante accesso radiale destro, che mostrava albero coronarico con circolo coronarico a dominanza destra, esente da stenosi critiche.
A questo punto, al fine di approfondire la sintomatologia e l’episodio sincopale, il paziente veniva sottoposto a studio elettrofisiologico endocavitario, che risultava negativo per anomalie della conduzione, ma che in corso di infusione di isoproterenolo risultava positivo per induzione di sintomatologia anginosa ed alterazioni significative del tracciato ECG, con evidenza di sopraslivellamento del tratto ST in sede inferiore (Figura 2) e successiva risoluzione dopo infusione di verapamil ev. Nell’ipotesi diagnostica di vasospasmo coronarico, veniva poi condotto test ergometrico al tapis-roulant secondo protocollo di Bruce, risultato massimale per frequenza cardiaca, in assenza durante lo sforzo di sintomatologia anginosa o dispnoica e di alterazioni ECG-grafiche significative per ischemia inducibile. Al 3° minuto di recupero il paziente lamentava comparsa di angor di breve durata, con concomitante registrazione all’ECG di sopraslivellamento transitorio del tratto ST di brevissima durata con specularità (Figura 3).
A questo punto veniva quindi confermata l’ipotesi diagnostica di vasospasmo coronarico ed impostata la terapia farmacologica specifica, con diltiazem per os 60 mg bid e nitrato transdermico 10 mg per 12 h. Si dimetteva il paziente con indicazione a controllo con test ergometrico ad 1 mese in terapia medica ottimizzata.
Conclusioni
Il caso riportato è un esempio di angina vasospastica appartenente all’entità patologica conosciuta come INOCA (ischemia in assenza di malattia coronarica ostruttiva), condizione responsabile di ischemia miocardica in assenza di lesioni coronariche emodinamicamente significative (>50%) all’esame coronarografico1. Nonostante le caratteristiche “benigne” di questa entità patologica, la prognosi e qualità della vita di questi pazienti ne sono fortemente inficiate, con una maggiore prevalenza nel sesso femminile, specialmente in età avanzata 1-3 .
L’INOCA include uno spettro di condizioni fisiopatologiche capaci di determinare ischemia, tra le quali di particolare nota sono l’angina microvascolare e l’angina vasospastica.
Dal punto di vista fisiopatologico, nell’angina microvascolare la microcircolazione coronarica presenta una limitata capacità vasodilatatrice in associazione a spiccata sensibilità agli stimoli vasocostrittori. Secondo il gruppo COVADIS la diagnosi di angina microvascolare può essere formulata in presenza di 4 criteri: sintomi tipici dell’ischemia miocardica; assenza di malattia ostruttiva coronarica; evidenza strumentale di ischemia miocardica; evidenza di alterata funzione microvascolare coronarica (tramite la valutazione della Coronary Flow Reserve mediante ecocardiogramma transtoracico sotto sforzo o tramite la valutazione dell’indice di resistenza miocardica con cateterismo intracoronarico)4. L’angina vasospastica (o di Prinzmetal) invece è caratterizzata da un’iperreattività a livello dei rami coronarici epicardici a stimoli vasocostrittori, con transitoria riduzione del flusso a valle e sofferenza ischemica del tessuto miocardico tributario. Clinicamente si manifesta con angina a riposo, transitoria, a risoluzione spontanea o con pronta risoluzione alla somministrazione di nitrati. E’ stato inoltre evidenziato un caratteristico ritmo circadiano della sintomatologia (più frequente nelle prime ore del mattino), la quale è spesso innescata dall’iperventilazione 5. Il COVADIS ha definito come gold standard per la diagnosi l’esecuzione di un test provocativo angiografico (con acetilcolina o meno frequentemente con ergotamina) che documenti uno spasmo coronarico con occlusione o subocclusione (> 90% del lume vasale) transitoria, a pronta regressione con infusione intracoronarica di nitrato6. Nonostante l’elevata specificità dei test provocativi, nella pratica clinica attuale i test provocativi vengono eseguiti in pochi centri di cardiologia interventistica, e la diagnosi di vasospasmo coronarico è avvalorata dalle caratteristiche cliniche del paziente, dalla sintomatologia e dalla presenza di segni di ischemia inducibile in assenza di coronaropatia ostruttiva critica.
Le opzioni terapeutiche includono le modifiche dello stile di vita e la correzione dei fattori di rischio, a cui si aggiungono agenti farmacologici rappresentati dai calcio-antagonisti (sia per l’angina vasospastica che per angina microvascolare) e dai beta-bloccanti, ranolazina e ivabradina (per l’angina microvascolare)7.
Bibliografia
1.Padro T, Manfrini O, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on “coronary microvascular dysfunction in cardiovascular disease”. Cardiovasc Res 2020;116:741-55.
2. Ford TJ, Yii E, Sidik N, et al. Ischemia and no obstructive coronary artery disease: prevalence and correlates of coronary vasomotion disorders. Circ Cardiovasc Interv 2019;12:e008126.
3. Shaw LJ, Bairey Merz CN, et al. Insight from the NHLBI-sponsored Women’s Ischemia Syndrome Evaluation (WISE) Study: Part I: gender differences in traditional and novel risk factors, symptom evaluation, and gender-optimized diagnostic strategies. J Am Coll Cardiol 2006;47(3 Suppl): S4-20.
4. Ong P, Camici PG, Beltrame JF, et al.; Coronary Vasomotion Disorders International Study Group (COVADIS). International standardization of diagnostic criteria for microvascular angina. Int J Cardiol 2018;250:16-20.
5. Lanza GA, Patti G, Pasceri V, et al. Circadian distribution of ischemic attacks and ischemia-related ventricular arrhythmias in patients with variant angina. Cardiologia. 1999 Oct;44(10):913-9. PMID: 10630051.
6. Beltrame JF, Crea F, Kaski JC, et al.. Coronary Vasomotion Disorders International Study Group (COVADIS). The who, what, why, when, how and where of vasospastic angina. Circ J 2016;80:289-98.
7. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J. 2020 Oct 1;41(37):3504-3520. doi: 10.1093/eurheartj/ehaa503. PMID: 32626906; PMCID: PMC7577516.
Un raro caso di dilatazione del seno coronarico: il valore aggiunto dell’approccio multi-imaging.
A. Denegri, A. Albini, A. Barbieri, G. Boriani
S.C. Cardiologia – AOU Policlinico di Modena. Scuola di Specializzazione in Malattie dell’apparato cardiovascolare. Università degli studi di Modena e Reggio Emilia
Caso Clinico
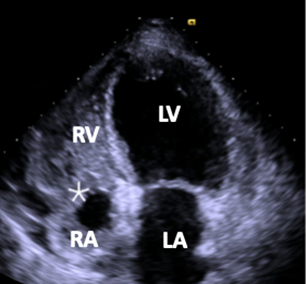
Una donna di 59 anni senza fattori di rischio cardiovascolare giunge all’attenzione di un cardiologo del territorio a seguito dell’insorgenza subacuta (circa 4-6 mesi) di dispnea per sforzi moderati. In anamnesi la paziente riferisce il riscontro occasionale di un Forame Ovale Pervio di “grandi dimensioni” (referto originale smarrito) circa 10 anni prima e di essere in follow-up clinico ed ecografico per angiomi epatici multipli. Il collega che per primo valuta la paziente riporta il riscontro obiettivo di un soffio continuo sisto-diastolico maggiormente udibile a livello marginosternale destro e ad un ecofocus reperta una “massa” a contenuto anecogeno a livello atriale destro. L’elettrocardiogramma registrato durante la visita mostra un ritardo incompleto della branca destra in assenza di alterazioni significative della ripolarizzazione ventricolare. Sulla base di tali reperti, invia la paziente presso il nostro Echolab per approfondimento diagnostico.
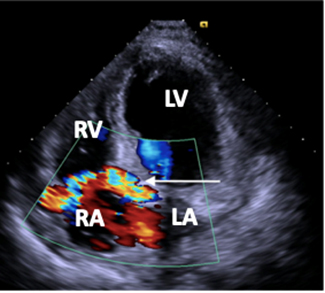
L’ecocardiografia transtoracica conferma la presenza di una struttura a contenuto anecogeno a livello dell’atrio destro e mostra un seno coronarico (CS) severamente dilatato, oltre ad una moderata dilatazione dell’origine della coronaria destra (RCA). Al color-doppler appare evidente un flusso continuo sisto-diastolico a livello del seno coronarico. (fig. 1)
Per indagare la persistenza di una vena cava superiore sinistra, viene effettuata un’ecocardiografia con iniezione di salina agitata in arto superiore sinistro che non mostra precoce opacizzazione del CS rispetto alle camere di destra. (Fig. 2)
Il quadro viene ulteriormente approfondito con ecocardiografia transesofagea (ETE) che esclude shunt intracardiaci e conferma la severa dilatazione del CS, il quale impronta la parete posteriore dell’atrio destro, dando origine dell’immagine a contenuto anecogeno vista dall’approccio transtoracico. Il riscontro di CS ectasico, l’entità del flusso sisto-diastolico, l’esclusione di anomali ritorni venosi e la dilatazione dell’emergenza della RCA portano alla formulazione del sospetto di fistola artero-venosa coronarica (CAVF) tra RCA e CS.La TC cardiaca con ricostruzione 3D conferma il sospetto e mostra come sia la RCA sia il CS siano estremamente dilatati (diametro sul piano assiale 2.1 e 4.5 cm, rispettivamente) e non sia possibile visualizzare l’opacizzazione della vena cardiaca magna. L’esame esteso al torace e all’addome mostra inoltre minuti difetti di riempimento segmentari a livello del lobo polmonare superiore destro e un voluminoso emangioma cavernoso nel lobo epatico destro. (Fig.3)
Vista l’ottimale definizione anatomica della malformazione ottenuta con la ricostruzione TC 3D, non appare indicato procedere a studio angiografico invasivo.
La successiva risonanza magnetica cardiaca non evidenzia ischemia a livello del territorio di competenza della RCA. Ad ulteriore completamento diagnostico, una angio-RM cerebrale esclude la presenza di ulteriori malformazioni vascolari a livello cerebrale.
Il caso della paziente viene discusso collegialmente con i colleghi della cardiochirurgia. Visto il riscontro occasionale del reperto e la non diretta correlazione tra il dato anatomico e la lieve dispnea da sforzo, la non evidenza di alterazioni significative della perfusione cardiaca e della complessità dell’approccio cardiochirurgico, viene posta indicazione ad atteggiamento “watchful waiting” con follow-up annuale, da anticipare in caso di comparsa di sintomatologia suggestiva di complicanze.
Discussione
Questo caso clinico può avere una duplice valenza: da un lato, ricordare l’approccio diagnostico e le possibili diagnosi differenziali della dilatazione del CS; dall’altro mostrare una delle più rare tra queste diagnosi, ovvero la CAVF. Nel nostro caso la dilatazione del CS e della RCA era tale da improntare la parete posteriore dell’atrio destro dando una “falsa immagine” di massa anecogena atriale. Una volta inquadrata l’immagine nel contesto di un CS dilatato, il primo passaggio è stato escludere ritorni venosi anomali mediante bubble test con iniezione dai due arti superiori ed ETE. La corretta interpretazione dei reperti ecocardiografici ed un approccio multi-imaging hanno portato al riconoscimento di una CAVF come causa di CS dilatato.
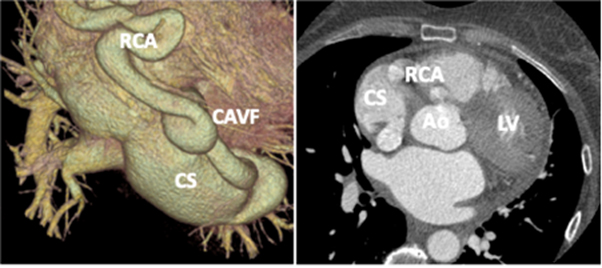
Le CAVF sono una rara entità e si presentano nella maggior parte dei pazienti con dolore toracico, palpitazioni o sincope1, sebbene possano essere occasionalmente riscontrate in pazienti asintomatici. Un soffio continuo sisto-diastolico è il reperto obiettivo più frequente.2 Le fistole tra RCA e CS sono la forma più frequente e rappresentano circa il 7% di tutti i casi di CAVF.3 L’ecocardiografia bidimensionale corredata dall’esame color-doppler può mostrare l’origine, il decorso e l’entità del flusso ematico nelle corrispondenti camere cardiache. Tuttavia, nella maggior parte dei casi, un approccio multi-imaging è necessario per confermare il sospetto di CAVF. In particolare, la TC con ricostruzione 3D è in grado di fornire una ottimale definizione anatomica e, in una buona parte dei casi, permette di evitare l’esame angiografico invasivo. Le CAVF congenite vanno incontro infrequentemente a chiusura spontanea. Il trattamento, pertanto, può essere chirurgico o percutaneo sulla base dell’opinione dell’heart team. 4
Referenze
1. Imbalzano, E., Dattilo, G., Scarpelli, M., Lo Gullo, A. & Saitta, A. Left coronary artery fistula to right ventricle complicated heart failure in a patient on hemodialysis. Intern. Emerg. Med. 8, 765–766 (2013).
2. Yuan, M., Bai, W. J., Li, C. M. & Rao, L. Fistula between the right coronary artery and coronary sinus: a case report and literature review. Anatol. J. Cardiol. 18, 79–80 (2017).
3. Sharma, U. M., Aslam, A. F. & Tak, T. Diagnosis of coronary artery fistulas: clinical aspects and brief review of the literature. The International journal of angiology : official publication of the International College of Angiology, Inc 22, 189–192 (2013).
4. Ali, M., Kassem, K. M., Osei, K. & Effat, M. Coronary artery fistulae. J. Thromb. Thrombolysis 48, 345–351 (2019).
Flutter atriale nel paziente con malattia critica COVID-19: strategia di controllo del ritmo per il compenso cardiorespiratorio
Rodolfo Francesco Massafra, Matteo Bertini, Francesco Vitali, Michele Malagù, Claudio Rapezzi
Centro Cardiologico Universitario, Università degli Studi di Ferrara, Arcispedale S. Anna, Ferrara
Abstract
Di seguito viene illustrato il caso di un paziente con malattia critica COVID-19 in cui la comparsa improvvisa di flutter atriale ad elevata risposta ventricolare ha giocato un ruolo determinante nel peggioramento dell’insufficienza respiratoria, e in cui dopo alcuni tentativi di controllo farmacologico del ritmo e della frequenza, una strategia di controllo del ritmo mediante ablazione transcatetere ha portato a un decisivo miglioramento del quadro clinico. Il caso evidenzia come la patologia COVID-19 abbia un impatto notevole sul sistema cardiovascolare anche per la possibile insorgenza di aritmie che possono aggravare il compenso cardio-respiratorio, creando un circolo vizioso.
Caso clinico
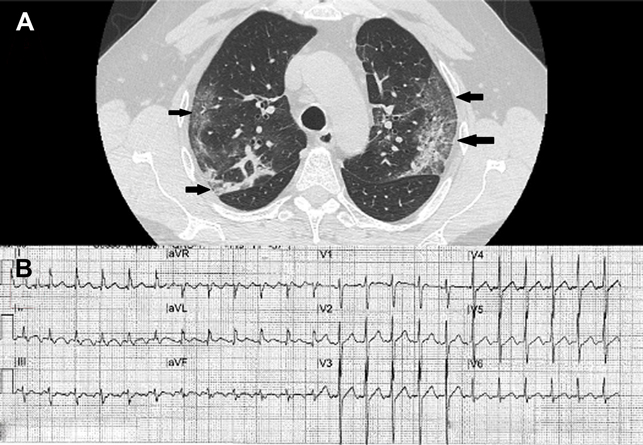
Un uomo di 61 anni, senza nessun precedente cardiovascolare noto né fattori di rischio cardiovascolari o comorbidità di rilievo, giungeva in PS per dispnea, tosse e febbre (39°C). Normoteso (PA 120/60 mmHg), tachipnoico (33 atti/minuto) e con SpO2 89%. Per il rapido peggioramento dell’insufficienza respiratoria veniva intubato. Alla HRCT emergeva un quadro di severa polmonite interstiziale bilaterale con aspetto “crazy paving” (Fig. 1A). Ricoverato in ambiente intensivo, l’ECG all’ingresso mostrava tachicardia sinusale a FC 100 bpm. Seguiva riscontro di positività del tampone nasofaringeo RT-PCR per RNA di SARS-CoV2. In nona giornata, per il miglioramento del quadro respiratorio, il paziente veniva estubato e posto in NIV con casco. Nella giornata successiva si assisteva a riacutizzazione di insufficienza respiratoria con evidenza al monitor ECG di flutter atriale tipico comune ad elevata risposta ventricolare (Fig. 1B).
Veniva eseguito ecocardiogramma transtoracico, che mostrava ventricolo sinistro con funzione sistolica ai limiti di norma (FE 50%), segni di aumento delle pressioni di riempimento (E/e’ media 16) e lieve dilatazione atriale destra. Alla luce della disfunzione diastolica e del mancato contributo atriale al riempimento ventricolare, ritenuta la correzione di tali elementi in grado di migliorare il compenso cardio-respiratorio, si decideva di attuare una strategia di controllo del ritmo. Visto il riscontro laboratoristico di alterazione degli indici di funzionalità epatica in contestuale verosimile sovrainfezione batterica, si decideva di eseguire tentativo di cardioversione elettrica esterna (CVE) a 120J, come da indicazioni ESC nel paziente emodinamicamente stabile (Classe I, LoE B) quale valida alternativa in prima istanza al controllo farmacologico della frequenza o del ritmo.1 La CVE esitava in transitorio ripristino di ritmo sinusale, ma pressoché immediata ricomparsa dell’aritmia. Seguiva nuovo tentativo di CVE a 150J in corso di amiodarone in infusione, con ripristino del ritmo sinusale, ma nuova recidiva dell’aritmia a distanza di ore. Fallito il controllo del ritmo, si optava per controllo della frequenza mediante infusione di metoprololo, verapamil e digossina a dosaggio pieno, (Classe IIa, LoE B) senza però alcun beneficio clinico.
Discusso il caso in team multidisciplinare (cardiologo clinico, elettrofisiologo, rianimatore e pneumologo), si continuava a imputare alla tachiaritmia un ruolo primario nell’alterazione del compenso cardio-respiratorio, perciò, ancora una volta si riteneva opportuno intraprendere strategia di controllo del ritmo. Inoltre, data la gravità del quadro clinico e la refrattarietà dell’aritmia a tutte le strategie terapeutiche disponibili indicate dalle linee guida ESC nello specifico setting acuto,1 si decideva per esecuzione di ablazione transcatetere con assistenza anestesiologica. In considerazione della presenza di ventilazione con casco, della conseguente difficoltà nell’utilizzo di fluoroscopia, e data l’impossibilità di mantenere a lungo il clinostatismo, si optava per procedura a raggi zero interamente guidata da mappaggio elettroanatomico tridimensionale, riducendo al minimo i tempi operatori. La procedura si svolgeva in conformità alle raccomandazioni internazionali per garantire la sicurezza del paziente e minimizzare l’esposizione professionale del personale impiegato (un elettrofisiologo senior, due anestesisti e un infermiere specializzato)2.
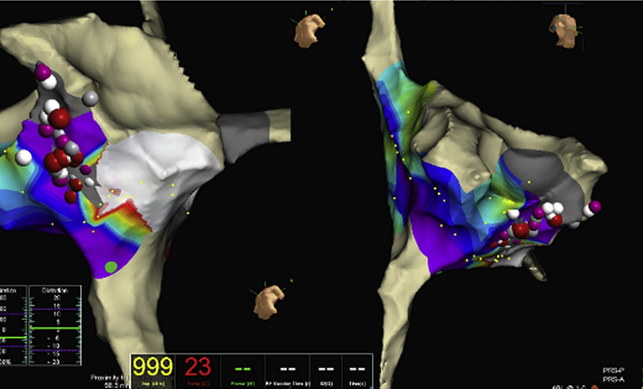
Posto il paziente in clinostatismo, ventilato con casco (Fig. 2), si procedeva a doppia puntura venosa femorale destra. Eseguito mappaggio endocardico, si confermava la presenza di flutter atriale istmo cavo-tricuspidalico dipendente, che veniva efficacemente trattato tramite ablazione mediante radiofrequenza, con ripristino di ritmo sinusale. Alla mappa di attivazione si confermava blocco bidirezionale istmo cavo-tricuspidalico durante stimolazione dall’ostio coronarico.3 (Fig. 3) La durata complessiva della procedura era inferiore a 60 minuti.
Al ripristino del ritmo sinusale il paziente mostrava un notevole e pressoché immediato miglioramento della funzionalità respiratoria, con passaggio della SpO2 dall’84% al 98% e miglioramento soggettivo della dispnea.
Conclusioni
Il caso clinico sottolinea il contributo ormai noto del flutter atriale ad elevata risposta ventricolare al deterioramento respiratorio nel paziente COVID-19,4,5 oltre che il potenziale ruolo terapeutico della strategia di controllo del ritmo mediante ablazione transcatetere, ad oggi largamente inesplorato in questo scenario. Al momento in letteratura non vi sono evidenze di qualità circa l’efficacia della terapia medica finalizzata al controllo del ritmo o della frequenza nel flutter atriale nel paziente critico COVID-19.5 Tuttavia, l’efficacia della terapia medica in questi pazienti è da ritenersi potenzialmente bassa per una serie di ragioni, delle quali la patologia polmonare sottostante e lo stato infiammatorio sistemico assumono probabilmente un ruolo fondamentale, agendo da fattori scatenanti.4 Inoltre, l’utilizzo di amiodarone per il controllo del ritmo potrebbe esporre a severi effetti avversi pneumotossici da citotossicità diretta e da ipersensibilità, particolarmente problematici in questo genere di paziente. L’ablazione transcatetere è una procedura relativamente semplice, ed è il trattamento più efficace per il mantenimento del ritmo sinusale nel flutter atriale.3,6 Essa si mostra potenzialmente utile anche in alcuni scenari critici di insufficienza respiratoria acuta con severa pneumopatia sottostante, in cui diventa decisivo ristabilire un adeguato compenso cardiocircolatorio, qualora l’aritmia risulti refrattaria alle strategie terapeutiche attualmente indicate dalle linee guida.
References
1. Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, Calkins H, Corrado D, Deftereos SG, Diller GP, Gomez-Doblas JJ, Gorenek B, Grace A, Ho SY, Kaski JC, Kuck KH, Lambiase PD, Sacher F, Sarquella-Brugada G, Suwalski P, Zaza A; ESC Scientific Document Group. 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020 Feb 1;41(5):655-720. doi: 10.1093/eurheartj/ehz467. Erratum in: Eur Heart J. 2020 Nov 21;41(44):4258. PMID: 31504425.
2. Lakkireddy DR, Chung MK, Gopinathannair R, et al. Guidance for Cardiac Electrophysiology During the COVID-19 Pandemic from the Heart Rhythm Society COVID-19 Task Force; Electrophysiology Section of the American College of Cardiology; and the Electrocardiography and Arrhythmias Committee of the Council on Clinical Cardiology, American Heart Association. Circulation 2020;141: e823–31
3. Shah DC, Jaïs P, Haïssaguerre M, et al. Three-dimensional mapping of the common atrial flutter circuit in the right atrium. Circulation.1997; 96:3904–3912.
4. Peltzer B, Manocha KK, Ying X, Kirzner J, Ip JE, Thomas G, Liu CF, Markowitz SM, Lerman BB, Safford MM, Goyal P, Cheung JW. Outcomes and mortality associated with atrial arrhythmias among patients hospitalized with COVID-19. J Cardiovasc Electrophysiol. 2020 Dec;31(12):3077-3085. doi: 10.1111/jce.14770. Epub 2020 Oct 14. PMID: 33017083; PMCID: PMC7675597.
5. Colon, C. M., Barrios, J. G., Chiles, J. W., McElwee, S. K., Russell, D. W., Maddox, W. R., & Kay, G. N. (2020). Atrial Arrhythmias in COVID-19 Patients. JACC: Clinical Electrophysiology. doi:10.1016/j.jacep.2020.05.015
6. Natale A, Newby KH, Pisanó E, Leonelli F, Fanelli R, Potenza D, Beheiry S, Tomassoni G. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol. 2000 Jun;35(7):1898-904. doi: 10.1016/s0735-1097(00)00635-5. PMID: 10841241.
Sindrome di Takotsubo e vasospasmo coronarico: due facce della stessa medaglia?
Pier Pasquale Leone, Giuseppe Pinto
Dipartimento di Scienze Biomediche, Humanitas University, Pieve Emanuele (MI), Italia
IRCCS Humanitas Research Hospital, Rozzano (MI), Italia
ABSTRACT
La cardiomiopatia di Takotsubo non si verifica usualmente in pazienti giovani nè esordisce con arresto cardiocircolatorio. Indagando le possibili cause di arresto cardiaco in un paziente di 35 anni che lamentava da qualche giorno dolore toracico e con un riscontro imaging di cardiomiopatia di Takotsubo, veniva documentato un vasospasmo severo dell’arteria interventricolare anteriore. La disfunzione endoteliale rientra tra i meccanismi alla base sia del vasospasmo coronarico che della cardiomiopatia di Takotsubo: siamo davanti ad un epifenomeno della stessa malattia?
CASO CLINICO
Presentazione
Un paziente di 35 anni in buone condizioni di salute avvertiva dolore toracico mentre giocava a calcetto con gli amici. Aveva avuto dolore toracico che regrediva spontaneamente anche nei giorni precedenti. Il suo unico fattore di rischio cardiovascolare era il fumo attivo. Dopo alcuni secondi cadeva a terra e veniva immediatamente soccorso dai compagni. In assenza di segni di circolo veniva iniziata la Rianimazione Cardio-Polmonare (RCP) dagli astanti e successivamente dal personale medico. Il ritmo di presentazione dell’arresto cardiocircolatorio corrispondeva a una fibrillazione ventricolare. Dopo 3 DC shock comparsa di ritorno della circolazione spontanea (ROSC) per cui si interrompeva la RCP. Il paziente veniva quindi intubato e condotto in Pronto Soccorso presso il nostro ospedale.
Gestione clinica
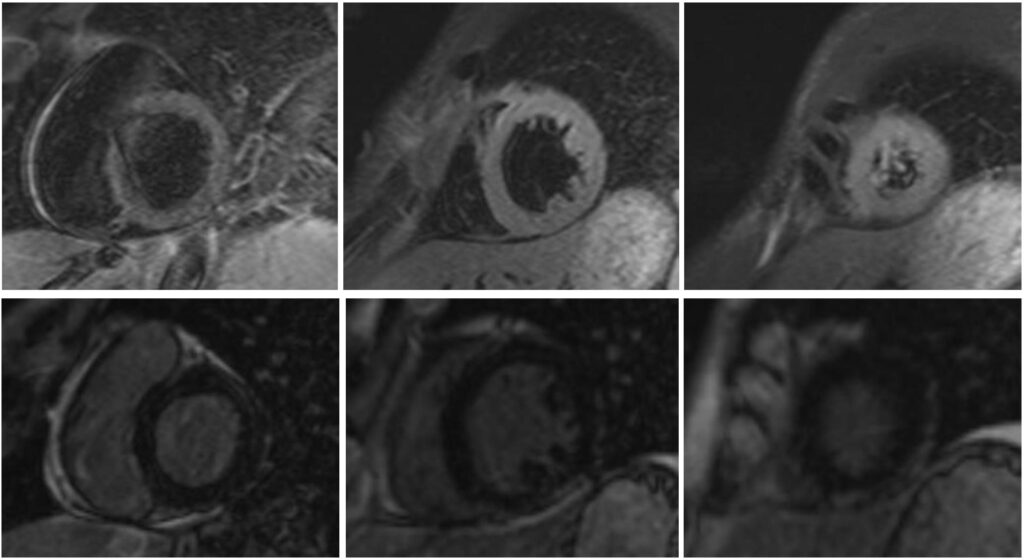
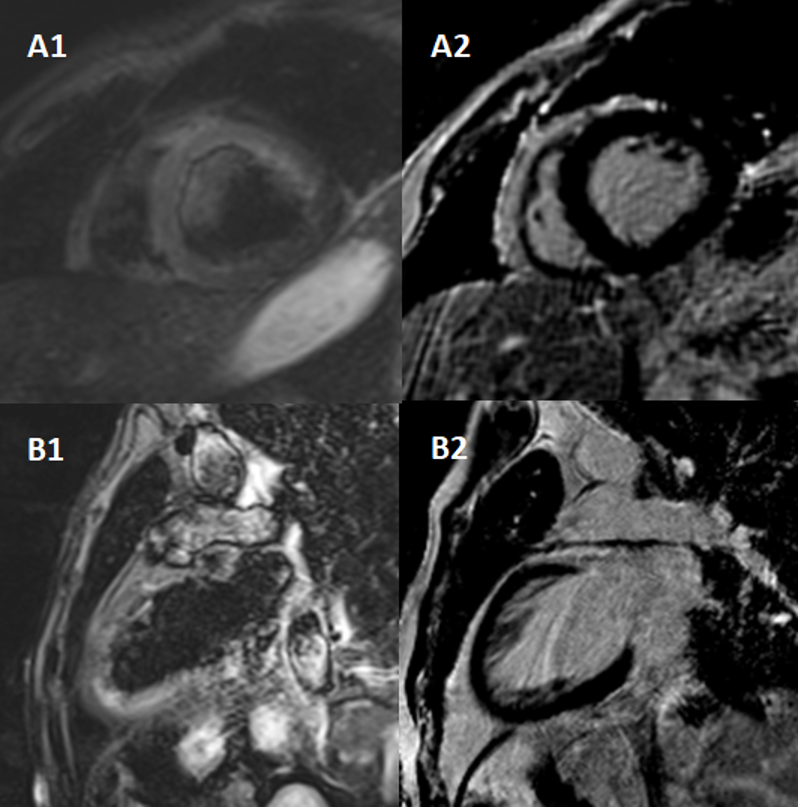
In alto. Sequenza T2 TIRM asse corto del ventricolo sinistro a livello basale, medio e apicale. Si nota iperintensità di segnale principalmente a livello apicale, riferibile a diffuso edema miocardico.
In basso. Acquisizione tardiva dopo somministrazione di MDC in asse corto a livello basale, medio e apicale. Si nota l’assenza di accumulo di LGE.
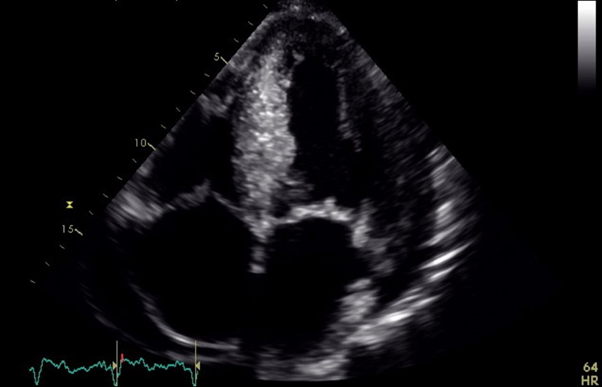
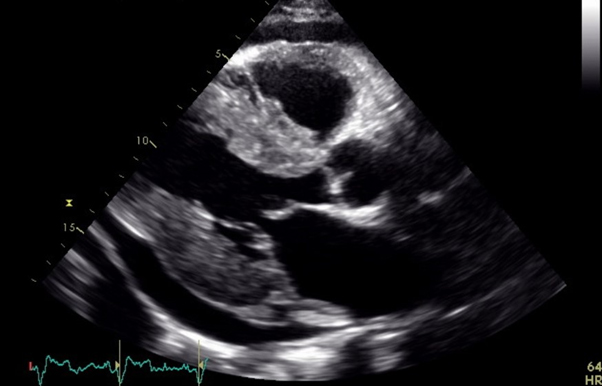
All’arrivo in PS i parametri vitali erano nella norma (PA 100/70 mmHg, FC 110 bpm, SpO2 100%). L’ECG documentava una tachicardia sinusale senza alterazioni significative del tratto ST. Agli esami ematochimici si riscontrava lieve rialzo degli indici di miocardionecrosi (hsTnI 80 ng/L, valori di riferimento 0-20 ng/L). L’EGA mostrava una lieve acidosi metabolica (pH 7.29, pO2 130, pCO2 39, HCO3- 18, lat 4). Veniva, quindi, effettuato un ecocardiogramma transtoracico che mostrava una severa disfunzione del ventricolo sinistro da ipocinesia diffusa con regionalità più marcata in apice (FEVS 25%) in assenza di valvulopatie di rilievo o di disfunzione ventricolare destra.
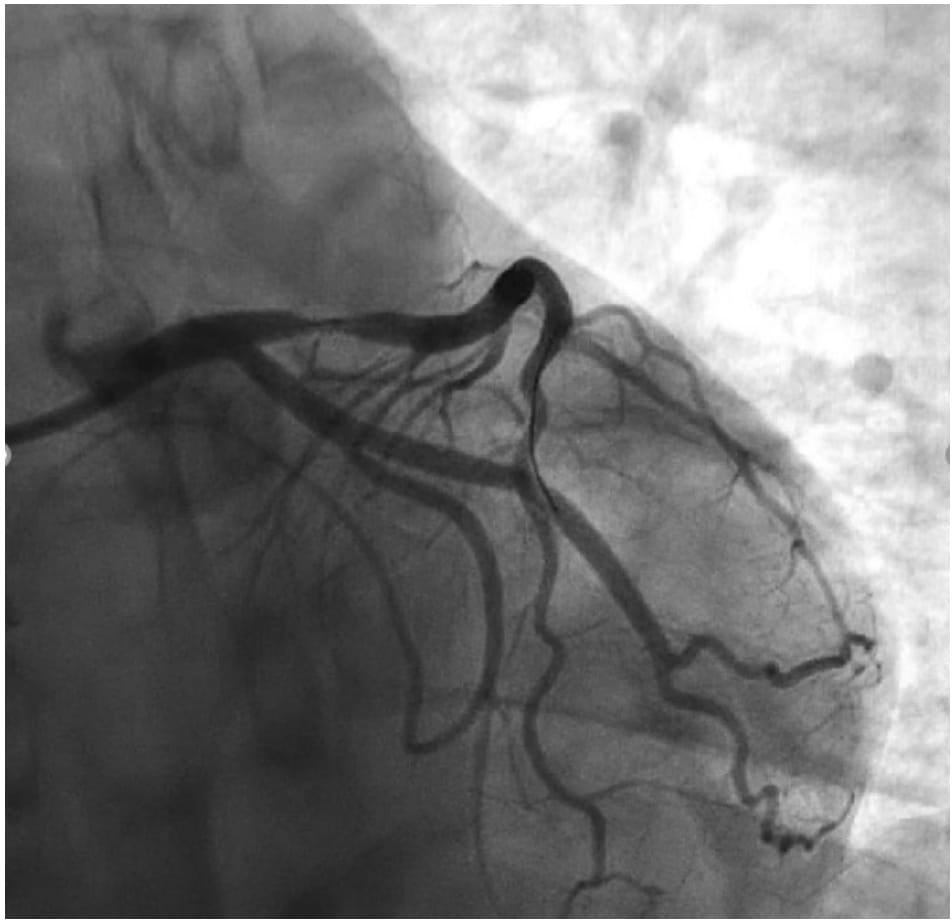
Nonostante l’ECG non mostrasse segni di ischemia miocardica in atto, sulla base anche della sintomatologia descritta dai soccorritori, si decideva di condurre il paziente in sala di emodinamica. Alla coronarografia si documentava un albero coronarico epicardico esente da malattia. Alla luce dei risultati della coronarografia e dell’ecocardiogramma veniva posta diagnosi di cardiomiopatia di Takotsubo.
Dopo 24 ore di monitoraggio in terapia intensiva per l’ipotermia terapeutica, eseguita nonostante il tempo di no-flow fosse trascurabile per il tempestivo inizio della RCP, il paziente veniva estubato.
La RMN cardiaca confermava la severa disfunzione ventricolare sinistra con stunning del miocardio apicale e mostrava un edema diffuso in regione apicale in assenza di LGE (FIG 1).
In considerazione della giovane età del paziente, non caratteristica per la classica presentazione della Takotsubo, si decideva di studiare in maniera più approfondita, anche con l’ausilio di imaging intracoronarico (OCT), l’albero coronarico epicardico, ed eventualmente effettuare un test provocativo con acetilcolina per escludere la possibilità di vasospasmo coronarico. Si repertava una lieve ateromasia non critica sull’arteria discendente anteriore ostio-prossimale: all’avanzamento del catetere OCT, però, veniva indotto un severo spasmo coronarico (FIG 2-3) con concomitante insorgenza di dolore toracico tipico e sopraslivellamento del tratto ST nelle derivazioni anteriori. Si procedeva quindi a iniezione di nitroglicerina intracoronarica con risoluzione del quadro.
Veniva quindi iniziata terapia con calcio antagonista ad azione centrale (diltiazem), cardioaspirina, statina (per la seppur minima malattia aterosclerotica coronarica) e ACE inibitore (per la prevenzione del rimodellamento cardiaco). Durante l’osservazione si assisteva a discreta ripresa della funzione contrattile del ventricolo sinistro. Il picco della curva di rilascio enzimatico si è verificato per valori di troponina pari a 2500 ng/L (valori di riferimento 0-20 ng/L). Veniva posta indicazione ad impianto di ICD in prevenzione secondaria e, visto il trend bradicardico e la necessità di terapia cronotropa negativa, si propendeva per device endocardico.
La restante degenza risultava priva di complicanze e il paziente si manteneva asintomatico e in buon compenso cardiocircolatorio.
Alla visita di controllo dopo tre mesi dalla dimissione il paziente si presentava in buone condizioni generali e non riferiva episodi di dolore toracico né sincopi. All’interrogazione del device non si documentavano eventi aritmici.
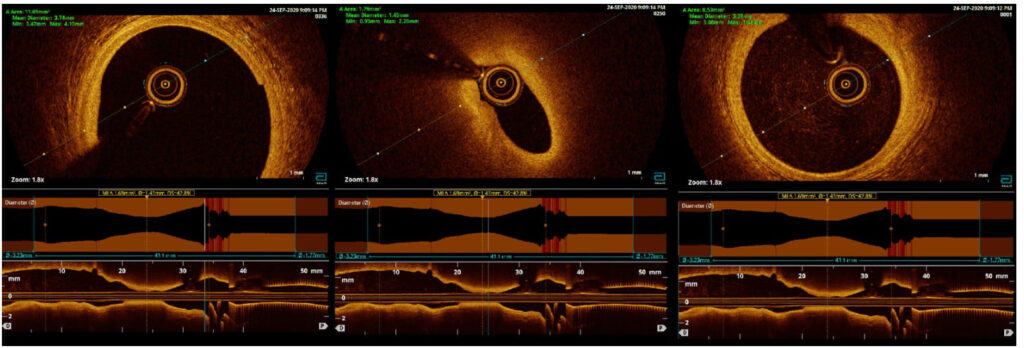
Imaging intracoronarico tramite OCT. Si nota il lume ristretto nell’immagine centrale per spasmo coronarico.
Conclusioni
La fisiopatologia della cardiomiopatia di Takotsubo è complessa e non ancora del tutto chiarita. La teoria più accreditata propende per un’iperattività del sistema simpatico con conseguente rilascio di un’aumentata quantità di catecolamine e contestuale alterato metabolismo cellulare e disfunzione del microcircolo. Recenti evidenze suggeriscono una connessione tra lo spasmo del circolo coronarico epicardico e la cardiomiopatia di Takotsubo. È ben appurato che lo spasmo coronarico possa essere esacerbato da fattori quali il fumo e l’iperventilazione: la prima condizione presente in anamnesi, la seconda verificatasi verosimilmente durante l’attività fisica del paziente. Per documentare il vasospasmo del circolo coronarico epicardico spesso è necessario ricorrere a test provocativo con acetilcolina o ergonovina durante coronarografia. Nel nostro caso non è servito eseguire questo test poiché il vasospasmo si è verificato semplicemente con uno stimolo meccanico. La disfunzione endoteliale è determinata da uno squilibrio tra molecole che, a livello endoteliale, mediano la vasodilatazione e hanno proprietà antimitogeniche e antitrombogeniche e sostanze con potenziale vasocostrittore, protrombotico e proliferativo. Questo squilibrio che determina iperreattività endoteliale è probabilmente alla base di due entità come la sindrome di Takotsubo e il vasospasmo coronarico. Resta ancora da capire se queste siano due aspetti della stessa malattia o due condizioni che possono coesistere con alla base meccanismi fisiopatologici simili.
References
- Pelliccia F , Kaski JC , Crea F , Camici PG. Pathophysiology of takotsubo syndrome. Circulation 2017;135:2426–2441.
- Templin C , Ghadri JR , Diekmann J , Napp LC , Bataiosu DR , Lüscher TF et al. Clinical features and outcomes of takotsubo (stress) cardiomyopathy. N Engl J Med 2015;373:929–938.
- Angelini P. Transient left ventricular apical ballooning: a unifying pathophysiologic theory at the edge of Prinzmental angina. Cathet Cardiovasc Intervent 2008;71:342–352.
- Beltrame JF, Crea F, Kaski JC, et al.; Coronary Vasomotion Disorders International Study Group (COVADIS). International standardization of diagnostic criteria for vasospastic angina. Eur Heart J 2017;38:2565-8. Documento nato con l’intento di standardizzare i criteri diagnostici del vasospasmo coronarico.
- Montone RA, Niccoli G, Fracassi F, et al. Patients with acute myocardial infarction and non-obstructive coronary arteries: safety and prognostic relevance of invasive coronary provocative tests. Eur Heart J 2018;39:91-8.
Abbreviazioni
ACE, angiotensin converting enzyme; ECG, elettrocardiogramma; EGA, emogasanalisi; FEVS, frazione d’eiezione del ventricolo sinistro; FV, fibrillazione ventricolare; ICD, implantable cardioverter defibrillator; LGE, late gadolinium enhancement; OCT, optical coherence tomography; PS, pronto soccorso; RCP, rianimazione cardio-polmonare; RMN, risonanza magnetica nucleare; ROSC, return of spontaneous circulation;
MINOCA da sindrome di anticorpi anti-fosfolipidi: un caso clinico di diagnosi “catastrofica”
Luca Paolucci, Giuseppe Verolino, Michele Mattia Viscusi, Francesco Piccirillo.
Dipartimento di Scienze Cardiovascolari, Università Campus Bio-Medico di Roma, Italia. Direttore: Prof. Francesco Grigioni
Abstract
Paziente donna di 49 anni con dolore toracico acuto in II giornata post-operatoria di isteroscopia operativa. In anamnesi, un episodio di embolia polmonare e due episodi di sindrome coronarica acuta con evidenza angiografica di coronarie indenni da lesioni; fra le patologie associate, si evidenziava un pattern trombofilico dominato da sindrome di anticorpi anti-fosfolipidi (APS). Il work-up diagnostico, comprensivo di ECG, esami ematochimici con curva della TnI e dosaggio degli anticorpi anti-fosfolipidi, ecocardiogramma con valutazione del global longitudinal strain, AngioTC torace, coroTC e RMN cardiaca, consentiva di porre diagnosi di infarto miocardico a coronarie indenni (MINOCA) nel contesto di APS catastrofica.
Caso clinico:
Donna di 49 anni con dolore toracico di nuova insorgenza, in II giornata post-operatoria di isteroscopia operativa per poliposi uterina. Alla valutazione, la paziente si presentava emodinamicamente stabile, con obiettività cardiologica e toracica nei limiti. L’ECG escludeva segni di ischemia acuta. L’anamnesi cardiovascolare includeva un’embolia polmonare nel 2001, per la quale paziente assumeva anticoagulante (anti-vitamina K – VKA), e due sindromi coronariche acute a coronarie indenni, già sottoposte a studio coronarografico e angio-TC coronarica, nel 2014 e nel 2015. Fra le patologie associate, si evidenziava un forte pattern trombofilico, con deficit delle proteine C ed S, una mutazione in eterozigosi per il gene dell’MTHFR e una diagnosi di sindrome da anticorpi antifosfolipidi (APS). Una settimana prima della comparsa di dolore, la paziente aveva sospeso il VKA ed iniziato bridging con Enoxaparina 8000 UI/Bid, era stata dunque sottoposta ad isteroscopia operativa ed in I giornata post-operatoria aveva iniziato a manifestare febbre, malessere generale e nausea.
Agli esami ematici, si rilevava aumento della TnI (35372 pg/ml; upper reference limit 15,6 pg/ml). La paziente veniva pertanto trasferita in UTIC per proseguire il work up diagnostico. Veniva eseguito un ecocardiogramma che non mostrava particolari anomalie al 2D (FE 55%, non valvulopatie rilevanti). Nel sospetto di un nuovo evento tromboembolico/dissezione aortica veniva eseguita una angio TC torace/addome che non mostrava difetti di riempimento a carico delle arterie polmonari e/o flap intimali. Come reperti collaterali, venivano descritti un quadro infiammatorio compatibile con aortite in sede sottorenale e un impegno parenchimale polmonare con aspetto a vetro smerigliato a carico dei lobi polmonari inferiori bilateralmente.
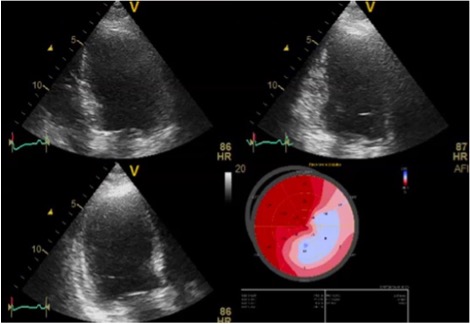
Una nuova valutazione ecocardiografica evidenziava una significativa riduzione del global longitudinal strain in sede antero-laterale e posteriore (GLS -11%) (Figura 1).
Alla luce delle documentate anomalie della cinesi segmentaria si procedeva, nel sospetto di SCA-NSTEMI, ad esecuzione di angio-TC coronarica, che non mostrava lesioni coronariche, coerentemente con il dato anamnestico. La paziente proseguiva il monitoraggio in UTIC durante il quale si eseguivano prelievi seriati della TnI, con un andamento compatibile con quello di un IMA tipico (picco TnI 115.000 pg/ml) (Figura 2).
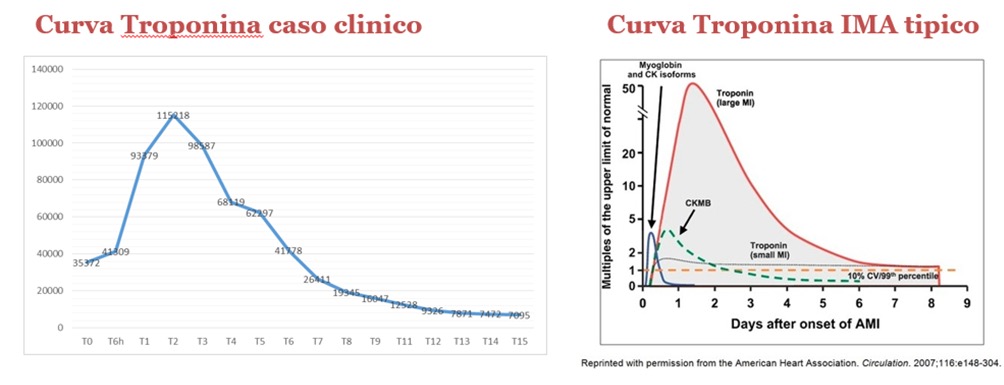
Veniva pertanto eseguita risonanza magnetica cardiaca (Figura 3 – FIGURA CHIAVE), che documentava esiti ischemici a carico dei territori vascolarizzati da arteria discendente anteriore e coronaria destra (coerentemente con il dato ecocardiografico). Si poneva pertanto diagnosi di specific MINOCA.
Rimaneva comunque aperta la questione riguardante la ragione e l’evento scatenante il MINOCA. Anamnesticamente, questo rappresentava il terzo evento coronarico per la paziente, al quale si doveva aggiungere l’evento tromboembolico pregresso. Inoltre risultava, oltre quello miocardico, anche interessamento a carico dell’aorta addominale e del parenchima polmonare. Alla luce della nota APS, si procedeva ad un dosaggio seriato degli anticorpi tipicamente associati alla patologia, che mostravano tutti valori criticamente sopra la soglia di riferimento.
Dato il quadro combinato di MINOCA, aortite addominale ed infiammazione del parenchima polmonare in corrispondenza di una documentata riattivazione del quadro autoimmune correlato con la malattia, veniva posta diagnosi di sindrome catastrofica da anticorpi antifosfolipidi (CAPS).
In seguito a valutazione reumatologica, si iniziava terapia con alte dosi di corticosteroidi e reintroduzione del VKA (range di INR prefissato 2,5-3,5). Nel corso della degenza si assisteva a recupero pressoché completo della cinesi distrettuale e scomparsa del quadro infiammatorio a carico dell’aorta addominale. Il decorso successivo intra-ospedaliero risultava libero da complicanze e la paziente veniva dimessa con indicazione a terapia cronica con corticosteroidi e VKA.
L’infarto miocardico a coronarie indenni (MINOCA) è una condizione clinica complessa, caratterizzata da elevazione dei marker di miocardionecrosi e sintomatologia compatibile con una sindrome coronarica acuta in assenza di lesioni coronariche (1). Rappresenta una diagnosi prevalentemente di esclusione e tutt’ora la sua definizione e il suo work-up diagnostico sono oggetto di costante revisione nelle più recenti linee guida (2). Nonostante spesso non sia facile raggiungere una diagnosi univoca, dietro ad un MINOCA può celarsi un quadro sindromico più complesso.
La CAPS è condizione piuttosto rara associata alla APS in cui la riattivazione del sistema immunitario provoca un coinvolgimento multisistemico, con la comparsa di eventi ischemici ed infiammatori polidistrettuali (3). Nell’ultimo consensus specifico (3), la sindrome viene definita dall’interessamento di almeno 3 organi diversi, dalla comparsa della sintomatologia in un arco di tempo inferiore ad una settimana e da un titolo anticorpale associato > 40 UI/L, in assenza di diagnosi alternative. I fenomeni causali tipicamente associati alla CAPS sono molteplici, ma fra essi risultano frequentemente associate la sospensione dei VKA, gli interventi chirurgici e le patologie dell’apparato pelvico.
In specifici quadri patologici ad altissimo rischio ischemico (quali l’APS), la sospensione dell’anticoagulante può rappresentare un pericoloso trigger per eventi cardiovascolari maggiori ed il bridging con l’eparina sotto cute (anche a dosaggi anticoagulanti), pur rappresentando una corretta strategia di diminuzione del rischio ischemico, potrebbe non essere sufficiente a garantire una significativa riduzione dello stesso (4).
Bibliografia:
1. Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European heart journal. 2018;39(2):119-77.
2. Agewall S, Beltrame JF, Reynolds HR, Niessner A, Rosano G, Caforio AL, et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. European heart journal. 2017;38(3):143-53.
3. Cervera R, Rodríguez-Pintó I, Colafrancesco S, Conti F, Valesini G, Rosário C, et al. 14th International Congress on Antiphospholipid Antibodies Task Force Report on Catastrophic Antiphospholipid Syndrome. Autoimmunity reviews. 2014;13(7):699-707.
4. Baron TH, Kamath PS, McBane RD. Management of antithrombotic therapy in patients undergoing invasive procedures. The New England journal of medicine. 2013;368(22):2113-24.
Un raro caso di massa sessile dell’arteria polmonare: dalla clinica all’imaging
Gianmarco Angelini, Laura Piscitelli
Dipartimento dell’Emergenza e dei trapianti d’organo (D.E.T.O), Università Degli Studi di Bari, Bari, Italia
ABSTRACT
Le masse a livello dell’arteria polmonare sono entità rare, che nella maggior parte dei casi possono entrare in diagnosi differenziale sia dal punto di vista clinico che di imaging con quadri di embolia polmonare.
CASO CLINICO
Uomo di 47 anni, fumatore, senza ulteriori fattori di rischio cardiovascolari, con familiarità per malattia neoplastica polmonare, si presentava presso il pronto soccorso del nostro Policlinico per dispnea da sforzo. Nell’ultimo periodo non aveva avuto nessun altro sintomo ed aveva goduto di buona salute. I parametri emodinamici erano stabili con FC 70 bpm, PA 140/90 mmHg e SpO2 95% in aria ambiente. L’esame obiettivo cardiaco e polmonare risultava nella norma. L’ECG documentava una deviazione assiale destra ed onde T alte nelle derivazioni precordiali. L’emogas mostrava un quadro di alcalosi respiratoria con lieve ipossiemia ed ipocapnia. Nel sospetto di embolia polmonare, il paziente veniva sottoposto ad un angio TC polmonare che evidenziava un difetto di riempimento di circa 22 mm di diametro all’origine dell’arteria polmonare determinante stenosi di grado severo. Dopo l’inizio della terapia anticoagulante con Enoxaparina, l’ecocardiogramma transtoracico e transesofageo confermavano la presenza di una massa sessile fissa di 17×13 mm a livello del tratto di efflusso del ventricolo destro, appena prima della valvola polmonare, con gradiente massimo di 100 mmHg e gradiente medio di 68 mmHg. Il ventricolo destro risultava lievemente dilatato ed ipertrofico, con una lieve disfunzione ventricolare (Figure 1 e 2).
Per approfondire la natura della lesione, il paziente veniva sottoposto a risonanza magnetica cardiaca, che caratterizzava la massa come una vegetazione fibrosa di 13×53 mm localizzata accanto al lembo anteriore della valvola polmonare ed estesa fino alla biforcazione polmonare (Figura 3). Per l’elevato sospetto di natura neoplastica, il paziente veniva sottoposto a PET/TC con 18F-FDG che, inaspettatamente, documentava un intenso assorbimento di glucosio nel lobo superiore del polmonare sinistro, ma non della massa sessile. Il paziente veniva successivamente sottoposto ad un’angio TC polmonare di controllo , che mostrava persistenza della massa a livello dell’arteria polmonare, nonostante la terapia anticoagulante iniziata da circa due mesi.
L’angio TC polmonare, inoltre, documentava una neoformazione solida di circa 7 cm al lobo superiore del polmonare sinistro. Con tecnica eco-guidata, veniva eseguita una biopsia del parenchima polmonare interessato, il cui risultato evidenziava un sarcoma pleomorfo di alto grado. Dopo discussione collegiale con cardiochirurgo, oncologo e patologo, si decideva di soprassedere alla tipizzazione istologica della massa a livello dell’arteria polmonare per l’elevato rischio di complicanze intra e periprocedurali per il paziente, e si decideva di intraprendere terapia chemioterapica con Doxorubicina, Ifosfamide, Mesna in cicli di 3 settimane, fino ad un massimo di 6 cicli. Dopo circa 3 mesi, l’angio TC polmonare e la risonanza magnetica cardiaca non mostravano alcun cambiamento della massa a livello dell’arteria polmonare, ma documentavano un incremento delle dimensioni della massa polmonare (18 cm), e la comparsa di una nuova lesione a livello del lobo inferiore del polmonare destro. Pertanto, in considerazione della progressione di malattia, si decideva di passare ad un trattamento chemioterapico di seconda linea con Gemcitabina e Docetaxel in cicli di 3 settimane. Dopo 5 mesi, purtroppo, il paziente è deceduto al domicilio per insufficienza respiratoria acuta.
DISCUSSIONE
A causa della rarità delle masse a livello dell’arteria polmonare, la diagnosi iniziale di questo paziente è stata erroneamente quella di embolia polmonare, ritardando il processo diagnostico-terapeutico. La particolarità di questo caso clinico, infatti, risiede proprio nella sfida della diagnosi differenziale tra embolia polmonare e masse a livello dell’arteria polmonare. La multimodalità nelle indagini diagnostiche di imaging ha aiutato a caratterizzare la massa a livello dell’arteria polmonare. La persistenza della massa all’angioTC di controllo nonostante i due mesi di terapia anticoagulante, insieme alla mancata captazione del glucosio alla PET/TC con 18-FDG, in contrasto con il sarcoma riscontrato a livello polmonare, ci hanno permesso di diagnosticare la natura benigna della massa a livello dell’arteria polmonare, con una improbabile relazione tra questa e la massa polmonare. La sede, la forma e la struttura, ci fanno propendere per un fibroelastoma sessile, un tumore benigno cardiaco, che può essere pericoloso a causa del rischio di embolizzazione periferica. Alcune ipotesi plausibili includono anche una reazione fibroelastica alla neoplasia polmonare (sindrome paraneoplastica). Una diagnosi istologica della lesione avrebbe portato alla diagnosi definitiva ma sarebbe stata troppo pericolosa per il paziente.
CONCLUSIONI
I tumori dell’arteria polmonare per la loro bassa incidenza e per la loro presentazione clinica, possono essere facilmente scambiati per processi tromboembolici. In questi casi risulta essenziale il ruolo dell’imaging multimodale nella diagnosi e di un team multidisciplinare nella gestione clinica-terapeutica.
Bibliografia:
- Kahlbau H, Antunes HT, Rodrigues I, Carvalho R, Fragata J. Pulmonary artery sarcoma masquerading as subchronic pulmonary thromboembolism. J Card Surg 2016;31:529–530;
- Chen P-W, Liu P-Y. Pulmonary artery sarcoma mimicking pulmonary embolism. BMJ Case Rep 2018;2018:bcr2018226999;
- George JC, Tang A, Markowitz A, Gilkeson R, Hoit BD. Papillary fibroelastoma of the pulmonic valve: evaluation by echocardiography and magnetic resonance imaging. Echocardiography 2008;25:433–435.
Aortite e cardiopatia ipocinetica da possibile malattia IgG4 correlata
Domenico Filomena MD, Giulio Montefusco MD, Francesca Fanisio MD, Giorgio Scarcella MD, Luciano Agati MD, Francesco Fedele MD
Dipartimento di Scienze Cliniche Internistiche, Anestesiologiche e Cardiovascolari, “Sapienza” Università di Roma, A.O.U. Policlinico Umberto I, Roma
Abstract La malattia IgG4-correlata è un processo fibro-infiammatorio che può colpire diversi organi, dalle ghiandole salivari al pancreas, dai vasi linfatici a quelli sanguigni. Si presenta spesso con una sintomatologia atipica e per questo è di difficile inquadramento diagnostico. Riportiamo un caso di possibile malattia IgG4-correlata manifestatasi con aortite, multiple lesioni ulcerative aortiche e cardiopatia ipocinetica non ischemica. Il paziente è stato trattato con successo con metil-prednisolone con conseguente miglioramento del quadro clinico e strumentale.
Background La malattia IgG4-correlata è una patologia sistemica, immunomediata, a coinvolgimento multiorgano. Può mimare diverse patologie infettive e condizioni infiammatorie notevolmente differenti tra di loro. Il coinvolgimento aortico è talvolta complicato da dilatazione e/o aneurismi infiammatori. Il coinvolgimento cardiaco è una possibile e rara manifestazione della malattia da IgG4. Per l’eterogeneità delle sue manifestazioni, è necessario integrare dati clinici, laboratoristici, strumentali ed istopatologici per una diagnosi definitiva.
Case report Un uomo di 50 anni accedeva al pronto soccorso per intenso dolore interscapolare a riposo.
In anamnesi riferiva: ex abitudine tabagica, emicrania con aurea, episodio di encefalite in età pediatrica, pregressi episodi ricorrenti di Herpes oculare, interventi di timpanoplastica e ernioplastica inguinale. Non assumeva terapia domiciliare.
Il paziente si presentava con febbre (temperatura 37.8°C), la PA era 110/65 mmHg, FC 90 bpm, spO2 96% (FiO2 0.21). L’esame obiettivo cardiovascolare risultava nei limiti; i polsi periferici erano presenti, validi e isosfigmici. Gli esami ematochimici mostravano anemia ipocromica microcitica, trombocitosi, lieve aumento delle transaminasi e significativo incremento della proteina C reattiva (110 mg/L, con v.n. < 5 mg/L). La radiografia del torace e l’elettrocardiogramma erano nei limiti della norma. All’ecocardiogramma si documentava ectasia dell’aorta ascendente ed iperecogenicità delle sue pareti. Il ventricolo sinistro era di dimensioni, spessori parietali nei limiti della norma. La funzione sistolica globale era moderatamente ridotta (frazione di eiezione 40%) con globale ipocinesia. Il paziente, peraltro asintomatico, veniva sottoposto a trattamento con beta-bloccante ed ACE-inibitore.
Per la persistenza dell’intenso dolore interscapolare, per escludere una dissezione aortica il paziente è stato sottoposto a TC torace-addome con mezzo di contrasto. L’esame documentava un diffuso ispessimento parietale dell’aorta toraco-addominale (massimo 6 mm), esteso sino in sede sotto-renale e una formazione a margini lobulati nel ventaglio mesenteriale. Non rilevando flap intimali né falso lume veniva esclusa la presenza di dissezione aortica. Al contrario, per il diffuso ispessimento parietale aortico, veniva posto il sospetto di un processo flogistico a carico del vaso. Dopo una settimana per monitorare l’evoluzione del processo infiammatorio, veniva ripetuta TC con mdc di controllo che mostrava ulteriore incremento dell’ispessimento parietale aortico (massimo 12 mm) con enhancement periferico. Venivano inoltre riscontrate multiple immagini riferibili ad ulcere parietali penetranti. Tali reperti venivano confermati con angio-RMN. La formazione polilobulariforme in corrispondenza della radice del mesentere risultava di dimensioni massime 7 cm, iperintensa in T2, senza potenziamento post-contrastografico.
Una risonanza magnetica cardiaca confermava la presenza di una cardiopatia ipocinetica con moderata riduzione della funzione sistolica del ventricolo sinistro (FE 37%) senza edema, né potenziamento patologico dopo mezzo di contrasto. Tuttavia, i valori di T1 mapping risultavano significativamente aumentati come da fibrosi miocardica diffusa.
Una TC delle coronarie documentava l’assenza di placche di significato emodinamico a carico del circolo coronarico.
Per la definizione eziologica del processo flogistico aortico e della cardiopatia ipocinetica associata venivano eseguiti accertamenti infettivologici e immunologici. L’esito degli esami mostrava solo un significativo aumento della sottoclasse di immunoglobuline IgG4 pari a 253 mg/dl (v.n. < 86 mg/dl). Obiettivamente non erano state riscontrate lesioni ulcerative a carico del cavo orale né dei genitali esterni compatibili con la diagnosi di malattia di Behçet né dolore o dolorabilità nella regione dell’arteria temporale da riferire a arterite di Horton. Venivano inoltre eseguite tipizzazione HLA B51 e B27, risultate negative, ed ecografia delle arterie temporali che risultava nei limiti.
In considerazione dell’ispessimento e del potenziamento post-contrastografico delle pareti aortiche con multiple lesioni ulcerative suggestivi di aortite, della lesione polilobulariforme mesenteriale compatibile con lesione infiammatoria pseudotumorale, dei valori significativamente aumentati di IgG4 e dell’assenza di criteri diagnostici per altre vasculiti specifiche, veniva posta la diagnosi di possibile malattia IgG4-correlata. La conferma diagnostica mediante biopsia non è stata possibile per l’impossibilità tecnica di ottenere materiale bioptico degli organi coinvolti.
Veniva impostata terapia con metilprednisolone e nei giorni seguenti si assisteva a negativizzazione degli indici di flogosi e significativa riduzione dell’ispessimento parietale aortico alla TC di controllo.
Al follow-up il paziente era asintomatico. Gli indici di flogosi risultavano negativi. Una TC-PET non documentava la presenza di lesioni captanti il tracciante. Ha eseguito angio-RMN seriate che documentavano progressiva riduzione dell’ispessimento parietale aortico e riduzione delle dimensioni delle lesioni ulcerative. Gli ecocardiogrammi seriati hanno documentato una stabilità della funzione sistolica del ventricolo di sinistra. Il paziente è rimasto in terapia corticosteroidea a bassi dosaggi per il controllo della patologia vasculitica.
Discussione e conclusioni La malattia IgG4-correlata è una complessa patologia multiorgano, immunomediata, caratterizzata da infiltrazione linfoplasmacellulare e fibrosi tissutale. Le sue manifestazioni cliniche sono molteplici e dipendono dall’organo target del processo infiammatorio e fibrosante. La più frequente manifestazione cardiovascolare è l’aortite/peri-aortite ma è stato anche descritto il coinvolgimento delle coronarie, delle valvole e del pericardio. Il coinvolgimento diretto del miocardio con infiammazione e/o fibrosi è stato raramente descritto.
Nella pratica clinica il riscontro radiologico di ispessimento delle pareti aortiche con potenziamento post contrastografico deve far porre il sospetto diagnostico di aortite. La diagnosi differenziale è complessa e deve includere patologie infettive (aortite luetica, S. aureus, S.pneumoniae, Salmonella spp., Mycobacterium spp.), disturbi autoimmunitari (arterite di Takayasu, arterite giganto-cellulare, artrite reumatoide, malattia di Behçet, sindrome di Cogan, artriti sieronegative HLA B27 correlate, vasculiti ANCA-associate), sarcoidosi, neoplasie, aortite isolata, aneurismi aterosclerotici ed esiti di dissezione aortica.
Bibliografia
- Kamisawa T, Zen Y, Pillai S, Stone JH. IgG4-related disease. Lancet. 2015 Apr 11;385(9976):1460-71. doi: 10.1016/S0140-6736(14)60720-0. Epub 2014 Dec 4. PMID: 25481618.
- Nikiphorou E, Galloway J, Fragoulis GE. Overview of IgG4-related aortitis and periaortitis. A decade since their first description. Autoimmun Rev. 2020 Dec;19(12):102694. doi: 10.1016/j.autrev.2020.102694. Epub 2020 Oct 22. PMID: 33121641.
- Mavrogeni S, Markousis-Mavrogenis G, Kolovou G. IgG4-related cardiovascular disease. The emerging role of cardiovascular imaging. Eur J Radiol 2017;86: 169–75. https://doi.org/10.1016/j.ejrad.2016.11.012.
Figura 1 (Figura chiave) Tomografia computerizzata toraco-addominale con mezzo di contrasto che mostra ispessimento delle pareti aortiche (freccia) e ulcere parietali penetranti (testa di freccia).
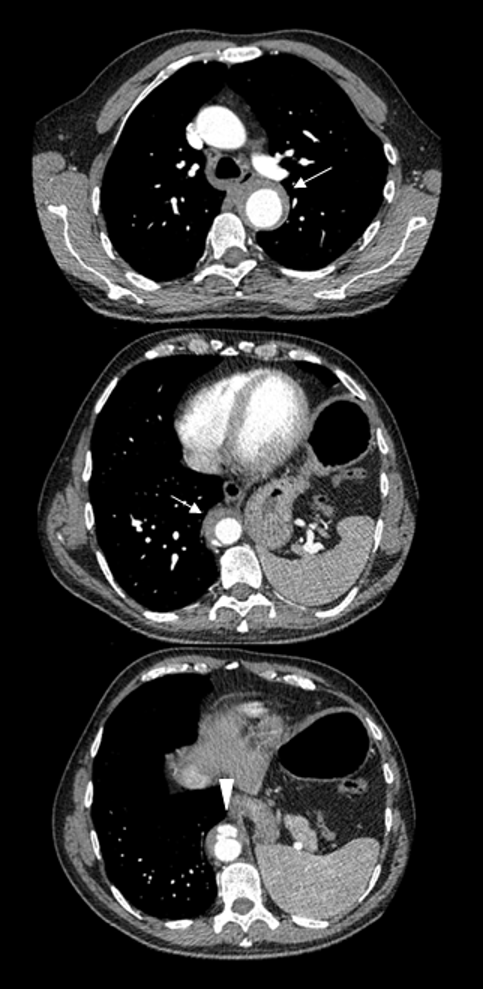
Figura 2 Ricostruzione tridimensionale mediante risonanza magnetica dell’aorta che documenta la presenza di multiple ulcere penetranti (freccia)
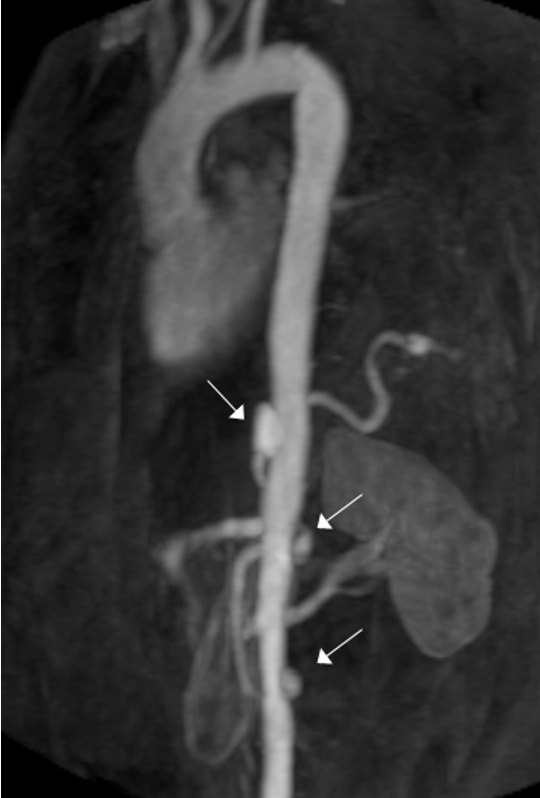
Figura 3 Risonanza magnetica cardiaca che documenta assenza di edema e di potenziamento post-contrastografico patologico (A1: asse corto T2 pesata, A2: asse corto T1 pesata post-contrasto, B1: asse lungo 2 camere T2 pesata, B2: asse lungo 2 camere T1 pesata post-contrasto).