Martina Settia, Luca Maritana, Caterina Butturinia, Annachiara Beninia, Mariantonietta Cicoiraa
a University of Verona, Section of Cardiology, Department of Medicine, Italy
ABSTRACT
La varietà di espressione fenotipica della cardiomiopatia ipertrofica (CMPI) richiede un’interpretazione integrata di sintomi clinici ed indagini strumentali. Il ruolo dell’interessamento del ventricolo destro nella CMPI dal punto di vista clinico, prognostico e terapeutico rimane ad oggi ancora da definire, data la casistica limitata, in assenza di linee guida specifiche. In questo caso clinico presentiamo una paziente con CMPI ostruttiva del ventricolo destro e l’iter diagnostico-terapeutico intrapreso.
Presentazione del paziente
Una donna di 57 anni con diagnosi di cardiomiopatia ipertrofica (CMPI) non ostruttiva accedeva al nostro ambulatorio di Scompenso Cardiaco Avanzato. La patologia le era stata diagnosticata da circa dieci anni, grazie ad uno screening cardiologico, intrapreso dopo la diagnosi di difetto del setto interventricolare del figlio in età pediatrica e il successivo sviluppo di CMPI. Inoltre, la prima figlia della donna era deceduta per ventricolo unico.
La paziente non aveva fattori di rischio cardiovascolari o altre patologie rilevanti. A livello sintomatologico lamentava astenia ingravescente, palpitazioni e occasionale dolore toracico sotto sforzo, in assenza di storia di sincopi. All’esame obiettivo, si notava un soffio sistolico di intensità 3/6 in focolaio mesocardico.
Work-up iniziale
Al tracciato elettrocardiografico (Figura 1) si documentava ritmo sinusale a 62 battiti per minuto, con ingrandimento bi-atriale ed onde Q nelle derivazioni inferiori e onde T negative in quelle antero-laterali.
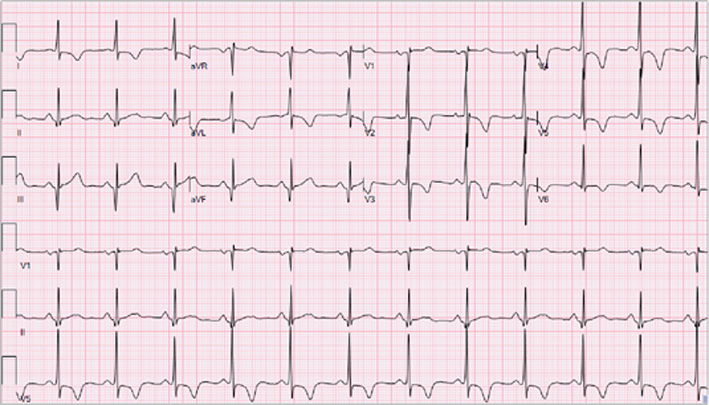
Ritmo sinusale, 62 battiti per minuto, allargamento dell’atrio sinistro e destro, onde Q patologiche in DII e DIII, onde T negative nelle derivazioni antero-laterali.
Veniva inoltre eseguito un ecocardiogramma transtoracico (Figura 2), che rivelava un’ipertrofia asimmetrica (spessore massimo 22 mm) del setto anteriore, della parete antero-laterale e dell’apice con funzione contrattile del ventricolo sinistro aumentata (frazione d’eiezione 78%). Il diametro antero-laterale dell’atrio sinistro risultava 33 mm. Al doppler, non si registrava alcun segno di ostruzione del tratto di efflusso del ventricolo sinistro, in condizioni basali, dopo manovra di Valsalva e squatting-standing. Al contrario, si evidenziava un’ostruzione del tratto di efflusso del ventricolo destro (gradiente di picco di 39 mmHg).
Veniva pertanto eseguito una valutazione ecocardiografica durante sforzo su letto-ergometro (ecostress), che confermava l’assenza di gradiente del tratto di efflusso del ventricolo sinistro e mostrava un significativo aumento del gradiente pressorio del tratto di efflusso destro (da 40 a 80 mmHg).
Al referto dell’Holter ECG delle 48 ore, eseguito il mese precedente, si notavano complessi ventricolari prematuri e un episodio di tachicardia ventricolare non sostenuta (4 battiti, a 135 battiti per minuto).
Veniva anche richiesta una risonanza magnetica cardiaca (RMC, Figura 3), che mostrava zone di late-gadolinium-enhancement (LGE) con pattern intramurale, nelle aree ipertrofiche di entrambi i ventricoli.
Era infine programmato un test cardiopolmonare, in cui si dimostrava una moderata riduzione della capacità funzionale, per limitazione cardiogenica (VO2 picco 13.8 ml/kg/min, corrispondente al 57% del predetto, AT 39% del predetto, RQ 1.06) e sovraccarico polmonare vascolare (VE/VCO2 slope 33.9), in assenza di aritmie indotte dall’esercizio.
Diagnosi e trattamento
Alla valutazione iniziale, la paziente era in terapia con beta-bloccante (nadololo, 40 mg al giorno), con persistenza dei sintomi. Veniva, pertanto, aggiunta disopiramide (125 mg due volte al giorno), con parziale beneficio. Non è stata titolata ulteriormente la disopiramide, anche visto il riscontro di QTc pari a 455 ms all’ECG di controllo, eseguito ad una settimana dall’inizio della terapia.
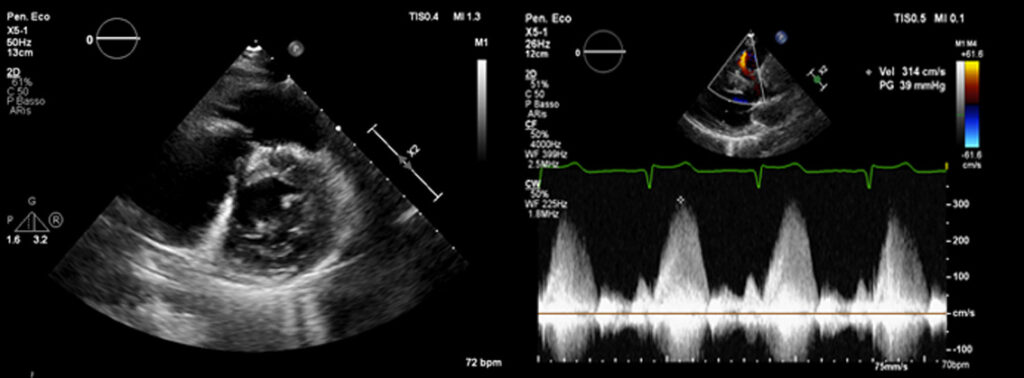
Sinistra) Parasternale asse corto, ipertrofia del tratto di efflusso del ventricolo destro
Destra) Parasternale asse corto, gradiente pressorio del tratto di efflusso del ventricolo destro (gradiente di picco 39 mmHg).
Al controllo successivo, dopo un mese, la paziente riferiva miglioramento dell’astenia e degli episodi di dolore toracico, nonostante il persistere di gradiente del ventricolo destro.
Il figlio della nostra paziente non era ancora stato sottoposto a test genetico nel centro di riferimento, pertanto è stata richiesta l’analisi genetica delle mutazioni comunemente associate a CMPI per la donna, risultata però negativa.
In assenza di specifiche indicazioni per questo raro fenotipo di CMPI nelle linee guida della Società Europea di Cardiologia, che precludeva la mera applicazione dello score di rischio ESC per morte cardiaca improvvisa, abbiamo scelto un approccio ad hoc. Tenuti in considerazione l’età della paziente, lo spessore massimo miocardico, la presenza di ostruzione del tratto di efflusso del destro e la tachicardia ventricolare non sostenuta ventricolare e l’evidenza di LGE nelle aree ipertrofiche, abbiamo considerato la paziente a elevato rischio di morte improvvisa. Dopo esserci consultati con i colleghi elettrofisiologi e aver condiviso la scelta con la paziente, si è deciso di impiantare un defibrillatore sottocutaneo.
Discussione
Il coinvolgimento del ventricolo destro nella CMPI dovrebbe essere sempre ricercato, valutandone sia la struttura sia la funzione.
L’ecocardiogramma rappresenta l’esame di prima linea per porre il sospetto e poi la diagnosi di CMPI (1), ma non sono ancora stati stabiliti criteri universali per definire il coinvolgimento e l’ostruzione del ventricolo destro (2). Gli indici ecocardiografici tradizionali spesso non risultano efficaci nel dimostrare precocemente una disfunzione del ventricolo destro ipertrofico di questi pazienti. La RMC rappresenta la metodica non invasiva con maggiore potenzialità per lo studio di morfologia, funzione e substrato miocardico dei ventricoli, in particolare quello destro. Ci sono, inoltre, alcune evidenze che la RMC possa aggiungere informazioni sulla quantificazione della fibrosi miocardica e sulla sua distribuzione in entrambi i ventricoli, con possibili risvolti sulla stratificazione prognostica (3,4).
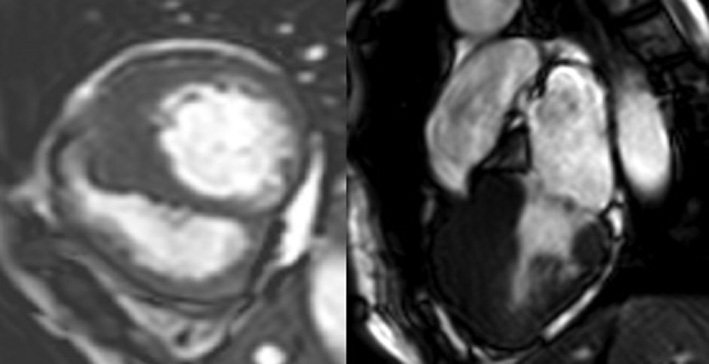
Sinistra) proiezione del tratto di efflusso del ventricolo destro
Destra) asse corto, ipertrofia asimmetrica
In generale, l’ipertrofia del ventricolo destro della CMPI è associata con peggioramento della presentazione clinica e della prognosi in pazienti in classe funzionale NYHA III o IV, aumentato rischio di aritmie ventricolari e sopraventricolari, dispnea severa (4) e tromboembolismo polmonare (5). Inoltre, risulta esserci correlazione tra lo spessore della parete del ventricolo destro e un aumentato rischio di aritmie ventricolari maligne e morte cardiaca improvvisa (5).
Non è ancora stato identificato alcun trattamento standardizzato della CMPI con coinvolgimento del ventricolo destro (3). Come nella CMPI ostruttiva del tratto di efflusso del ventricolo sinistro, la terapia si basa sull’utilizzo di farmaci beta-bloccanti e, in assenza di miglioramento dello stato clinico, si dovrebbe aggiungere la disopiramide (4). La persistenza dell’ostruzione del ventricolo destro in pazienti sintomatici può richiedere la miectomia chirurgica, per ridurre il gradiente e migliorare la sintomatologia (4, 6,7).
Per stratificare il rischio aritmico delle CMPI e decidere se è necessario impiantare il defibrillatore in profilassi primaria, è stato sviluppato uno score, che include parametri inerenti soltanto al ventricolo sinistro. Dato il numero limitato di studi nei pazienti con ipertrofia del ventricolo destro ed ostruzione, è difficile quantificare in modo preciso il rischio di morte improvvisa ad essa connessa. Il nostro caso sottolinea come siano pertanto necessari altri studi per valutare pazienti con CMPI e coinvolgimento del ventricolo destro, così come il loro eventuale rischio di morte improvvisa.
Bibliografia
1. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, Hagege A, Lafont A, Limongelli G, Mahrholdt H, McKenna WJ, Mogensen, Nihoyannopoulos P, Nistri S, Pieper PG, Pieske B, Rapezzi C, Rutten FH, Tillmanns C, Watkins H. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 35 (2014), pp. 2733-2779, doi:10.1093/euheartj/ehu284.
2. Maron MS, Hauser TH, Dubrow E et al.,Right ventricular involvement in hypertrophic cardiomyopathy, Am J Cardiol, 100 (2007), pp. 1293-1298.
3. Keramida K et al ., Right ventricular involvement in hypertrophic cardiomyopathy: Patterns and implications, Hellenic Journal of Cardiology, https://doi.org/10.1016/j.hjc.2018.11.009.
4. McKenna WJ, Kleinebenne A, Nihoyannopoulos P, Foale R, Echocardiographic measurement of right ventricular wall thickness in hypertrophic cardiomyopathy: relation to clinical and prognostic features, J Am Coll Cardiol, 11 (1988), pp. 351-358.
5. Roşca M, Călin A, Beladan CC et al., Right ventricular remodeling, its correlates, and its clinical impact in hypertrophic cardiomyopathy. J Am Soc Echocardiogr, 28 (11) (2015 Nov), pp. 1329- 1338.
6. Maron BJ, McIntosh CL, Klues HG, Cannon III RO, Roberts WC, Morphologic basis for obstruction to right ventricular outflow in hypertrophic cardiomyopathy, Am J Cardiol, 71 (1993), pp. 1089- 1094.
7. Butz T, Horstkotte D, Langer C et al., Significant obstruction of the right and left ventricular outflow tract in a patient with biventricular hypertrophic cardiomyopathy, Eur J Echocardiogr, 9 (2008), pp. 344-345.
