Sinigiani G [1], Giordani AS [1], Cecchetto A [1], Sarais C [1], Napodano M [1], Rizzo S [2], Berno T [3], Brunello G [1].
[1] Dipartimento di Scienze Cardiache, Toraciche, Vascolari e Sanità Pubblica, Università degli Studi di Padova. [2] Patologia cardiovascolare, Dipartimento di Scienze Cardiache, Toraciche, Vascolari e Sanità Pubblica, Università degli Studi di Padova. [3] Dipartimento di medicina, unità di ematologia e immunologia clinica, Università degli Studi di Padova.
Abstract
Un uomo di 53 anni, senza precedenti cardiologici, veniva ricoverato per scompenso cardiaco. All’ecocardiogramma e a RM cuore venivano documentati ventricolo sinistro ipertrofico, di normali dimensioni e funzione, versamento pericardico non tamponante. L’elettroforesi sieroproteica, la biopsia del grasso periombelicale e la scintigrafia ossea risultavano negative. Ricompensato, il paziente veniva dimesso. Tuttavia, il quadro clinico recidivava quattro mesi dopo, per cui veniva ricoverato nuovamente e trasferito presso il nostro reparto. Qui gli esami laboratoristici e strumentali permettevano la diagnosi di amiloidosi cardiaca in mieloma multiplo e veniva impostata terapia con Bortezomib e Desametasone. Il paziente tuttavia decedeva due mesi dopo.
Caso Clinico
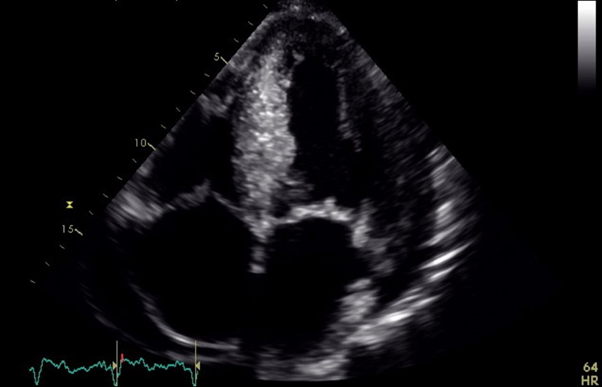
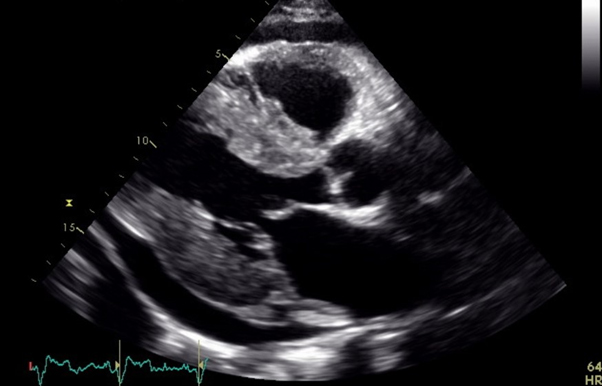
Un uomo di 53 anni, senza precedenti cardiologici, veniva ricoverato presso un reparto di cardiologia per edemi declivi e dispnea da sforzo. All’ecocardiogramma veniva documentato versamento pericardico non tamponante, ventricolo sinistro ipertrofico, di normali dimensioni e funzione di pompa con aumentata pressione telediastolica; una TAC del torace e dell’addome inoltre documentava versamento pleurico bilaterale. Venivano eseguite elettroforesi sieroproteica e dosaggio degli autoanticorpi, risultati negativi, ed impostata terapia diuretica ed antinfiammatoria. Il paziente veniva dimesso, dopo aver ottenuto un soddisfacente compenso emodinamico. Una successiva risonanza magnetica cardiaca documentava unicamente ipertrofia concentrica del ventricolo sinistro. Nel sospetto di amiloidosi si eseguivano una biopsia del grasso periombelicale ed una scintigrafia ossea, risultate negative. Quattro mesi dopo, per recidiva della sintomatologia, veniva nuovamente ricoverato, con reperti strumentali sovrapponibili ai precedenti; il dosaggio dell’alfa galattosidasi ematica escludeva malattia di Fabry. Il paziente veniva trasferito presso il nostro reparto. Si ripeteva ecocardiogramma, che documentava moderata riduzione della frazione di eiezione ventricolare sinistra, lieve versamento pericardico, ispessimento delle valvole atrioventricolari, aspetto a “granular sparkling” del miocardio ventricolare ed aspetto “apicalsparing” all’analisi del global longitudinal strain. Una risonanza magnetica cardiaca documentava inoltre difficile reperimento del tempo di inversione nelle sequenze T1 scout e LGE a “zebra pattern”. L’elettroforesi sieroproteica e la proteinuria di Bence Jones risultavano nella norma; veniva però documentato un aumento considerevole delle catene leggere libere lambda, mai dosate in precedenza.
I valori di NT-proBNP e troponina risultavano essere rispettivamente di 10.800 ng/L e 180 ng/L. Alla luce di ciò e della scintigrafia ossea negativa effettuata nel ricovero precedente, nel sospetto di amiloidosi AL veniva ricercata una neoplasia ematologica, ed eseguita quindi biopsia osteomidollare che documentava mieloma multiplo. Il paziente veniva sottopostoper diagnosi di certezza di amiloidosi cardiaca AL a biopsia endomiocardica, che confermava la diagnosi. Pertanto, successivamente all’ottenimento di buon compenso emodinamico con terapia diuretica, si iniziava terapia con Bortezomib e Desametasone. La prognosi del paziente si prospettava tuttavia infausta (Stadio IV del Revised Staging System, mediana di sopravvivenza 6 mesi); a due mesi dalla dimissione dal nostro reparto, il paziente andava incontro ad arresto cardiaco e decesso.
Discussione
L’amiloidosi cardiaca è una patologia da accumulo, caratterizzata dal deposito di fibrille amiloide nel miocardio, che si originano a partire da un precursore proteico, a seconda del quale si distinguono diverse forme di amiloidosi, tra cui l’amiloidosi AL, ATTRwt e ATTRm. La prima ha come precursore una catena leggera di immunoglobulina; l’ATTRwt e ATTRm condividono il precursore, la transtiretina, ma nella prima è nativa, mentre nella seconda è mutata. Clinicamente sono caratterizzate, nelle prime fasi di malattia, da un quadro di scompenso cardiaco a frazione di eiezione preservata, e solo successivamente, si osserva uno scadimento della frazione di eiezione. Fondamentali per il sospetto di malattia sono le metodiche di imaging, ecocardiografia e risonanza magnetica cardiaca senza e con mezzo di contrasto. All’ecocardiogramma si osserva tipicamente ventricolo sinistro ipertrofico, con conservata funzione di pompa e disfunzione diastolica (finanche alla fisiologia restrittiva), dilatazione atriale sinistra, ispessimento del setto interatriale e delle valvole atrioventricolari, aspetto “granular sparkling” del miocardio e aspetto ad “apical sparing” dell’analisi del global longitudinal strain. Alla RM cuore caratteristiche sono la difficoltà a reperire il tempo di inversione nelle sequenze T1 scout, un valore di T1 nativo elevato al mapping T1, il pattern di LGE subendocardico diffuso o a “zebra pattern”. Se a seguito il sospetto è elevato, è indicata l’esecuzione di elettroforesi sieroproteica con immunofissazione su siero ed urine, ricerca della proteinuria di Bence Jones e dosaggio delle catene leggere libere sieriche e di scintigrafia ossea, la quale documenta intensa captazione del tracciante in caso di amiloidosi cardiaca da TTR. Sulla base degli esiti di questi esami, è possibile porre diagnosi di amiloidosi TTR, con successiva analisi genetica. Per la diagnosi di amiloidosi AL generalmente è indicata la biopsia cardiaca o extracardiaca. Una volta confermata la diagnosi di amiloidosi AL, è possibile in questo contesto stimare la prognosi mediante il Revised Staging System, che utilizza i valori di TnT, NT-proBNP e catene leggere libere. Per quanto riguarda la terapia, è essenziale giungere ad una diagnosi della discrasia ematologica alla base per poter intraprendere la terapia più appropriata, che, anche in riferimento al rischio clinico del paziente (stimato anche sul sistema di prognosi), può comprendere il trapianto e l’autotrapianto di midollo, farmaci inibitori del proteasoma, o chemioterapia classica.
Il caso in esame evidenza come l’amiloidosi cardiaca sia una patologia spesso misconosciuta, rapidamente ingravescente con prognosi infausta. Fondamentali sono il sospetto di malattia, metodo sistematico di ricerca ed esperienza.