Shock cardiogeno come prima manifestazione di cardiotossicità indotta da antracicline
Cristina Conte1, Alessia d’Aiello2, Francesco Cribari1, Marco del Buono2, Gianluigi Saponara2, Cristina Aurigemma2, Daniela Pedicino2, Tommaso Sanna2
1 Università Cattolica del Sacro Cuore, Roma, Italia
2 Dipartimento di Scienze Cardiovascolari e Toraciche, Fondazione Policlinico Universitario A. Gemelli IRCCS, Roma, Italia
ABSTRACT: Numerosi farmaci citotossici sono disponibili per i pazienti affetti da patologie oncologiche: se da una parte i recenti progressi terapeutici sono associati ad una maggiore aspettativa di vita, ciascun farmaco può provocare una vasta gamma di effetti collaterali, che aumentano la morbilità e la mortalità di questi pazienti. Le patologie cardiovascolari sono tra più le frequenti e drammatiche manifestazioni avverse dei farmaci chemioterapici: quando manifeste, esse prevedono l’interruzione di terapie potenzialmente salvavita o esitano nell’insufficienza cardiaca.
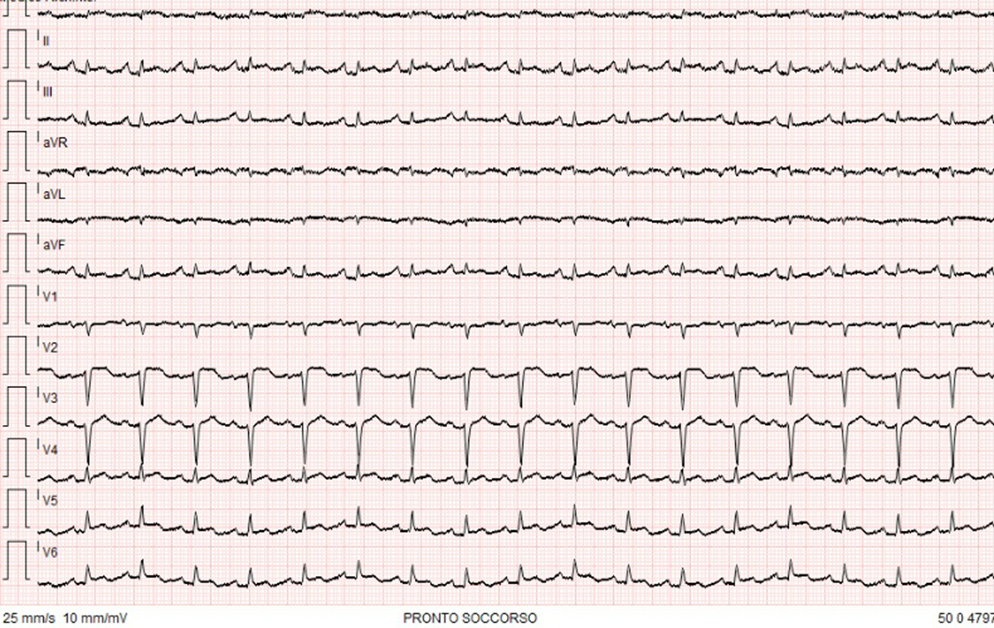
CASO CLINICO: Una donna di 50 anni con recente diagnosi di carcinoma mammario si è presentata presso il Pronto Soccorso (PS) del nostro Nosocomio per astenia, vomito e dispnea; tre giorni prima, le era stata somministrata la prima dose di chemioterapia neoadiuvante (epirubicina + ciclofosfamide). L’ecocardiogramma risultava nei limiti della norma. All’ammissione in PS la paziente si presentava ipotesa, tachicardica, con confusione mentale e sudorazione algida. L’ ECG 12 D mostrava tachicardia sinusale con diffuso sopra-slivellamento del tratto ST e diffusi bassi voltaggi del QRS (Figura 1);
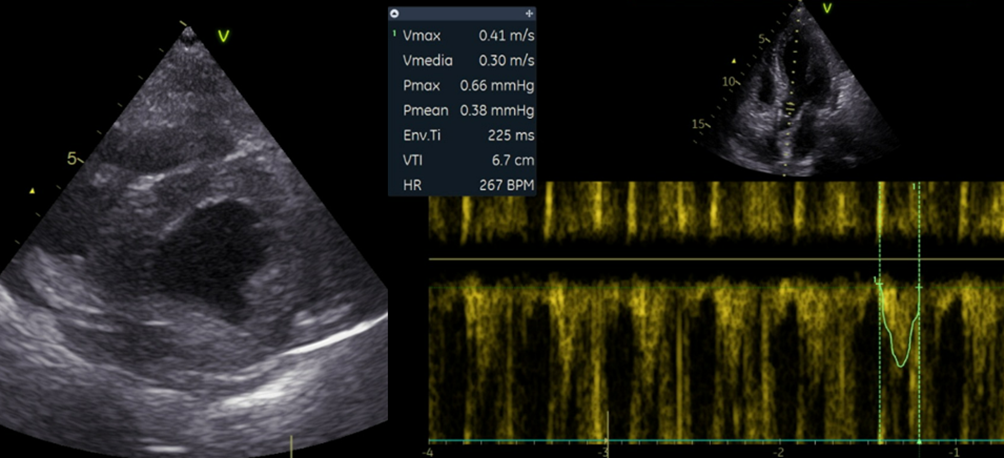
l’ecocardiogramma bed-side mostrava una severa disfunzione del ventricolo sinistro (FE Biplano 15%) con segni di bassa gittata sistolica (LVOT VTI 6 mm), significativa ipertrofia parietale ventricolare sinistra, pressioni telediastoliche ventricolari sinistre aumentate (E/e’ 26) (Figura 2).
L’emogas analisi arterioso mostrava severa iperlattacidemia (Lac 12 mmol/L). Veniva posta la diagnosi di shock cardiogeno ed è stata iniziata terapia di supporto con alte dosi di dobutamina e noradrenalina ev. Gli esami di laboratorio, in quadro di ipoperfusione sistemica, hanno confermato il coinvolgimento multiorgano, in assenza di rialzo degli indici di infiammazione e/o infezione. Lo studio coronarografico ha escluso malattia aterosclerotica coronarica e la ventricolografia ha confermato la presenza di elevate pressioni telediastoliche ventricolari sinistre (LVEDP 29 mmHg). Le condizioni emodinamiche della paziente sono peggiorate nonostante la terapia vasopressoria massimale, per cui si è iniziato supporto meccanico con IMPELLA CP. È stata avviata anche la soministrazione di alte dosi di corticosteroidi (metilprednisolone 10 mg/kg per tre giorni, con successivo scalaggio). Dopo 24 h, si è ottenuta la stabilità emodinamica e la completa clearance dei lattati. La successiva comparsa di mielotossicità con marcata piastrinopenia (conta piastrinica minima 16 000*10 9/L) ha complicato ulteriormente il decorso clinico e nessuna terapia anticoagulante, se non quella contenuta nella soluzione purge dell’IMPELLA, è stata somministrata. La risonanza magnetica cardiaca ha confermato la presenza di edema citotossico e fibrosi microscopica diffusi, con potenziamento di segnale nelle sequenze T2 pesate ed aumento del T2 Mapping, T1 Mapping e del volume extracellulare. Le condizioni emodinamiche della paziente sono progressivamente migliorate, consentendo la rimozione del supporto meccanico. La paziente è stata sottoposta ad ecocardiogrammi transtoracici seriati, che hanno documentato il progressivo miglioramento della frazione d’eiezione del ventricolo sinistro (FE Biplano 38%) e la riduzione dei valori delle pressioni telediastoliche (E/e’ 9). Il supporto farmacologico inotropo è stato progressivamente ridotto sino alla completa sospensione e gradualmente è stata introdotta la terapia medica orale anti-scompenso.
DISCUSSIONE: Il caso clinico descrive un episodio di disfunzione cardiaca acuta molto grave indotta da terapia citotossica in una donna giovane con probabilità clinica pre-trattamento di tossicità cardiovascolare molto bassa. [1] Le antracicline (doxorubicina, daunorubicina, epirubicina, idarubicina) rappresentano i principali farmaci antineoplastici associati a cardiotossicità.
La cardiotossicità acuta è un evento raro che si sviluppa in < 1% dei pazienti, prevalentemente subito dopo l’infusione del farmaco [2]: quando si manifesta, è il risultato di una forma di ipersensibilità scatenata da un fenomeno allergico, immunologico o idiosincratico; si caratterizza per una risposta infiammatoria dose-indipendente; richiede la sospensione immediata del farmaco imputato e le strategie terapeutiche sono limitate alle terapie di supporto standard [3].
Si definisce tossicità acuta l’insorgenza, nei 14 giorni a seguire l’infusione del farmaco, di disfunzione ventricolare sinistra associata ad insufficienza cardiaca acuta e/o cardiopatia dilatativa, aritmie transitorie (tachicardia sopraventricolare, anomalie aspecifiche del tratto ST e dell’onda T, sindrome mio-pericarditica) e/o morte cardiaca improvvisa [4]. La letteratura in merito è piuttosto limitata e ciò che conosciamo deriva principalmente da case reports [5].
Il principale meccanismo molecolare imputato è il danno diretto dei miomiocardiociti cardiociti insieme ad un’aumentata produzione di radicali dell’ossigeno [6]. Sono state, quindi, descritte te numerose i varianti genetiche che sembrano essere associate ad un’aumentata suscettibilità per lo sviluppo della cardiotossicità da farmaci chemioterapici: esse includono geni che codificano per proteine implicate nel trasporto e nel metabolismo delle antracicline, geni implicati nella sintesi dei radicali dell’ossigeno e geni implicati nella genesi di altre cardiomiopatie [7]. Sebbene la maggior parte di essi sia correlato ad un’aumentata suscettibilità per lo sviluppo di cardiotossicità cronica, ci si sta chiedendo se essi possano rivestire un ruolo anche nella cardiotossicità acuta [7].
La previsione della cardiotossicità da antraciclina rimane, quindi, una sfida: in tal senso, i dati emergenti soprattutto nella popolazione oncologica pediatrica insieme ad una maggiore conoscenza dei dati genetici, potrà aiutare a creare un modello di previsione integrato per una migliore stratificazione dei pazienti e per la scelta del farmaco più adeguato, contenendo gli effetti avversi dei farmaci chemioterapici e massimizzando i benefici delle terapie oncologiche [8].
CONCLUSIONI: La cardiotossicità acuta è una condizione clinica rara ma possibile in ogni classe di rischio clinico basale; essa è, inoltre, associata a gravi conseguenze emodinamiche, potenzialmente fatali. La previsione della cardiotossicità da antraciclina rimane un’incognita: è necessaria la stratificazione dei pazienti attraverso classi di rischio integrative di dati clinici, molecolari e genetici.
BIBLIOGRAFIA
[1] Lyon AR; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022.
[2] Zamorano JL; ESC Scientific Document Group. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J. 2016.
[3] Raschi E; ESC position paper on cardiovascular toxicity of cancer treatments: challenges and expectations. Intern Emerg Med. 2018.
[4] Khouri MG; Cancer therapy-induced cardiac toxicity in early breast cancer: addressing the unresolved issues. Circulation. 2012.
[5] Bristow MR; Early anthracycline cardiotoxicity. Am J Med. 1978.
[6] Cuomo A; Heart Failure and Cancer: Mechanisms of Old and New Cardiotoxic Drugs in Cancer Patients. Card Fail Rev. 2019.
[7] Berkman AM; The genetic underpinnings of anthracycline-induced cardiomyopathy predisposition. Clin Genet. 2021.
[8] Chaix MA; Machine Learning Identifies Clinical and Genetic Factors Associated With Anthracycline Cardiotoxicity in Pediatric Cancer Survivors. JACC Cardiooncol. 2020.





Related Posts