Antonella Rispoli (1), Angelo Giano (1), Vittoria Miano (1), Michele Tedeschi (1), Marco Torre (1), Antonia Alfano (2), Michele Manzo (2), Gennaro Galasso (1)
1. Dipartimento di Medicina e Chirurgia, Università degli studi di Salerno, Italia
2. A.O.U. “San Giovanni di Dio e Ruggi D’Aragona”, Salerno, Italia
Introduzione
Lo scompenso cardiaco a frazione di eiezione preservata (HFpEF) è una sindrome clinica complessa caratterizzata da una frazione di eiezione del ventricolo sinistro superiore al 50% e da segni e sintomi dovuti alla disfunzione diastolica (1,2).
Lo scompenso cardiaco è spesso associato a tachiaritmie sopraventricolari come la fibrillazione atriale (FA) e il flutter atriale (AFL). Infatti, HFpEF e tachiaritmie sopraventricolari hanno fattori eziopatologici e scatenanti comuni, soprattutto quando sono presenti altre comorbidità come diabete mellito e condizioni proinfiammatorie (3,4,5).
Caso clinico
Giunge alla nostra osservazione paziente maschio, 67 anni, in seguito ad un episodio di arresto cardiocircolatorio trattato mediante rianimazione cardiopolmonare con ripristino del ROSC.
In anamnesi diagnosi di miocardio non compatto a coronarie epicardiche esenti da lesioni angiograficamente significative, flutter atriale tipico comune, ipertensione arteriosa, dislipidemia, insufficienza renale cronica, anemia sideropenica, pregressa nefrectomia per carcinoma renale e pregressa gastrectomia per ulcera perforante.
Dopo aver escluso cause reversibili determinanti l’evento aritmico, il paziente viene sottoposto ad impianto di defibrillatore bicamerale in prevenzione secondaria.
Il defibrillatore scelto è dotato di un sistema di monitoraggio da remoto che sulla base di un algoritmo multiparametrico consente di identificare precocemente segni di peggioramento di scompenso cardiaco (6,7).
Durante i mesi successivi il paziente viene sottoposto a monitoraggio da remoto mediante il dispositivo impiantato e controlli ambulatoriali frequenti. Tuttavia, si assiste all’insorgenza di numerosi episodi di incremento della soglia del sistema di monitoraggio da remoto del defibrillatore che vengono prontamente trattati mediante valutazione ambulatoriale ed ottimizzazione della terapia medica (Figura 1A).
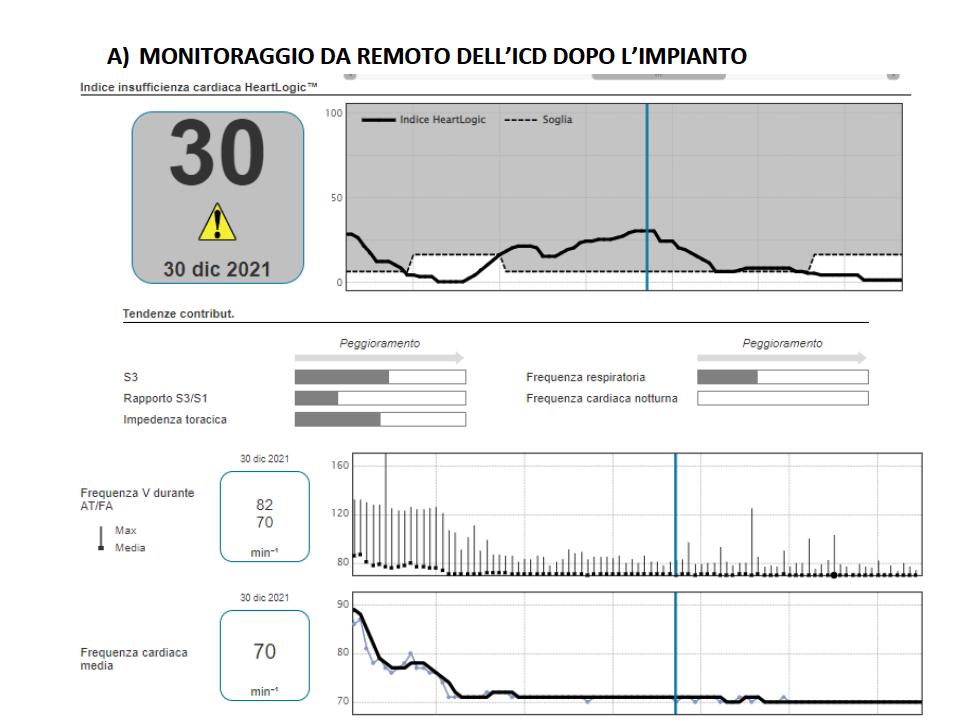
Il sistema di monitoraggio remoto rileva inoltre il persistere di un ritmo da flutter atriale a frequenza cardiaca adeguatamente controllata. In considerazione dei frequenti episodi di incremento della soglia e contestuale peggioramento della dispnea del paziente nonché degli indici di funzione diastolica si decide di sottoporre il paziente ad ablazione del flutter atriale tipico comune.
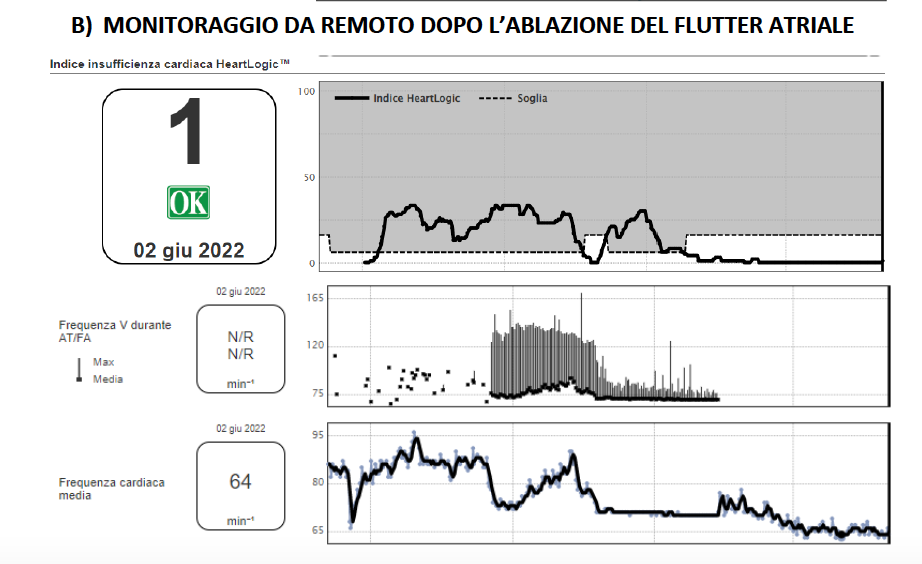
Il paziente pertanto esegue ablazione transcatetere con radiofrequenze dell’istmo cavo-tricuspidalico. Dopo l’ablazione, fino ad oggi, il paziente non ha più avuto episodi di peggioramento della dispnea, non si sono più verificati incrementi dei valori del monitoraggio remoto e non sono stati necessari aggiustamenti della terapia medica (Figura 1 B).
Discussione
HFpEF e AFL sono condizioni cliniche patofisiologicamente correlate. Il rimodellamento sfavorevole dell’atrio sinistro e l’incremento delle pressioni di riempimento nelle sezioni sinistre del cuore nonché la disfunzione diastolica favoriscono l’insorgenza di segni e sintomi di scompenso cardiaco (8,9).
I pazienti affetti da scompenso cardiaco a frazione d’eiezione preservata hanno frequentemente un riarrangiamento patologico dell’atrio sinistro riconducibile alle incrementate pressioni di riempimento. Un atrio di volume aumentato costituisce un substrato aritmogeno che può pertanto favorire l’insorgenza di fibrillazione atriale o di altre tachiaritmie. Allo stesso tempo, la fibrillazione atriale di per sé determina un rimaneggiamento negativo dell’atrio sinistro che si associa a modifiche emodinamiche e pressorie dovute alle conseguenti alterazioni della sistole atriale e del riempimento ventricolare (10).
Nel nostro caso, la modifica della terapia medica ha ridotto le ospedalizzazioni per scompenso cardiaco, consentendo una gestione ambulatoriale del paziente; tuttavia, non è stata sufficiente a ridurre il riesacerbarsi dei sintomi e dei segni di scompenso cardiaco.
C’è stato un sostanziale miglioramento della stabilità clinica del paziente solo arrivando a un approccio multidisciplinare che tenesse conto della terapia medica ottimizzata ma anche del ricorso a trattamenti invasivi come l’ablazione transcatetere del flutter atriale con radiofrequenza. Il guadagno del ritmo sinusale ha permesso di stabilizzare lo stato clinico del paziente riducendo gli indici di disfunzione diastolica e migliorando conseguentemente l’equilibrio volemico del paziente (11).
Conclusioni
Il sistema di monitoraggio da remoto è utile per identificare precocemente le riacutizzazioni di scompenso cardiaco (12).
In associazione alla terapia medica ottimizzata vanno considerati trattamenti invasivi per la gestione dello scompenso cardiaco (13).
Bibliografia
1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022 Jan;24(1):4-131. doi: 10.1002/ejhf.2333. PMID: 35083827.
2. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, Deswal A, Drazner MH, Dunlay SM, Evers LR, Fang JC, Fedson SE, Fonarow GC, Hayek SS, Hernandez AF, Khazanie P, Kittleson MM, Lee CS, Link MS, Milano CA, Nnacheta LC, Sandhu AT, Stevenson LW, Vardeny O, Vest AR, Yancy CW. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Apr 1:101161CIR0000000000001063. doi: 10.1161/CIR.0000000000001063. PMID: 35363499.
3. Lee JZ, Cha YM. Atrial fibrillation and heart failure: A contemporary review of current management approaches. Heart Rhythm O2. 2021;2(6Part B):762-770. Published 2021 Dec 17. doi:10.1016/j.hroo.2021.11.006
4. Packer M, Lam CSP, Lund LH, Redfield MM. Interdependence of Atrial Fibrillation and Heart Failure With a Preserved Ejection Fraction Reflects a Common Underlying Atrial and Ventricular Myopathy. Circulation. 2020 Jan 7;141(1):4-6. doi: 10.1161/CIRCULATIONAHA.119.042996. Epub 2019 Dec 30. PMID: 31887078.
5. Shah SJ, Borlaug BA, Kitzman DW, McCulloch AD, Blaxall BC, Agarwal R, Chirinos JA, Collins S, Deo RC, Gladwin MT, Granzier H, Hummel SL, Kass DA, Redfield MM, Sam F, Wang TJ, Desvigne-Nickens P, Adhikari BB. Research Priorities for Heart Failure With Preserved Ejection Fraction: National Heart, Lung, and Blood Institute Working Group Summary. Circulation. 2020 Mar 24;141(12):1001-1026. doi: 10.1161/CIRCULATIONAHA.119.041886. Epub 2020 Mar 23. PMID: 32202936; PMCID: PMC7101072.
6. Bertini M, Vitali F, Santini L, Tavoletta V, Giano A, Savarese G, Russo AD, Santobuono VE, Mattera A, Lavalle C, Amellone C, Pecora D, Calvanese R, Rapacciuolo A, Campari M, Valsecchi S, Calò L. Implantable defibrillator-detected heart failure status predicts atrial fibrillation occurrence. Heart Rhythm. 2022 Jan 20:S1547-5271(22)00035-2. doi: 10.1016/j.hrthm.2022.01.020. Epub ahead of print. PMID: 35066184.
7. Calò L, Bianchi V, Ferraioli D, Santini L, Dello Russo A, Carriere C, Santobuono VE, Andreoli C, La Greca C, Arena G, Talarico A, Pisanò E, Santoro A, Giammaria M, Ziacchi M, Viscusi M, De Ruvo E, Campari M, Valsecchi S, D’Onofrio A; Full list of participant centers and investigators. Multiparametric Implantable Cardioverter-Defibrillator Algorithm for Heart Failure Risk Stratification and Management: An Analysis in Clinical Practice. Circ Heart Fail. 2021 Oct;14(10):e008134. doi: 10.1161/CIRCHEARTFAILURE.120.008134. Epub 2021 Jun 30. PMID: 34190592; PMCID: PMC8522625.
8. Reddy YNV, Obokata M, Verbrugge FH, Lin G, Borlaug BA. Atrial Dysfunction in Patients With Heart Failure With Preserved Ejection Fraction and Atrial Fibrillation. J Am Coll Cardiol. 2020 Sep 1;76(9):1051-1064. doi: 10.1016/j.jacc.2020.07.009. PMID: 32854840; PMCID: PMC7455760.
9. Pfeffer MA, Shah AM, Borlaug BA. Heart Failure With Preserved Ejection Fraction In Perspective. Circ Res. 2019 May 24;124(11):1598-1617. doi: 10.1161/CIRCRESAHA.119.313572. PMID: 31120821; PMCID: PMC6534165.
10. Kotecha D, Lam CS, Van Veldhuisen DJ, Van Gelder IC, Voors AA, Rienstra M. Heart Failure With Preserved Ejection Fraction and Atrial Fibrillation: Vicious Twins. J Am Coll Cardiol. 2016 Nov 15;68(20):2217-2228. doi: 10.1016/j.jacc.2016.08.048. PMID: 27855811.
11. Jani C, Arora S, Zuzek Z, Jaswaney R, Thakkar S, Patel HP, Lahewala S, Arora N, Josephson R, Deshmukh A, Viles-Gonzalez J, Osman MN, Sahadevan J, Hoit BD, Mackall JA. Impact of catheter ablation in patients with atrial flutter and concurrent heart failure. Heart Rhythm O2. 2020 Nov 22;2(1):53-63. doi: 10.1016/j.hroo.2020.11.005. Erratum in: Heart Rhythm O2. 2021 Jun 18;2(3):309. PMID: 34113905; PMCID: PMC8183960.
12. Boehmer JP, Hariharan R, Devecchi FG, Smith AL, Molon G, Capucci A, An Q, Averina V, Stolen CM, Thakur PH, Thompson JA, Wariar R, Zhang Y, Singh JP. A Multisensor Algorithm Predicts Heart Failure Events in Patients With Implanted Devices: Results From the MultiSENSE Study. JACC Heart Fail. 2017 Mar;5(3):216-225. doi: 10.1016/j.jchf.2016.12.011. PMID: 28254128.
13. Rillig A, Magnussen C, Ozga AK, et al. Early Rhythm Control Therapy in Patients With Atrial Fibrillation and Heart Failure. Circulation. 2021;144(11):845-858. doi:10.1161/CIRCULATIONAHA.121.056323

