Roberta Lotti, Università degli Studi di Genova.
Abstract
La Sindrome di Kounis rappresenta una sindrome coronarica acuta caratterizzata dal verificarsi nel contesto di una reazione di ipersensibilità, di un’allergia o di un’anafilassi. E’ classificata in tre tipi: la prima da spasmo coronarico in presenza arterie normali, la seconda da instabilità delle placche in arterie coronariche aterosclerotiche e la terza da trombosi di stent coronarici [1, 2].
Vi riportiamo il caso di un paziente di 67 anni che, a seguito di puntura di un insetto, andava incontro ad anafilassi con evidenza di elevazione del segmento ST-T all’elettrocardiogramma successivamente regredito. La coronarografia evidenziava un quadro di ateromasia diffusa con erosione di placca e, all’analisi OCT, trombo intraluminare nel contesto di ateromasia fibrolipidica diffusa. Veniva dunque posta diagnosi di sindrome di Kounis di tipo 2. La lesione rilevata veniva infine trattata con impianto di stent medicato.
Caso clinico
Presentiamo il caso di un uomo di 67 anni, normotipo, sovrappeso, iperteso e dislipidemico in terapia con un sartano ed una statina a bassa dose. In anamnesi non si rilevavano precedenti cardiovascolari e/o allergologici.
A seguito di una puntura di insetto, il paziente riportava un episodio lipotimico, in assenza di angor, per cui veniva allertato il 112. All’arrivo dei soccorsi il paziente veniva trovato privo di coscienza, ipoteso ( P.A. 70/40 mmHg), si evidenziava inoltre un sovraslivellamento del tratto ST in inferiore all’ECG (Figura 1). Veniva immediatamente avviata soluzione fisiologica ad infusione rapida con ripresa dello stato di coscienza e stabilizzazione emodinamica. Veniva inoltre pretrattato con ASA ed enoxaparina e allertata la sala di emodinamica.
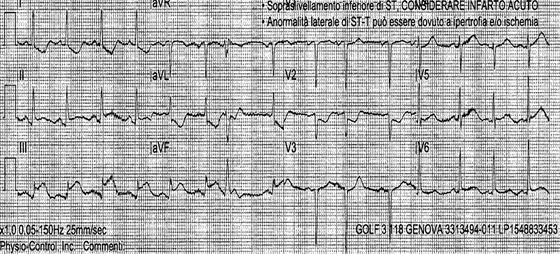
Il paziente accedeva presso la nostra UTIC, asintomatico, emodinamicamente stabile, con la presenza di un diffuso rush cutaneo. All’ECG si osservava quasi completa risoluzione delle alterazioni, mentre all’ecocardiografia al letto si rilevava una modesta ipocinesia medio-basale inferiore in presenza di funzione sistolica globale conservata e assenza di altri reperti. Il primo dosaggio della troponina I risultava di 8.6 ng/dl, i livelli di triptasi erano inoltre elevati.
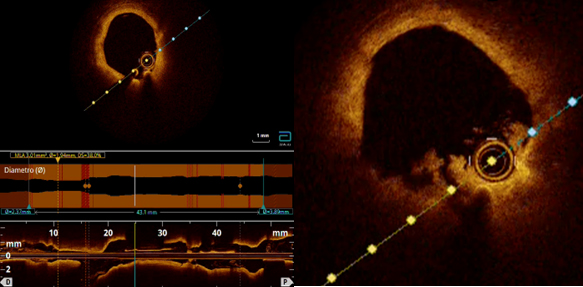
Il paziente veniva inviato in sala di emodinamica con riscontro coronarografico di ateromasia diffusa con stenosi significative di arteria interventricolare posteriore (IVP) e ramo diagonale di modesto calibro. Poiché si osservava un’immagine di minus angiografico a livello della Cx media (sospetta presenza di trombo) si procedeva ad analisi OCT per meglio ottimizzarne l’interpretazione e la successiva eventuale strategia terapeutica (Figura 2). Mediante OCT, si evidenziava un’erosione di placca con presenza di trombo intraluminare nel contesto di ateromasia fibrolipidica diffusa.
Se pur esistono studi preliminari sul trattamento conservativo in questi casi, in assenza di studi clinici randomizzati si decideva di trattare la lesione con impianto di stent medicato (DES), ottimizzato grazie alla rivalutazione OCT che permetteva di evidenziare una lieve mal apposizione.
Nei giorni successivi il paziente era asintomatico e stabile, veniva avviata e mantenuta la duplice anti-aggregazione e venivano effettuati controlli allergologici con il dosaggio di IgE totali e specifiche che dimostravano una sensibilizzazione per tafano e vespidi, ed alti livelli di Triptasi.
Ipotizzavamo pertanto che la reazione anafilattica fosse il fattore scatenante della sindrome coronarica acuta (SCA), confermata dall’associazione di alterazioni dell’ECG, aumento dei livelli di troponina cardiaca e comparsa contemporanea di sintomatologia allergica. Veniva dunque formulata diagnosi di sindrome di Kounis (SK) tipo II.
L’approccio ai pazienti con sindrome coronarica acuta nel contesto di una reazione allergica dovrebbe essere diretto non soltanto all’evento coronarico, ma anche alla reazione allergica che lo induce.
Poiché il vasospasmo è il meccanismo primario, venivano somministrati i calcio-antagonisti non-diidropiridinici (DHP) come terapia di prima linea, evitando l’uso dei betabloccanti.
L’adrenalina è alla base del trattamento dell’anafilassi. Successivamente, al paziente viene prescritta adrenalina autoiniettabile con le istruzioni per l’uso in caso di reazione anafilattica dopo puntura con sintomi respiratori – cardiocircolatori.
Il controllo evolutivo del dosaggio delle IgE specifiche e di triptasi è richiesto alcune settimane dopo la reazione ed è prevista una successiva rivalutazione e l’esecuzione di test cutanei per valutare la possibilità di un trattamento di iposensibilizzazione specifica.
Discussione
La SK, descritta per la prima volta nel 1991, è definita come la concomitante presenza di una SCA ed una reazione allergica o da ipersensibilità, anafilattica o anafilattoide (tutte condizioni in cui abbiamo attivazione di piastrine e mastociti) [1].
Successivamente, lo stesso Kounis, distinse tre diversi tipi: tipo I il cui meccanismo della SCA è lo spasmo in pazienti con coronarie normali (o quasi); tipo II, per rottura/erosione di placca «vulnerabile» pre-esistente; tipo III trombosi di stent con tromboaspirato positivo per presenza di eosinofili e mastociti oppure morte cardiaca improvvisa (SCD) con esame istologico indicativo di infiltrazione eosinofilo-mastocitaria in prossimità dello stent [2].
La sindrome è scatenata dal rilascio di tutti i mediatori della risposta infiammatoria quali istamina, PAF, acido arachidonico e citochine presenti in grande quantità nelle reazioni allergiche.
L’azione di queste molecole a livello coronarico (sia tessuto muscolare liscio che endotelio) è alla base del meccanismo del danno (vasospasmo, trombosi).
All’inizio di una reazione allergica, l’allergene si lega alle corrispettive IgE ed avviene la degranulazione con il rilascio di sostanze, sia pre-formate (granuli) sia prodotti de-novo, localmente e nella circolazione sistemica.
I mastociti sono coinvolti anche in altre condizioni, altri attivatori innescano la loro degranulazione e il rilascio di composti che contribuiscono all’infiammazione e ad altri processi coinvolti nella destabilizzazione delle placche aterosclerotiche. Il rilascio di istamina e renina dai mastociti può̀ innescare il vasospasmo coronarico [3, 6]. In particolare:
– L’istamina induce vasocostrizione coronarica e l’espressione del fattore tissutale e attiva le piastrine;
– Le proteasi neutre (Chinasi, Triptasi, Catepsina) possono attivare le metalloproteasi della matrice, che possono degradare il cappuccio di collagene e indurre l’erosione e la rottura della placca;
– I leucotrieni, potenti vasocostrittori, la cui sintesi è potenziata nella fase acuta dell’angina instabile;
– Il trombossano, potente mediatore dell’aggregazione piastrinica con proprietà vasocostrittrici;
– Il PAF, che nell’ischemia miocardica agisce sia come vasocostrittore diretto, sia attraverso l’attivazione di leucociti e piastrine.
È stato visto che i mastociti vengono attivati da trigger non allergici spesso senza degranulazione ma con il rilascio selettivo di sostanze [7].
È stata inoltre descritta l’associazione della SK e la Sindrome di Takotsubo: gli impulsi provenienti dai centri corticali alti dopo stress emotivo e depressogeno, attraverso una cascata di azioni, stimolazioni, secrezioni e interazioni, possono portare allo sviluppo della sindrome di Kounis, così come durante una reazione allergica il distress respiratorio (broncospasmo, edema della glottide), e la necessità di infondere adreanlina (anafilassi) possono indurre una Takotsubo [8].
I vasi con stent costituiscono un ambiente ideale per il danno e la disfunzione endoteliale, insieme alla turbolenza che si può creare, alla disfunzione piastrinica e alterazioni della coagulazione. La trombosi dello stent ha sicuramente un’eziologia multifattoriale: l’endotelizzazione ritardata, la lunghezza degli stent, la complessità delle lesioni, l’inserimento subottimale dello stent, la turbolenza di flusso, l’aderenza alla terapia antitrombotica. E tra queste cause abbiamo anche l’ipersensibilità ai componenti dello stent che è più probabile che accada in paziente atopici. È stato infatti proposto l’uso di DES con rilascio di farmaci stabilizzatori dei mastociti in pazienti con trombosi di stent in seguito ad una reazione di ipersensibilità [9]. Una recente revisione della letteratura suggerisce il ruolo importante dei mastociti nelle malattie cardiovascolari e soprattutto il ruolo chiave che hanno i mastociti in alcune condizioni nell’ambito delle malattie cardiovascolari. È stato proposto l’uso di stabilizzatori dei mastociti il cui più famoso è il disodio cromoglicano che inibisce l’attivazione dei mastociti IgE-dipendente [10]. Per quanto riguarda l’eziologia, secondo alcune revisioni prospettiche, le cause più frequenti di anafilassi includono cibo, farmaci e punture di insetti. Sintomi alla presentazione più comuni erano orticaria, dispnea, dolore toracico [4]. In uno studio prospettico è stata effettuata la risonanza magnetica cardiaca entro 24h dall’evento che ha mostrato un coinvolgimento subendocardico nelle impregnazioni precoci di Gadolinio ed edema (aree di iperintensità) nelle immagini T2 pesate (indicatore di ischemia) in tutti i pazienti con ipocinesia. L’impregnazione tardiva è normale in tutti i pazienti dimostrando che non c’è danno cardiaco permanente nella SK di tipo I [5]. È importante sottolineare come, nonostante si conoscano i protagonisti alla base della fisiopatologia, vi sia ad oggi ancora difficoltà nel predire il rischio di SK in pazienti con episodi allergici (non esiste un livello soglia nel dosaggio di triptasi, chimasi, livello assoluto di eosinofili). Per quanto riguarda il trattamento distinguiamo [2]:
- SK tipo I: il solo trattamento dell’evento allergico può abolire i sintomi, possono essere utilizzati corticosteroidi ev come idrocortisone e antistaminici come la Difenidramina. La somministrazione di vasodilatatori come Ca-antantagonisti e nitrati può inoltre abolire il vasospasmo, benché i nitrati possano aggravare l’eventuale ipotensione e la tachicardia.
- SK tipo II: il protocollo della SCA insieme a corticosteroidi ed antistaminici. L’uso di B-bloccanti può aumentare lo spasmo coronarico; l’adrenalina, dato in caso di anafilassi, può aggravare l’ischemia e peggiorare il vasospasmo coronarico; la morfina, per il dolore, deve essere data con cautela in quanto può causare una massiccia degranulazione dei mastociti (meglio usare il fentanil e i suoi derivati);
- SK tipo III: dopo l’aspirazione del trombo è importante l’esame istologico per la colorazione degli eosinofili (ematossilina ed eosina) e mastociti (Giemsa), si usano antistaminici insieme a corticosteroidi e stabilizzatori dei mastociti.
Conclusioni
La SK, per quanto rara, rappresenta una forma peculiare di SCA con plurimi meccanismi fisiopatologici, nei quali un ruolo fondamentale è rivestito dall’attivazione di mediatori allergenici. Il trattamento andrebbe pertanto indirizzato non solo alla cura della sindrome coronarica acuta, ma anche alla sottostante reazione anafilattica. L’utilizzo di imaging coronarico avanzato, quale l’OCT, può aiutare a classificarne la tipologia e pertanto ad ottimizzarne il trattamento.
Referenze
[1] Kounis NG, Zavras GM. Histamine-induced coronary artery spasm: the concept of allergic angina. Br J Clin Pract. 1991;45(2):121-128. [2] Kounis NG, Patsouras N, Grapsas N, Hahalis G. Histamine induced coronary artery spasm, fish consumption and Kounis syndrome. Int J Cardiol. 2015;193:39-41. doi:10.1016/j.ijcard.2015.05.038 [3] Theoharides TC, Sismanopoulos N, Delivanis DA, Zhang B, Hatziagelaki EE, Kalogeromitros D. Mast cells squeeze the heart and stretch the gird: their role in atherosclerosis and obesity. Trends Pharmacol Sci. 2011;32(9):534-542. doi:10.1016/j.tips.2011.05.005 [4] Cha YS, Kim H, Bang MH, et al. Evaluation of myocardial injury through serum troponin I and echocardiography in anaphylaxis. Am J Emerg Med. 2016;34(2):140-144. doi:10.1016/j.ajem.2015.09.038 [5] Akoz, Ayhan & Tanboga, Halil & Emet, Mucahit & Bayramoglu, Atif & Kizrak, Yesim & Kantarci, Mecit & Aslan, Sahin. (2013). A prospective study of kounis syndrome: Clinical experience and cardiac magnetic resonance imaging findings for 21 patients. Acta Medica Mediterranea. 29. 811-816. [6] Varricchi G, Marone G, Kovanen PT. Cardiac Mast Cells: Underappreciated Immune Cells in Cardiovascular Homeostasis and Disease. Trends Immunol. 2020;41(8):734-746. doi:10.1016/j.it.2020.06.006 [7] Theoharides TC, Kalogeromitros D. The critical role of mast cells in allergy and inflammation. Ann N Y Acad Sci. 2006;1088:78-99. doi:10.1196/annals.1366.025 [8] Kounis NG, Kounis GN, Kouni SN, Soufras GD. The heart, the brain, and the Kounis syndrome. Eur Heart J. 2006;27(6):757-758. doi:10.1093/eurheartj/ehi776 [9] Kounis NG, Hahalis G, Theoharides TC. Coronary stents, hypersensitivity reactions, and the Kounis syndrome. J Interv Cardiol. 2007;20(5):314-323. doi:10.1111/j.1540-8183.2007.00283.x [10] Hermans M, Lennep JRV, van Daele P, Bot I. Mast Cells in Cardiovascular Disease: From Bench to Bedside. Int J Mol Sci. 2019;20(14):3395. Published 2019 Jul 10. doi:10.3390/ijms20143395