Maria Barilli1, Carmine Marallo1, Carlo Alberto Belli1, Giulia Elena Mandoli1, Claudia Baiocchi2, Amato Santoro2, Matteo Cameli1
1Dipartimento Biotecnologie Mediche, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia
2Dipartimento Cardio-toraco-vascolare, Clinica di cardiologia, Azienda Ospedaliera Universitaria Senese, Siena, Italia.
Abstract
La valutazione dei ritardi di conduzione interventricolari per predire il successo di resincronizzazione delle due camere cardiache nel pacing biventricolare (BiVP) o nel Pacing del Sistema di Conduzione (PSC), non è di pratica comune. Un intervallo di conduzione intrinseco ventricolo destro – ventricolo sinistro sentito (RVs – LVs) > 70 msec o un intervallo ventricolo destro stimolato – ventricolo sinistro sentito (RVp – LVs) > 145 msec è in grado di pronosticare la risposta ventricolare alla terapia di resincronizzazione cardiaca (CRT). Il nostro manoscritto descrive un caso di resincronizzazione cardiaca guidato da intervalli di conduzione interventricolare spontanei e stimolati, ottenuti in modalità BiVP, che ha portato al cambiamento intraoperatorio dell’approccio di stimolazione. Una strategia decisionale per la resincronizzazione cardiaca tramite pacing CSP/BiVP basata sugli intervalli di conduzione interventricolare potrebbe rappresentare un metodo pratico e affidabile per ottenere un QRS stretto e migliorare la risposta alla CRT.
Introduzione:
Le ultime linee guida sulla stimolazione cardiaca e lo scompenso cardiaco raccomandano l’utilizzo della CRT nei pazienti in cui la dissincronia interventricolare ha un forte impatto sulla morbidità e la mortalità. In questi casi, la CRT può essere in grado di migliorare il rimodellamento cardiaco inverso, in sincronia con la terapia medica ottimale (1,8). Tutti i pazienti con scompenso cardiaco a frazione di eiezione severamente ridotta (FE < 35%, HFrEF), classe NYHA II-IV, in ritmo sinusale con QRS di durata o morfologia predisponente a dissincronia ventricolare, quali Blocco di Branca sinistro (BBsn) e durata > 130 msec, trovano beneficio da tale trattamento. L’evidenza maggiore in termini di mortalità e/o ospedalizzazione per scompenso cardiaco è riportata per quei pazienti con BBsn e QRS > 150 msec (1,2).
Nonostante i benefici della CRT, il tasso di non-responders rimane un problema clinicamente rilevante. Il posizionamento del catetere ventricolare sinistro basato unicamente su criteri anatomici, infatti, non ha mostrato un impatto significativo sull’outcome (3). Lo studio più specifico dei casi di dissincronia elettrica interventricolare potrebbe migliorare il tasso di risposta alla CRT. In letteratura è descritto che il riscontro di un ritardo ventricolo destro – ventricolo sinistro intrinseco (RVs – LVs) > 70-80 msec o un intervallo ventricolo destro stimolato – ventricolo sinistro sentito (RVp – LVs) > 146 msec sia in grado di predire un miglior outcome di resincronizzazione (3,7). Intervalli RVs – LVs o RVp – LVs subottimali registrati durante il posizionamento del catetere sinistro portanto frequentemente ad ottenere un QRS largo con persistenza di dissincronia.
La stimolazione del sistema di conduzione (CSP) ha dimostrato essere una tecnica realizzabile ed efficace per l’ottenimento di un pacing fisiologico lungo il naturale sistema di conduzione. La modalità BiVP rimane la metodica di prima linea per la CRT però, come suggerito dalle linee guida europee, il CSP dovrebbe essere considerato nei casi di fallimento del posizionamento del catetere sinistro. L’approccio di stimolazione hissiana (HBP) presenta alcuni svantaggi, quali la necessità di soglie di stimolazione più elevate, l’ottenimento di onde R di bassa ampiezza, il rischio di oversensing delle onde atriali o undersensing dei potenziali ventricolari. La stimolazione della branca sinistra (LBBP) permette il superamento di tali limitazioni4 diventando una tecnica alternativa di CSP (5).
Caso clinico:
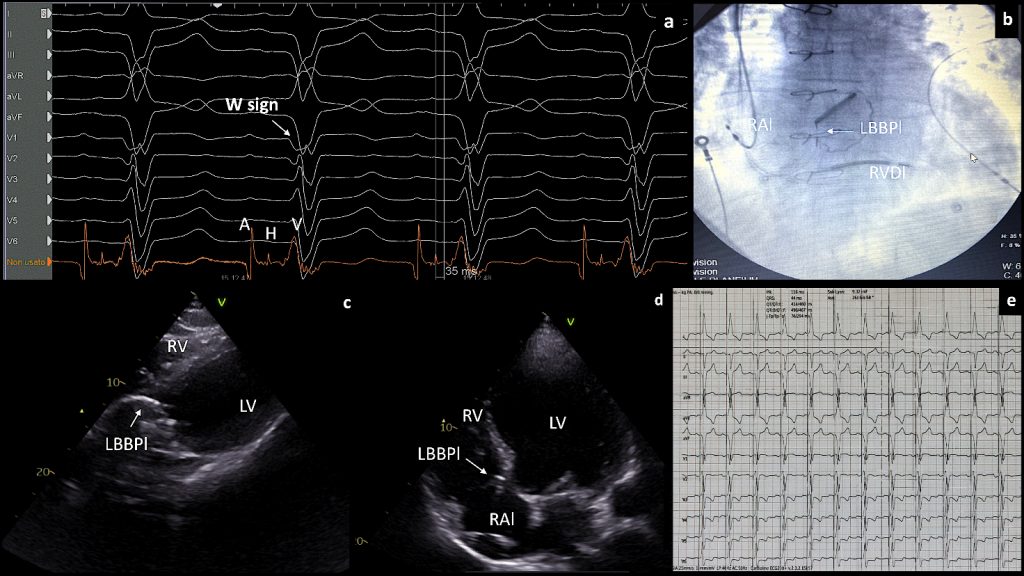
Un uomo di 68 anni, portatore di protesi valvolare aortica biologica e affetto da HFrEF in un quadro di cardiomiopatia dilatativa di origine valvolare a coronarie indenni, accedeva presso il nostro dipartimento d’emergenza per un quadro di scompenso congestizio acuto su cronico (Classe NYHA III-IV). In seguito a stabilizzazione e proseguimento della terapia medica ottimalizzata, l’ecocardiogramma transtoracico mostrava una frazione di eiezione del 18% con severa disfunzione biventricolare. All’elettrocardiogramma si evidenziava un ritardo di conduzione tipo BBsn con durata del QRS 142 msec (Figura 1 a). In considerazione delle più recenti linee guida europee sullo scompenso cardiaco, al paziente veniva posta indicazione per impianto di ICD-biventricolare (8).
Descrizione della procedura:
A seguito del posizionamento del catetere coiled in ventricolo destro, abbiamo incannulato il seno coronarico (CS) usando un catetere quadripolare Josephson curvo diagnostico. Il delivery è stato avanzato lungo il quadripolare con successiva esecuzione di venografia del CS: veniva evidenziata una vena tributaria antero-laterale utile all’incannulamento del quadripolare per ottenere il BiVP. I ritardi EGM misurati successivamente al posizionamento del catetere sinistro mostravano un intervallo RVs – LVs di 80 msec e un RVp – LVs di 100 msec. L’ECG misurato in modalità BiVP riportava un QRS di 192 msec (Figura 1 b). Le figure 1c e 1d evidenziano la posizione degli elettrocateteri in fluoroscopia. In considerazione dell’alta probabilità di insuccesso di resincronizzazione in presenza di tali predittori di scarso outcome, il catetere sinistro quadripolare veniva rimosso. Si procedeva successivamente ad eseguire mappaggio dell’His tramite catetere Josephson quadripolare, dimostrando un blocco sub-Hissiano (intervallo HV 105 msec). Vista la possibilità di stimolazione diretta della branca sinistra, avvantaggiata da un’area target più ampia rispetto al fascio di His, si optava per l’esecuzione di un sistema di pacing CSP tipo LBB. Tramite specifico sistema di delivery per impianto di LBBP con catetere 3830 (Medtronic Inc, Minneapolis, MN) si otteneva un EGM come da branca sinistra. La guaina veniva avanzata con guida floroscopica raggiungendo il setto interventricolare destro, 1-1.5 cm sopra il sito hissiano in proiezione obliqua anteriore destra (RAO) 30°. L’orientamento a livello settale si confermava in proiezione obliqua anteriore sinistra (LAO) 40°. Il QRS mostrava morfologicamente il notch al nadir lungo la derivazione precordiale V1, noto come “pattern W” (Figura 2 a).
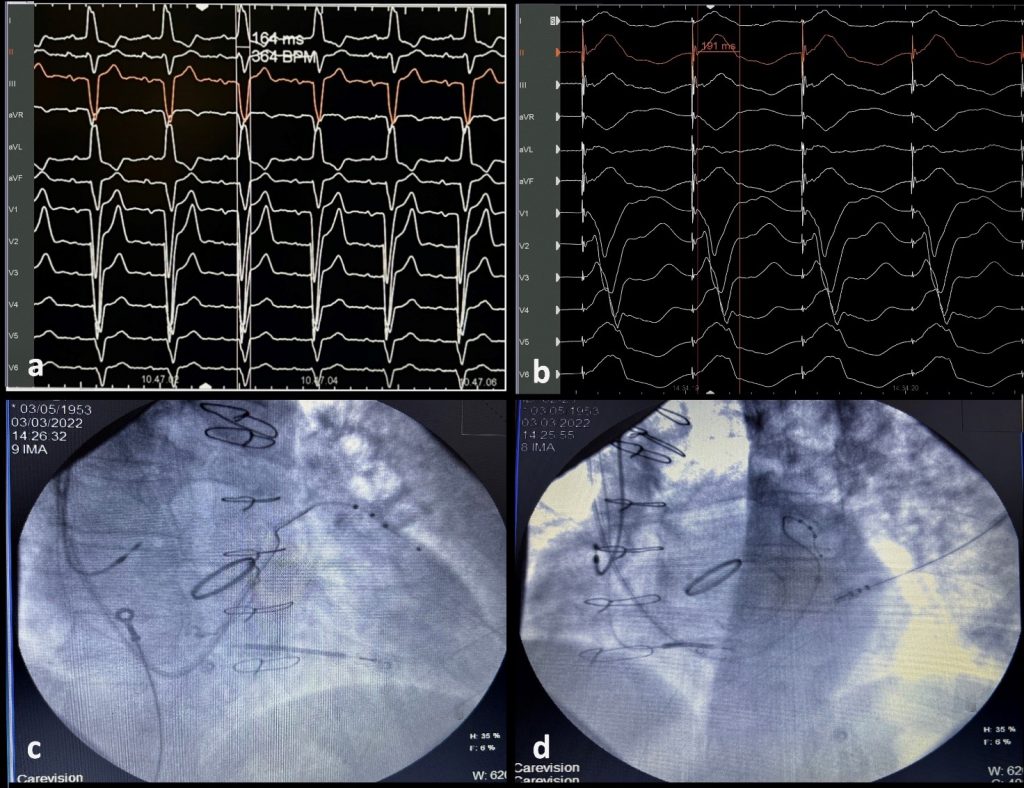
A seguito di riscontro di intervallo ventricolare locale EGM a LBB di 35 msec abbiamo eseguito un test di cattura decrementale con ottenimento di transizione della morfologia del QRS da LBB non-selettivo a selettivo. Il tempo al picco di attivazione del LV lungo le precordiali V5-V6 < 80 msec confermava il corretto orientamento del catetere di pacing. Pertanto, la punta veniva mantenuta perpendicolare alla superficie settale usando la guaina per conferire stabilità, con successivo impianto intrasettale raggiungendo il subendocardio del ventricolo sinistro tramite una profondità di penetrazione di circa 6-8 mm. L’avanzamento veniva eseguito in LAO 40°.
La posizione veniva accertata grazie alla presenza del “fulcrum sign” in fluoroscopia LAO 30° (Figura 2b), mentre il “W” all’EGM su V1 risultava essere un pattern a BBdx. L’impedenza di pacing in setting unipolare era aumentata gradualmente fino all’attesa caduta a 100-200 Ω al raggiungimento del subendocardio. La stimolazione ad alti e bassi voltaggi mostrava una riduzione della durata del QRS fino a 110 msec con una soglia di stimolazione a 1V x 0.4 msec. Tutti i parametri sono stati ricontrollati a seguito di rimozione del delivery, per scongiurare un’eventuale dislocamento. All’ecocardiografia post-impianto si poteva notare il posizionamento intrasettale profondo dell’elettrocatetere sinistro (Figura 2 c-d). Successivamente al follow-up è stata dimostrata l’efficace risposta alla CRT-CSP con un miglioramento della frazione d’eiezione del 17%.
Discussione e conclusioni
L’attuale indicazione per la CRT standard in modalità BiVP è basata su solide evidenze riguardanti la sua efficacia e sicurezza (Classe di evidenza livello A)8, rendendola la terapia gold standard per la resincronizzazione cardiaca. La letteratura suggerisce l’utilizzo della stimolazione Hissiana in caso di fallito impianto di catetere sinistro tramite seno coronarico1. Utilizzando la stimolazione diretta della branca sinistra sono stati descritti numerosi vantaggi, tra i quali la maggiore area di impianto e la necessità di soglie minori, ma ancora non abbiamo a disposizione dati a lungo termine (4). L’uso di ritardi di conduzione intracardiaci per predire la risposta alla CRT sono già stati descritti (3,6) e, nel nostro caso, in congiunta all’ottenimento di un QRS in modalità BiVP di lunga durata, risultavano essere markers di scarso outcome. Pertanto, nonostante il cannulamento di una vena antero-laterale dal CS risulti essere idoneo per impianto dell’elettrocatetere sinistro secondo la letteratura, il nostro approccio ha portato a preferire l’utilizzo di una modalità di stimolazione fisiologica del sistema di conduzione. In specifico, visto il ritardo H-V prolungato, abbiamo optato per un LBBp. La procedura è stata eseguita come precedentemente descritta4 raggiungendo soglie di stimolazione basse e durata del QRS ottimale. In considerazione della necessità di inserimento a livello settale profondo dell’elettrocatetere, l’utilizzo di conoscenze dei segnali EGM, del segno “W” e della precisa anatomia del sistema di conduzione risulta essere fondamentale per tale applicazione, insieme ai marker anatomici in fluoroscopia. Questo caso mostra quindi come, tramite lo studio intraprocedurale degli intervalli LVp – RVs e RVp – LVs si possa ottimizzare la terapia di resincronizzazione specifica per ogni paziente, con il raggiungimento di un effettivo rimodellamento ventricolare. Studi con ampie coorti di pazienti sono necessari per la validazione di tale approccio.
Bibliografia
- Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal. 2021;42(35):3427-3520. doi:10.1093/eurheartj/ehab364
- Moss AJ, Hall WJ, Cannom DS, et al. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med2009;361:1329–38
- Gold MJ , Singh JP, Ellenbogen KA, Yu Y, Wold N et al., Interventricular Electrical Delay Is Predictive of Response to Cardiac Resynchronization Therapy, 10.1016/j.jacep.2016.02.018
- Mulia EPB, Amadis MR, Julario R, Dharmadjati BB. Left bundle branch pacing: An evolving site for physiological pacing. Journal of Arrhythmia. 2021;37(6):1578-1584. doi:10.1002/joa3.12638
- Ponnusamy S S, Arora V et al., Left bundle branch pacing: A comprehensive review, J. of Cardiovascular Electrophysiology, doi:10.1111/jce.14681
- Naqvi, S.Y., Jawaid, A., Goldenberg, I. et al. Non-response to Cardiac Resynchronization Therapy. Curr Heart Fail Rep 15, 315–321 (2018). https://doi.org/10.1007/s11897-018-0407-7 1 LG
- Moubarak, G., Sebag, F.A., Socié, P., Villejoubert, O., Louembe, J., & Ferchaud, V. (2020). Interrelationships between interventricular electrical delays in cardiac resynchronization therapy. Journal of Cardiovascular Electrophysiology, 31, 2405 – 2414.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726. doi: 10.1093/eurheartj/ehab368. Erratum in: Eur Heart J. 2021 Oct 14;: PMID: 34447992.
