Gianluca Di Bella a, Francesco Cappellib , Roberto Licordaria, Paolo Piaggic, Mariapaola Campisia , Diego Bellaviad, Fabio Minutolie, Luca Gentilea, Massimo Russoa, Cesare de Gregorioa , Federico Perfettob, Anna Mazzeoa, Calogero Fallettad, Francesco Clemenzad, Giuseppe Vitaa, Scipione Carerja, Giovanni Donato Aquarof.
a Dipartimento di medicina clinica e sperimentale , Università di Messina, Messina, Italia;
b Ospedale Universitario Careggi, Firenze, Italia.
cDipartimento di medicina clinica e sperimentale, Università di Pisa, Pisa, Italia
d Divisione di malattie cardiovascolari, Dipartimento Cardio-toracico, IRCCS-ISMETT, Palermo, Italia.
eDipartimento di scienze biomediche e dentali e di imaging morfofunzionale, Università di Messina,
f Fondazione Monasterio, Regione Toscana, Pisa, Italia.
ABSTRACT
L’amiloidosi cardiaca (AC) è una cardiomiopatia a fenotipo ipertrofico con deposizione di fibrille nell’interstizio cardiaco. Presentiamo lo studio, il cui scopo era di valutare la prevalenza e il valore diagnostico di siti di deposito extra-ventricolari, in strutture non convenzionali, valutati all’ecocardiogramma. 146 pazienti, con spessore del ventricolo sinistro (VS) ≥ 15mm, sono stati arruolati: 70 pazienti avevano ricevuto diagnosi di cardiomiopatia ipertrofica sarcomerica (gruppo HCM) e 76 con amiloidosi (gruppo AC). Il gruppo AC mostrava maggiori dimensioni della crista terminalis (CriT), del setto interatriale (SIA), del coumadin ridge (CouR), del piano atrio-ventricolare (AVP), lamina mitro-aortica (MAL). Sono stati identificati i seguenti cut-off per determinare la presenza di AC: SIA>9mm, MAL>7mm, CriT>9mm2. Tali evidenze di fronte ad un paziente a fenotipo ipertrofico dovrebbero suggerire approfondimenti diagnostici.
COMMENTO
L’amiloidosi cardiaca (AC) è una cardiomiopatia a fenotipo ipertrofico caratterizzata dalla deposizione di fibrille nell’interstizio di miocardio, valvole, pericardio e vasi, che porta ad un aumento degli spessori ventricolari [1]. I sottotipi più comuni sono quella da catene leggere (AL), da trans-tiretina mutata (ATTRv) e da trans-tiretina wild-type (ATTRwt) [2].
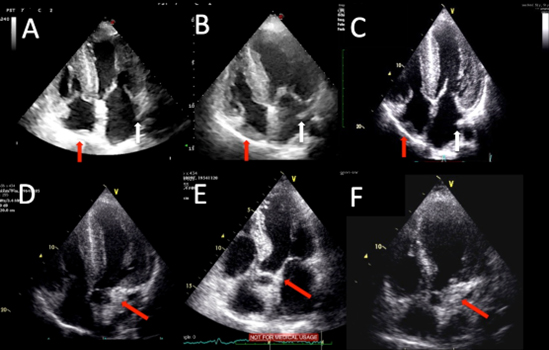
L’aumento dello spessore del setto inter-atriale (SIA) è stato osservato nell’AC [3]. La deposizione di amiloide può essere osservata in altre strutture extra-ventricolari [piano atrio-ventricolare (AVP), coumadin ridge (CouR), lamina mito-aortica (MAL), valvola di Eustachio (EusV) o crista terminale (CriT)].
Gli obiettivi del nostro studio sono (1) descrivere le localizzazioni extra-ventricolari della deposizione di amiloide; e (2) valutarne l’accuratezza nel distinguere l’AC dalla cardiomiopatia ipertrofica sarcomerica (HCM).
Abbiamo arruolato prospetticamente 155 pazienti con fenotipo ipertrofico (spessore della parete del VS di >15 mm con ventricolo sinistro non dilatato, senza possibili cause emodinamiche di ipertrofia).
Le sezioni apicali quattro e cinque camere sono state utilizzate per rilevare CouR (cm2), CriT (cm2), EusV (cm2), AVP (mm) e SIA (mm). La media di misurazioni in cinque camere e asse lungo parasternale è stata utilizzata per calcolare la MAL (mm) (Figura 1). La media delle misurazioni dalle sezioni para-sternale ad asse lungo ed asse corto è stata utilizzata per quantificare la parete anteriore dell’aorta ascendente (mm) (Figura 2). Tutti i parametri sono stati misurati in tele-diastole.
La popolazione finale era composta da 146 pazienti (9 pazienti sono stati esclusi per motivi tecnici e per altre diagnosi). 66 pazienti avevano una AC da transtiretina (gruppo AC) e 70 HCM (gruppo HCM).
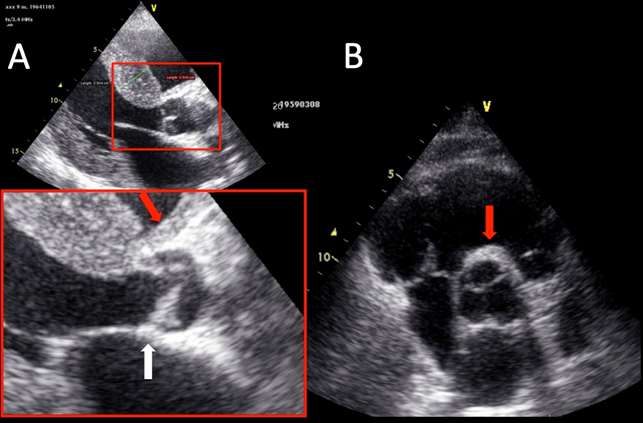
La presenza di CriT è stata osservata più comunemente (p=0.003) nel gruppo AC rispetto al gruppo HCM; mentre la presenza di EusV era simile. Il gruppo AC ha mostrato un significativo aumento dello spessore di CriT, CouR, AVP, MAL e SIA rispetto al gruppo HCM.
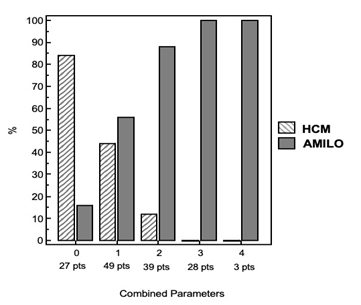
I pazienti con AC hanno mostrato una maggiore prevalenza di 2 o più localizzazioni extra-ventricolari (Figura 3).
L’analisi multivariata ha mostrato come predittori indipendenti di AC: area CriT, MAL e LVEF.
Secondo l’analisi delle curve ROC, i migliori cut-off per l’identificazione del gruppo AC erano SIA > 9 mm, MAL > 7mm, CriT > 90mm2 e CouR > 80mm2. Un SIA ispessito aveva la migliore specificità (96%) e valore predittivo positivo (93%) ma mostrava bassa sensibilità (44%) e valore predittivo negativo (57%) nell’identificazione della AC. Combinando i parametri (CriT, MAL, SIA e CouR), la presenza di uno o più parametri è stata associata a una sensibilità del 92%, una specificità del 39%, un valore predittivo positivo (PPV) del 66% e un valore predittivo negativo (NPV) del 79% nell’identificazione della AC; combinando almeno 3 parametri è stata osservata una specificità del 100% e un PPV del 100%.
Questo è il primo studio prospettico che valuta la prevalenza ecocardiografica e il ruolo diagnostico dei segni di deposizione di amiloide extra-ventricolare. I principali risultati sono: (1) la deposizione di amiloide extra-ventricolare è frequente nella AC da transtiretina; (2) MAL, CriT, SIA e frazione d’eiezione ventricolare sinistra (FEVS) più bassa sono predittori indipendenti di AC da transtiretina; (3) la combinazione di questi segni di deposito extra-ventricolare aumenta l’accuratezza diagnostica per la AC.
Precedentemente, Falk e colleghi hanno dimostrato che il SIA ispessito aveva un’elevata specificità nella diagnosi di AC [3]. I nostri dati dimostrano che anche altre strutture cardiache, non indagate di routine, possono essere coinvolte nel deposito di amiloide cardiaca e possono indirizzare la diagnosi.
Davanti ad un paziente con fenotipo ipertrofico, l’evidenza di ispessimento di CriT o MAL dovrebbe essere altamente suggestiva di AC da transtiretina e spingere ad approfondimenti diagnostici.
BIBLIOGRAFIA
[1] Benson MD, Buxbaum JN, Eisenberg DS, et al. Amyloid nomenclature 2020: update and recommendations by the inter- national society of amyloidosis (ISA) nomenclature committee. Amyloid. 2020;27(4):217–222. [2] Rapezzi C, Merlini G, Quarta CC, et al. Systemic cardiac amy- loidoses: disease profiles and clinical courses of the 3 main types. Circulation. 2009;120(13):1203–1212. [3] Falk RH, Plehn JF, Deering T, et al. Sensitivity and specificity of th echocardiographic features of cardiac amyloidosis. Am J Cardiol. 1987;59(5):418–422.Per saperne di più:
Gianluca Di Bella, Francesco Cappelli, Roberto Licordari, Paolo Piaggi, Mariapaola Campisi, Diego Bellavia, Fabio Minutoli, Luca Gentile, Massimo Russo, Cesare de Gregorio, Federico Perfetto, Anna Mazzeo, Calogero Falletta, Francesco Clemenza, Giuseppe Vita, Scipione Carerj & Giovanni Donato Aquaro (2022): Prevalence and diagnostic value of extra-left ventricle echocardiographic findings in transthyretin-related cardiac amyloidosis, Amyloid, DOI: 10.1080/13506129.2022.2064739