Un caso atipico di flutter atriale tipico: quando il substrato è più complesso dell’atteso.
Federico Blasi, MD a,b, Jacopo Marazzato, MD a,b, Michele Golino, MD a,b, Carlo Arnò, MD a, b, Manola Vilotta, EP Tech a, Lorenzo Adriano Doni, MD a, Raffaella Marazzi, MD a, Roberto De Ponti, MD, FHRS a,b,.
a Department of Heart and Vessels, Ospedale di Circolo, Viale Borri, 57, Varese 21100, Italy; b Department of Medicine and Surgery, University of Insubria, Viale Guicciardini, 9, Varese 21100, Italy.
Abstract:
Le aritmie atriali nel contesto di cardiopatie congenite corrette chirurgicamente possono nascondere substrati aritmici più complessi di quanto atteso, che vanno accuratamente valutati da un punto di vista clinico ed interventistico. Riportiamo il caso di una paziente di 51 anni nata con un quadro di Tetralogia di Fallot, giunta alla nostra attenzione per un quadro di tachicardia sopraventricolare, in cui lo studio elettrofisiologico comprensivo di un accurato mappaggio elettroanatomico ha consentito la corretta definizione dell’aritmia sottostante con conseguente trattamento definitivo del substrato aritmico.
Introduzione:
Nel corso degli anni, le tecniche di ablazione per il flutter atriale tipico comune (FLATC) sono migliorate al punto che l’ablazione dell’istmo cavo-tricuspidalico (ICT) è attualmente considerata la terapia di scelta in questa aritmia. Infatti, la percentuale di successo dopo una singola procedura è riportata in letteratura pari al 91,7%, con un tasso di complicanze inferiore allo 0,5%. 1
Tuttavia, alcune situazioni particolari possono inficiare l’efficacia e la sicurezza di questa procedura.
Spesso è possibile riconoscere le procedure che presenteranno possibili difficoltà grazie ad elementi presenti all’ECG di base, come un ciclo più lungo, o ad un contesto particolare, come una storia di intervento cardiochirurgico e/o cardiopatie congenite.
Caso Clinico:
Nel 2019, una donna di 51 anni accedeva in Pronto Soccorso con un quadro di scompenso cardiaco e cardiopalmo. La paziente era nota per Tetralogia di Fallot per cui era stata sottoposta nel 1973 e nel 1981 a correzione chirurgica con infundibolectomia e posizionamento di patch pericardico transanulare, chiusura del difetto del setto interventricolare e posizionamento di una protesi biologica polmonare. Dall’intervento correttivo permane una residua stenosi polmonare, in follow up presso il centro di riferimento.
All’ECG di presentazione in Pronto Soccorso si riscontrava una tachicardia sopraventricolare a 100 bpm, condotta con blocco di branca destra ed emiblocco anteriore sinistro, in assenza di chiare onde P (Figura 1A).
Dopo la somministrazione della terapia per il controllo della frequenza ventricolare, l’ECG mostrava un’aritmia atriale con onde P a morfologia compatibile con un FLATC, con variabile conduzione atrioventricolare (Figura 1B). Vista la persistenza dell’aritmia e della sintomatologia, la Paziente veniva sottoposta a studio elettrofisiologico (SEF) ed eventuale ablazione trans catetere per il ripristino del ritmo sinusale.
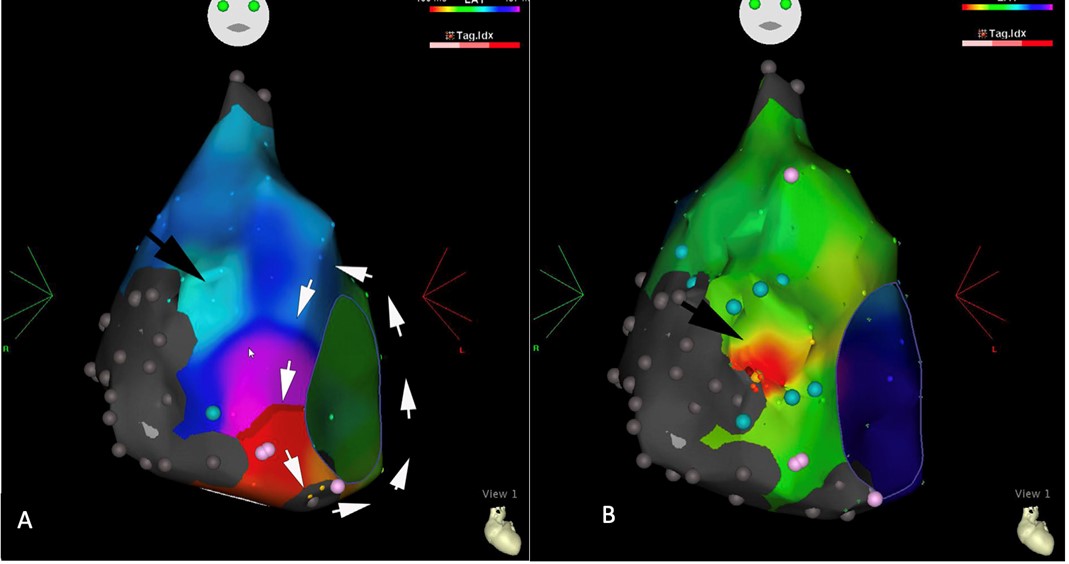
Durante il SEF, dopo posizionamento di un catetere decapolare in seno coronarico come repere, è stato eseguito un mappaggio elettroanatomico dell’aritmia in atrio destro, mostrando una vasta area cicatriziale nella zona postero-laterale (zona grigia nel mappaggio elettroanatomico, Figura 2A) e piccole zone cicatriziali sparse a livello dell’ICT.
Dopo ricostruzione del percorso di rientro, si è dimostrato come l’aritmia fosse sostenuta da un macrorientro con orientamento antiorario intorno all’anello tricuspidale, con ciclo di 350 ms e rallentamento a livello del tessuto cicatriziale nell’ICT (Fig. 2A). Questa particolare durata del ciclo favoriva un rapporto di conduzione atrio-ventricolare 1:1, che, associata al disturbo di conduzione, mascherava l’effettiva aritmia all’ECG di presentazione.
Inoltre, grazie all’accurato mappaggio elettroanatomico, si è evidenziata un’area di attivazione relativamente precoce a ore 11 dell’anello tricuspidale, non legata al loop peritricuspidale e fonte di una seconda onda di attivazione (freccia nera Fig. 2A), segno della coesistenza di un secondo substrato fonte di un’aritmia parzialmente soppressa dal flutter in corso.
Pertanto, l’ICT è stato sottoposto ad ablazione con radiofrequenze e successivo blocco della conduzione smascherando, all’interruzione del circuito, una seconda aritmia con ciclo di 360 ms (Fig. 3).
Il mappaggio post-ablazione ha mostrato un’aritmia focale con un’attivazione centrifuga più precoce nella zona identificata già al primo mappaggio in corso di flutter come zona ad attivazione precoce (Fig 2B). Successive applicazioni di radiofrequenze nella zona hanno quindi soppresso efficacemente la tachicardia atriale.
A seguito della procedura descritta la paziente si è mantenuta in ritmo sinusale, stabile e asintomatica per cardiopalmo al follow up a due anni ed è seguita presso il centro di riferimento per dal punto di vistacardiochirurgico per la nota stenosi polmonare.
Discussione:
Oltre alle aritmie da macrorientro come i flutter atriali, anche le tachicardie atriali focali possono essere riscontrate nei pazienti sottoposti ad interventi cardiochirurgici.
Anche se in questa popolazione le aritmie atriali da macrorientro risultano di gran lunga più rappresentate, un meccanismo focale è presente dal 7 al 18% delle aritmie riportate in letteratura2-6.
I siti di origine delle tachicardie atriali focali possono essere in alcuni casi, come quello descritto, molto vicini a vaste zone cicatriziali con bassi potenziali, dove i microrientri possono rappresentare l’origine dell’aritmia.
Nel caso proposto, un’aritmia focale ed un flutter tipico comune coesistevano, come dimostrato dal mappaggio elettroanatomico di propagazione.
Ciò era possibile solo grazie al fatto che il ciclo delle due aritmie risultava molto simile, dato che il FLATC era rallentato dalla zona cicatriziale dell’ICT.
È inoltre interessante notare come la frequenza ventricolare della prima aritmia osservata (Fig 1A), non corrisponda esattamente ad alcun possibile rapporto di conduzione del FLATC con ciclo di 350 ms osservato successivamente. Poiché le aritmie da rientro tendono a mantenere un ciclo stabile a differenza di quelle focali, è possibile che la prima aritmia mostrata in figura 1 possa essere la tachicardia atriale focale riscontrata poi successivamente durante il SEF e che in questo caso le due aritmie si alternassero.
Conclusioni:
Le aritmie atriali in un contesto di cardiopatia congenita corretta chirurgicamente possono nascondere un substrato più complesso di quanto atteso, che va accuratamente valutato da un punto di vista clinico ed interventistico.
In questi casi particolari è pertanto fondamentale eseguire un accurato mappaggio elettroanatomico in modo da consentire un trattamento completo e definitivo del substrato aritmico.
FIGURE:
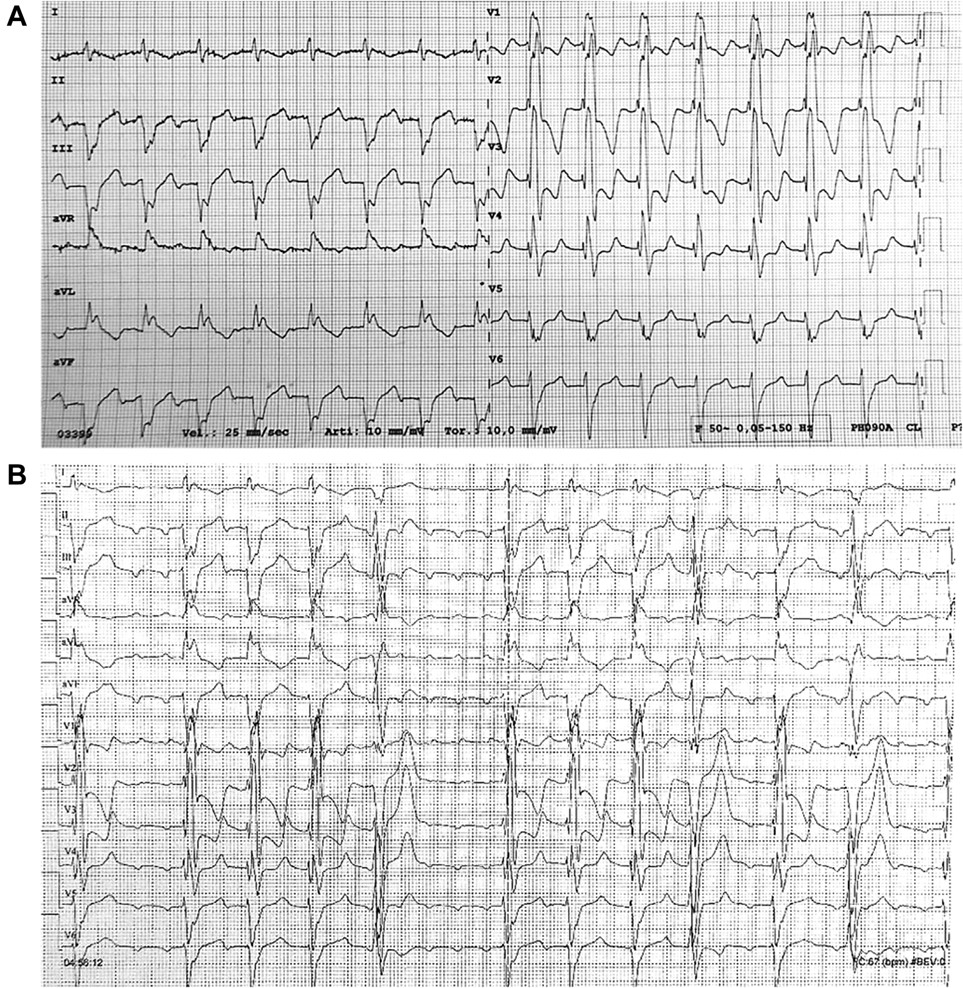
Fig. 1. ECG a 12 derivazioni all’ingresso in PS (A) e dopo terapia (B).
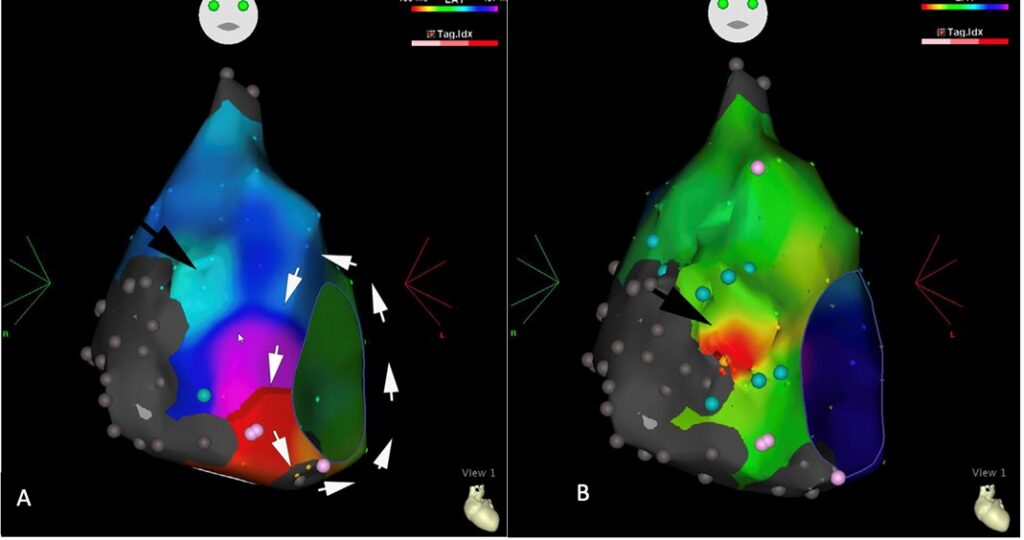
Fig. 2: A) Mappa di attivazione elettroanatomica del FLATC in atrio destro in proiezione antero-posteriore. Un singolo loop è evidente a livello peritricuspidalico (frecce bianche). Un’ulteriore zona di attivazione precoce, non compatibile con il loop di rientro, si osserva nella zona antero-laterale alle ore 11 dell’ICT (freccia nera). Le aree grigie identificano zone cicatriziali prive di attività elettrica mentre i punti rosa rappresentano zone con potenziali frammentati.
B) Mappa di attivazione elettroanatomica della tachicardia focale atriale dopo interruzione del FLATC. La zona rossa (freccia nera) identifica la zona di attivazione precoce già evidente in corso di FLATC.
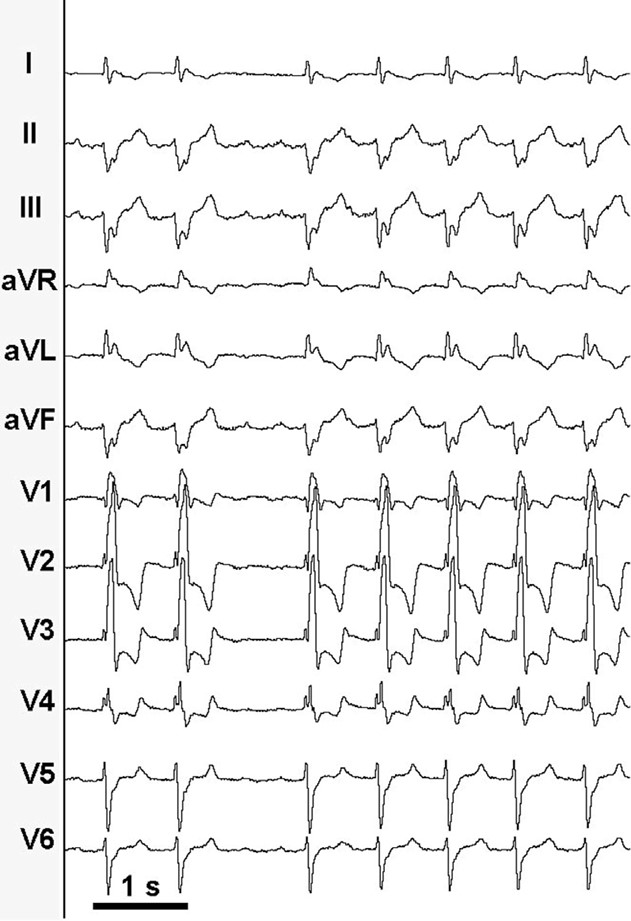
Fig. 3. ECG a 12 derivazioni della tachicardia atriale comparsa dopo blocco della conduzione a livello dell’ICT, con ciclo di 360 ms.
Bibliografia:
- Spector P, Reynolds MR, Calkins H, et al. Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol 2009;104:671-7.
- de Groot NM, Zeppenfeld K, Wijffels MC, et al. Ablation of focal atrial arrhythmia in patients with congenital heart defects after surgery: role of circumscribed areas with heterogeneous conduction. Heart Rhythm 2006;3:526–35.
- Pap R, Koha´ ri M, Makai A, et al. Surgical technique and the mechanism of atrial tachycardia late after open heart surgery. J Interv Card Electrophysiol 2012;35:127–35.
- Koha´ ri M, Pap R. Atrial tachycardias occurring late after open heart surgery. Curr Cardiol Rev 2015; 11:134–40.
- Moore JP, Gallotti RG, Chiriac A, et al. Catheter ablation of supraventricular tachycardia after tricuspid valve surgery in patients with congenital heart disease: a multicenter comparative study. Heart Rhythm 2020;17:58–65.
- Marazzato J, Cappabianca G, Angeli F, et al. Ablation of atrial tachycardia in the setting of prior mitral valve surgery. Minerva Cardiol Angiol 2021;69: 94–101.
Info sull'autore