Matching Imaging and Remodulation Effects: Benefits of Cardiac Contractility Modulation Shown by Global Longitudinal Strain: A Case Report
Andrea Matteucci 1,2 , Giacomo Bonacchi 2 , Vincenzo Mirco La Fazia 2 , Giuseppe Stifano 2 e Domenico Sergi 2
1 Division of Cardiology, San Filippo Neri Hospital, Via Martinotti, 20, 00135 Rome, Italy
2 Division of Cardiology, University Hospital “Tor Vergata”, 00133 Rome, Italy;
Abstract
Il dispositivo per la Cardiac Contractily Modulation (CCM) è un device proposto per i pazienti affetti da scompenso cardiaco a frazione d’eiezione ridotta ancora sintomatici nonostante terapia medica ottimale. Presentiamo il caso di una paziente trattata con terapia medica massimale e angioplastica primaria per sindrome coronarica acuta senza elevazione persistente del tratto ST-T (NSTE-ACS). La paziente rifiutava l’impianto di un defibrillatore impiantabile e, per ridurre il numero di accessi per riacutizzazione di scompenso cardiaco, le è stato proposto l’impianto del device per la Cardiac Contractily Modulation. Dopo l’impianto si è osservato un notevole miglioramento dei parametri ecocardiografici e della qualità di vita. Dopo nove mesi dall’impianto non si sono registrati riacutizzazioni di scompenso cardiaco. Abbiamo osservato con l’analisi speckle tracking come il miglioramento nel global longitutinal strain può correlare con il rimodellamento dei miocardiociti.
Introduzione
Il dispositivo per la “Cardiac Contractily Modulation” (CCM) è stato proposto per i pazienti affetti da scompenso cardiaco a frazione d’eiezione ridotta ancora sintomatici nonostante terapia medica ottimale [1]. Questo agisce tramite modifiche epigenetiche sui cardiomiociti, migliorando la resistenza all’esercizio fisico e la qualità della vita, andando a ridurre il numero di accessi ospedalieri. Tramite l’analisi istologica è stato dimostrato uno shift dei geni espressi nel cuore scompensato, in particolar modo dei geni che agiscono sul pathway delle proteine regolatrici il ciclo del calcio. La CCM si è dimostrata efficace indipendentemente dalla durata del QRS [2]. In questo caso clinico abbiamo dimostrato l’utilità dello speckle tracking strain [3] nel confermare il miglioramento clinico-strumentale di questa paziente.
Caso clinico
Presentiamo il caso clinico di una paziente di 77 anni ricoverata presso il nostro reparto di cardiologia per peggioramento della dispnea e astenia marcata. La paziente, dislipidemica, ipertesa, diabetica era stata precedentemente sottoposta a triplice bypass aortocoronarico. Nell’ultimo anno aveva effettuato tre ricoveri per riacutizzazione di scompenso cardiaco. In passato aveva rifiutato l’impianto di un defibrillatore per paura di potenziali shock.
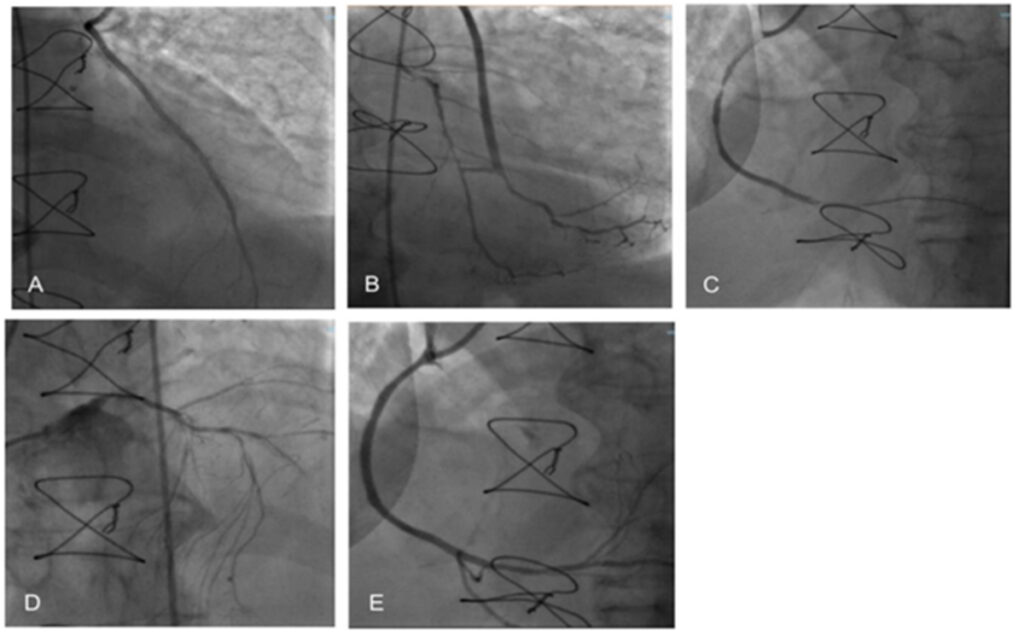
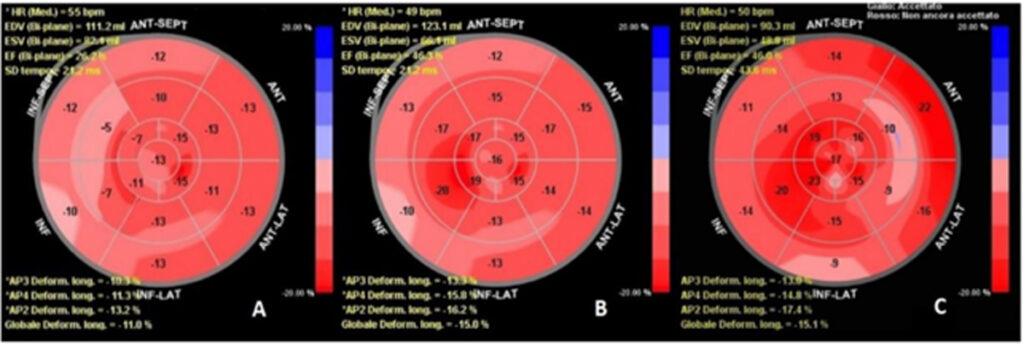
Al momento del ricovero presso il nostro reparto la paziente presentava un valore di pressione arteriosa di 100/65 mmHg, edema perimalleolare. La terapia medica all’ingresso era ottimizzata secondo le condizioni cliniche della paziente. La prima valutazione ecocardiografica mostrava acinesia dell’apice e di tutti i segmenti distali, ipocinesia della parete anteriore e del setto interventricolare (LVEF 25%). La paziente veniva dunque sottoposta a studio coronarografico che mostrava pervietà dei bypass precedentemente confezionati e una nuova lesione sul tratto distale della coronaria destra trattato mediante angioplastica con impianto di uno stent medicato (Figura 1). Dopo 40 giorni la paziente si presentava ancora in condizioni cliniche scadute e veniva effettuata nuova valutazione ecocardiografica della LVEF con metodica speckle tracking strain, una tecnica quantitativa per stimare la funzionalità miocardica attraverso un’analisi della deformazione miocardica indipendente dai movimenti di traslazione ‘in plane’ e dall’angolo di insonazione [4]. L’analisi mostrava una deformazione longitudinale AP3 (LD) −10.3%, AP2 LD −11.3%, AP4 LD −13.2%, global LD −11.0%. L’ LVEF calcolata con metodo Simpson biplano era 26% (Figura 2A), e dunque in assenza di miglioramenti dal giorno del ricovero. È stata valutata la capacità di esercizio fisico e la qualità di vità tramite six-minute walking test (SMWT), e questionario Minnesota Living with Heart Failure (MLWHFQ). La paziente era riuscita a percorrere una distanza di 50 metri con una saturazione del 88% e il punteggio del MLWHFQ era 84 punti.
In considerazione della persistenza della ridotta LVEF, dei numerosi accessi ospedalieri per riacutizzazioni di scompenso cardiaco si procedeva ad impianto di dispositivo CCM. A un mese dalla dimissione la paziente riferiva un notevole miglioramento nei sintomi e nella dispnea da sforzo. La valutazione ecocardiografica dello strain del ventricolo sinistro mostrava un valore nella proiezione apicale tre camere di -13.35, nella due camere di -15.8% e nella quattro camere di -16,2% con un risultato globale di -15%; con un miglioramento nelle regioni stimolate (Figura 2B). Dopo tre mesi dalla dimissione veniva mostrato un ulteriore miglioramento: la distanza percorsa al 6MWT era di 230 metri senza desaturazione e il punteggio MLWHFQ era 58. Dopo sei mesi dalla dimissione veniva confermato il miglioramento della frazione d’eiezione che risultava 46% (Figura 2C). Dopo nove mesi dalla dimissione venivano confermati sia i parametri ecocardiografici che quelli della qualità di vita in assenza di nuovi accessi per riacutizzazioni di scompenso cardiaco.
Discussione
In questo caso clinico la CCM si è dimostrata efficace nel migliorare i sintomi e ridurre il numero di ospedalizzazioni di una paziente affetta da scompenso cardiaco a frazione d’eiezione ridotta. La CCM è un dispositivo impiantabile che emette impulsi elettrici bifasici ad alto voltaggio durante il periodo refrattario assoluto. È costituito da un generatore che viene collocato nella regione sottoclaveare e da due elettrocateteri posizionati sul setto interventricolare che influenzano la biologia del miocardiocita aumentandone la contrattilità senza aumentare il consumo di ossigeno.
È stato dimostrato che questi segnali ristabilizzano la corretta fosforillazione di proteine regolatrici come il fosfolambano che migliora l’uptake di calcio tramite la proteina SERCA2a aumentandone la contrattilità ventricolare sinistra e risultando in un miglioramento nella tolleranza nell’esercizio e nella capacità funzionale [4]. Dopo 40 giorni dalla rivascolarizzazione si è osservato solo un piccolo miglioramento nella frazione eiezione ventricolare sinistra. Dopo l’impianto del device si è dimostrato un miglioramento della contrattilità a carico dei segmenti più vicino agli elettrocateteri correlando dunque con le aree sottoposte al maggior rimodellamento genico [5]. Questo caso mostra l’efficacia del GLS nel dimostrare il miglioramento della performance ventricolare sinistra, in accordo con la valutazione clinica, ed è il primo a valutare l’effetto del rimodellamento della CCM usando il GLS. L’analisi dello strain ventricolare sinistro ha mostrato di essere utile nel monitoraggio della terapia con la CCM correlando l’imaging e il riarrangiamento dei geni miocardici indotto dal device.
References
1. Seferovic, P.M.; Ponikowski, P.; Anker, S.D.; Bauersachs, J.; Chioncel, O.; Cleland, J.G.F.; de Boer, R.A.; Drexel, H.; Ben Gal, T.; Hill, L.; et al. Clinical practice update on heart failure 2019: Pharmacotherapy, procedures, devices, and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2019, 21, 1169–1186.
2. Kahwash, R.; Burkhoff, D.; Abraham, W.T. Cardiac contractility modulation in patients with advanced heart failure. Expert Rev. Cardiovasc. Ther. 2013, 11, 635–645.
3. Giallauria, F.; Vigorito, C.; Piepoli, M.F.; Coats, A.J.S. Effects of cardiac contractility modulation by non-excitatory electrical stimulation on exercise capacity and quality of life: An individual patient’s data meta-analysis of randomized controlled trials. Int. J. Cardiol. 2014, 175, 352–357.
4. Mando, R.; Goel, A.; Habash, F.; Saad, M.; Ayoub, K.; Vallurupalli, S.; Maskoun, W. Outcomes of Cardiac Contractility Modulation: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Cardiovasc. Ther. 2019, 2019, 9769724.
5. Anker, S.D.; Borggrefe, M.; Neuser, H.; Ohlow, M.-A.; Röger, S.; Goette, A.; Remppis, B.A.; Kuck, K.-H.; Najarian, K.B.; Gutterman, D.D.; et al. Cardiac contractility modulation improves long-term survival and hospitalizations in heart failure with reduced ejection fraction. Eur. J. Heart Fail. 2019, 21, 1103–1113.
Info sull'autore