Grazia Casavecchia, MDa, Maria Delia Corboa, Matteo Gravinaa, Roberta Baronea, Michele Magnesaa,
Marco Meleb, Domenico D’Alessandrob, Riccardo Ievab, Massimo Iacovielloa, Luca Macarinia, Natale Daniele Brunetti, MD, PhDa
a Department of Medical & Surgical Sciences, University of Foggia, Foggia, Italy
b Policlinico Riuniti University Hospital, Foggia, Italy
Abstract
La malattia da Coronavirus (Covid)-19 può presentarsi nei bambini in modo asintomatico o con caratteristiche cliniche molto lievi. Una possibile complicanza, tuttavia, può essere rappresentata da una sindrome infiammatoria ritardata, successiva alla fase acuta dell’infezione da SARS-CoV-2 di settimane-mesi, con coinvolgimento multiorgano, simile alla malattia di Kawasaki. Questa sindrome infiammatoria multisistemica nei bambini (MIS-C) associata a SARS-CoV-2 si verifica di solito 4-6 settimane dopo l’infezione e si presenta con febbre alta, disfunzione d’organo, livelli elevati di marcatori infiammatori e segni di shock, in assenza di una ipotesi diagnostica alternativa [1].
Riportiamo il caso di miocardite aritmica associata a MIS-C che si è risolta dopo terapia antinfiammatoria e infusione di immunoglobuline.
Caso Clinico
Riportiamo il caso di un ragazzo di 15 anni che si è presentato al pronto soccorso per dolore toracico 42 giorni dopo l’infezione da SARS-CoV-2, che si alleviava in seguito a flessione in avanti del torace. Al ricovero la pressione arteriosa era 120/70 mmHg e l’esame obiettivo negativo. L’elettrocardiogramma ha mostrato tachicardia sinusale e sopraslivellamento del tratto ST diffuso (Fig. 1), QRS di ampiezza ridotta e valori QTc prolungati; I livelli di HS-troponina-I erano notevolmente aumentati (3652 ng/L, n.v. <20). L’ecocardiografia basale ha mostrato una funzione sistolica globale preservata e versamento pericardico minimo (Fig. 2). La radiografia del torace e l’emocromo erano normali. Il paziente è stato ricoverato in reparto di terapia intensiva cardiologica. Dopo l’ammissione, è comparsa la febbre (38°C), con dolori addominali e diarrea. L’ecografia addominale era normale. Un breve run (10 battiti) di tachicardia ventricolare è stato riscontrato al monitoraggio continuo dell’elettrocardiogramma. Il ragazzo è stato trattato con aspirina 1500 mg/die ed enoxaparina 4000 UI/die. Il livello di picco di hs-troponina-I è stato 12,333 ng/L, i livelli di NT-proBNP 1.570 pg/mL, D-dimero 991 ng/mL e proteina C-reattiva 110 mg/L (nv <5). I livelli di IgG del virus SARS-CoV-2 erano notevolmente aumentati, mentre test degli autoanticorpi, epatite B/C e IgM per virus comuni (parotite, varicella, mononucleosi, toxoplasma, parvovirus-19, rosolia, citomegalovirus, i livelli di herpes virus1–2, paramyxovirus, Mycoplasma Pneumonie) erano negativi.
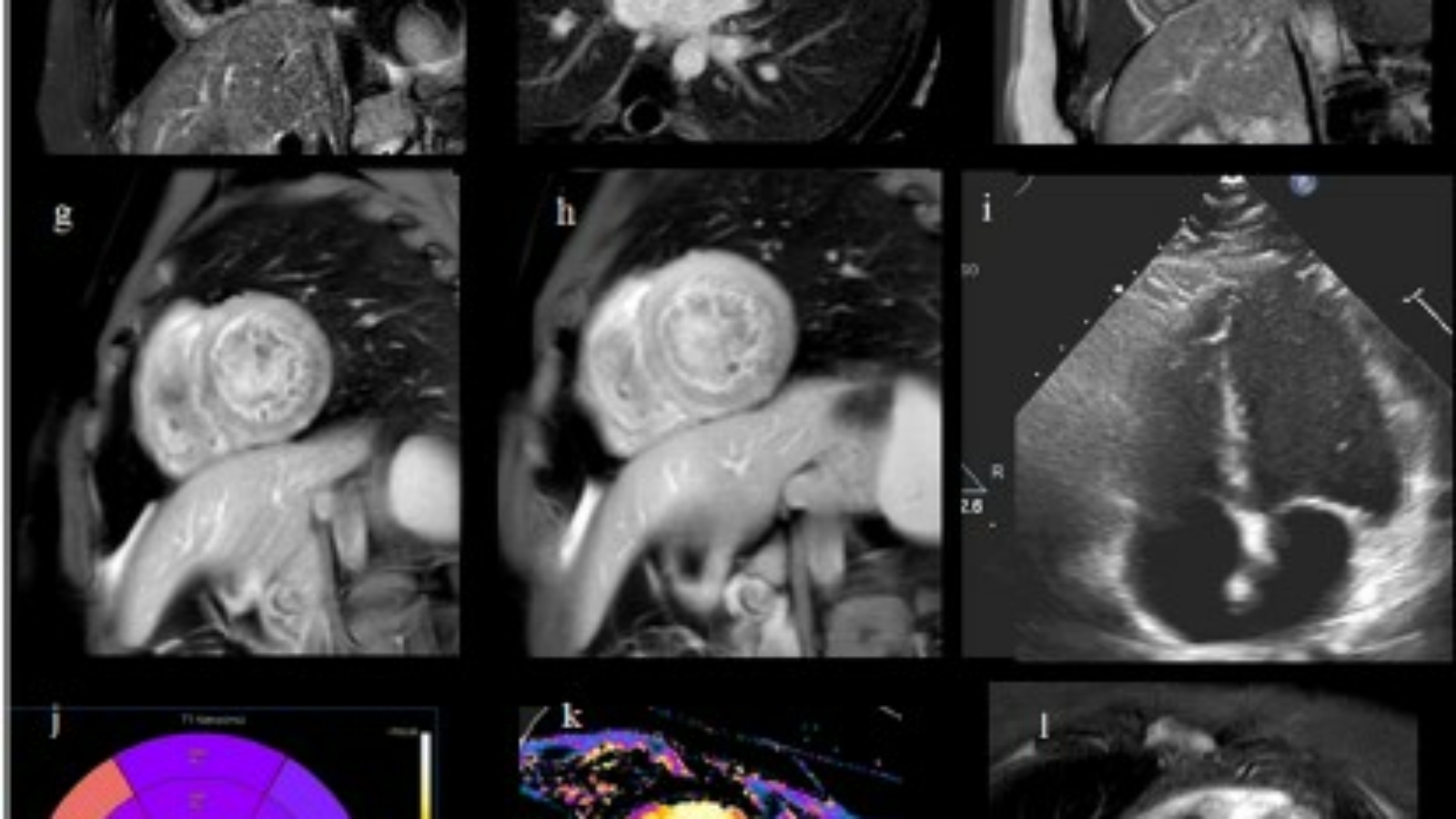
In presenza di diagnosi di MIS-C (miocardite acuta con sintomi intestinali) sono state infuse immunoglobuline per via endovenosa, con netto miglioramento dei test di laboratorio e una riduzione dei livelli di hs-troponina I (5749 ng/L) (Fig. 3). La risonanza magnetica cardiaca ha mostrato un aumento del segnale diffuso nelle pareti del ventricolo sinistro al T1 mapping nativo. (Fig. 2a-b), aumento del segnale con distribuzione “a chiazze” delle pareti del ventricolo sinistro nelle sequenze T2-STIR edema (Fig. 2c-d), aree multiple di segnale aumentato con distribuzione media e subepicardica all’interno delle pareti ventricolari sinistre nelle sequenze per Early Gadolinium Enhancement e aumento del segnale con distribuzione “a macchia di leopardo” della sinistra pareti ventricolari nella sequenza PSIR, compatibili con necrosi miocardica da miocardite acuta (Fig. 2e-f).
Alla dimissione, l’elettrocardiogramma mostrava ritmo sinusale con Onde T negative e i livelli di marcatori infiammatori (CRP) e hs-troponina-I erano ridotti. Il paziente è stato dimesso 12 giorni dopo il ricovero, asintomatico, con defibrillatore indossabile. Al follow-up a 3 mesi la risonanza magnetica cardiaca ha mostrato una riduzione di segnale nelle sequenza T1 Native per lo studio Mapping (Fig. 2j-k), assenza di edema all’interno delle pareti del ventricolo sinistro nelle sequenze T2-STIR (Fig. 2l-m) e riduzione delle aree di potenziamento del Late Gadolinium enhancement compatibili con fibrosi (Fig. 2n-o). L’ecocardiografia era normale, senza versamento pericardico. L’elettrocardiogramma era normale, mentre i livelli di PCR ancora aumentato. La terapia con aspirina è stata ridotta a 1000 mg/die. L’ECG a riposo e il monitoraggio continuo con defibrillatore indossabile erano normali e non hanno mostrato alcun episodio di tachiaritmie ventricolari.
Discussione
Riportiamo il caso di MIS-C che si presenta con miocardite, tachicardia ventricolare e sintomi intestinali. 2Le condizioni cliniche sono migliorate dopo terapia con aspirina e infusione di immunoglobuline. In genere, i bambini sono stati colpiti in modo meno grave dall’infezione da SARS-CoV-2 rispetto agli adulti [3, 4]. L’incidenza della presentazione clinica grave in bambini varia tra il 2 e il 6%, con un rischio maggiore nei pazienti con pregresse comorbidità respiratorie, cardiologiche e neuromuscolari [3, 5]. Tuttavia, l’8 maggio 2020, il Center for Disease Control (CDC) negli Stati Uniti ha emesso un avviso descrivendo una nuova entità denominata MIS-C (sindrome infiammatoria multisistemica nei bambini associati con Covid-19). La definizione di MIS-C include [6]: a) un individuo di età <21 anni che presenta febbre, prove di laboratorio di infiammazione, e evidenza di malattia clinicamente grave che richiede il ricovero in ospedale, con coinvolgimento multisistemico (>2) d’organo (cardiaco, renale, respiratorio, ematologico, gastrointestinale, dermatologico o neurologico); E b) nessuna diagnosi plausibile alternativa; E c) Positivo per corrente o recente Infezione da SARS-CoV-2 mediante RT-PCR, sierologia o test dell’antigene; o esposizione a un caso sospetto o confermato di COVID-19 entro le 4 settimane prima della comparsa dei sintomi. I pazienti con MIS-C di solito si presentano con febbre persistente, dolore addominale, vomito, diarrea, eruzioni cutanee, mucocutanee lesioni e, nei casi più gravi, con ipotensione e shock [2]. Alcuni i pazienti sviluppano miocardite, disfunzione cardiaca e danno renale acuto. La patogenesi di MIS-C è ancora sconosciuta. Alcune funzioni si sovrappongono con malattia di Kawasaki, una vasculite acuta dei vasi medi, con specificità predilezione per le arterie coronarie, che si verifica nei neonati e nei bambini. MIS-C e malattia di Kawasaki potrebbero condividere una disregolazione delle citochine, mentre differiscono nella regolazione delle piastrine e dei fattori della coagulazione [7]. MIS-C è caratterizzato da una tempesta di citochine guidata dall’interleuchina-6 e da una disregolazione dei linfociti citotossici con deplezione di CD8+ T linfociti e cellule NK CD56 e CD57. Consiglio et al. dimostrato che i sottotipi di cellule T linfocitarie differiscono tra due malattie e l’interleuchina-17A media l’iperinfiammazione nella malattia di Kawasaki, ma non in MIS-C [8]; uno studio ha trovato prove di microangiopatia in MIS-C [9].
Non è ancora chiaro se i processi che mediano MIS-C siano diversi da quelli che portano a grave insufficienza respiratoria e shock in caso di Covid-19 [9]. Il ritardo nella presentazione dopo il contagio da Covid-19, i bassi tassi di SARS-CoV-2 positivi e le alte proporzioni di anticorpi positivi suggeriscono che questa sindrome infiammatoria non è presumibilmente mediata da invasione virale diretta ma può rappresentare un risposta immunitaria acquisita a SARS-CoV-2, mediata da anticorpi o Cellule che attaccano cellule mediate da cellule T che esprimono antigeni virali o ospite antigeni che reagiscono in modo incrociato o imitano gli antigeni virali. I bambini con MIS-C in genere rispondono bene alla terapia con immunoglobuline per via endovenosa, che prevengono complessi di attacco di membrana da fattori del complemento e mitigano patologia mediata da autoanticorpi [8]. Il paziente con MIS-C può avere markers infiammatori elevati (CRP, fibrinogeno, D-dimero, ferritina, lattato deidrogenasi, IL-6, neutrofili, linfociti e albumina) e sviluppano danno renale, anemia, trombocitopenia, ipertrigliceridemia, proteinuria, coagulopatia e disfunzione cardiaca [6, 10]. I pazienti con coinvolgimento cardiaco potrebbero avere livelli elevati di troponina, BNP e CK-MB [11]. Data la frequente associazione della MIS-C con l’interessamento cardiaco (oltre l’80%), i test cardiaci (ecocardiogramma, elettrocardiogramma, troponina e peptide natriuretico di tipo B (BNP) o NT-proBNP) devono essere considerati. Il danno cardiaco coinvolge il sistema sistodiastolico con disfunzione biventricolare (con necessità di trattamenti di supporto, compreso il supporto ventilatorio, l’uso di inotropi ed ECMO [12]), rigurgito mitralico, aritmia e versamento pericardico, mentre è stato descritto il coinvolgimento coronarico nel 6-24% dei casi (come lieve o come ectasia coronarica) [1]. Anomalie elettrocardiografiche aspecifiche del tratto ST, prolungamento del segmento QTc, si possono osservare battiti ectopici atriali e ventricolari in MIS-C, mentre i casi di blocco atrioventricolare di I e II grado e le aritmie sopraventricolari e ventricolari sono più rare.
I test sierologici devono essere eseguiti prima dell’assunzione di immunoglobuline per via endovenosa (IVIG) o qualsiasi trattamento con anticorpi esogeni. Il trattamento ottimale non è ancora noto per un paziente con MIS-C; tuttavia, è necessario un approccio multidisciplinare per guidare l’individuo trattamento, che potrebbe essere diverso e si basa sulla valutazione di sintomi e valori di laboratorio. Di solito lo sono i pazienti con MIS-C trattati con IVIG, 2 g/kg (max 100 g), per infusione lenta (16–24 h). Pazienti sono stati anche trattati con terapia steroidea (da 2 a 30 mg/kg/die di metilprednisolone a seconda della gravità della malattia) e biologici [13]. Un recente studio osservazionale ha rilevato che il trattamento iniziale sia con IVIG che con terapia steroidea ha portato a una risoluzione più precoce della febbre rispetto alle sole IVIG [14]. Deve essere presa in considerazione la profilassi antitrombotica in tutti i pazienti con MIS-C e, salvo controindicazioni, dovrebbe esserlo iniziato con enoxaparina [15]. Deve essere considerata solo la terapia antipiastrinica se è presente un coinvolgimento piastrinico o coronarico [16]. Nel nostro caso la terapia è stata limitata all’uso di IVIG, dopo una rapida risposta terapia infusionale. Degno di nota, tuttavia, possiamo osservare in questo caso un’insorgenza ritardata di MIS-C precedentemente riportato [17], e, data la presentazione aritmica, un monitoraggio ambulatoriale prolungato con un ICD indossabile in un ragazzo con miocardite.
Conclusioni
Anche se i bambini con Covid-19 generalmente presentano sintomi lievi o sono asintomatici, c’è un crescente riconoscimento di un ritardo MIS-C a seguito di SARS-CoV-2. Riportiamo il caso di MIS-C associato miocardite aritmica.
Bibliografia
[1] Jiang L, Tang K, Levin M, Irfan O, Morris SK,Wilson K, et al. COVID-19 and multisystem inflammatory syndrome in children and adolescents. The Lancet. Infect Dis. 2020;20:e276–88. [2] Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet. 2020; 395(10237):1607–8. [3] Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, et al. Epidemiology of COVID-19 among children in China. Pediatrics. 2020.;145(1–10):e20200702. [4] Liguoro I, Pilotto C, Bonanni M, Ferrari ME, Pusiol A, Nocerino A, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur J Pediatr. 2020;179: 1029–46. [5] Lu X, Zhang L, Du H, Zhang J, Li YY, Qu J, et al. SARS-CoV-2 Infection in Children. N Engl J Med. 2020;382:1663–5. [6] (COVID-19). US Centers for Disease Control and Prevention. Multisystem inflammatory syndrome in children (MIS-C) associated with coronavirus disease 2019. Atlanta, GA: US Centers for Disease Control and Prevention; May 14, 2020. https://emergencycdc.gov/han/2020/han00432.asp (accessed Aug 26, 2020). [7] Beckmann ND, Comella PH, Cheng E, Lepow L, Beckmann AG, Mouskas K, et al. Cytotoxic lymphocytes are dysregulated in multisystem inflammatory syndrome in children. medRxiv [Preprint]; 2020. 0.08.29.20182899. [8] Consiglio CR, Cotugno N, Sardh F, Pou C, Amodio D, Rodriguez L, et al. The immunology of multisystem inflammatory syndrome in children with COVID-19. Cell. 2020; 183:968–81. [9] Diorio C, Henrickson SE, Vella LA, McNerney KO, Chase J, Burudpakdee C, et al. Multisystem inflammatory syndrome in children and COVID-19 are distinct presentations of SARS-CoV-2. J Clin Invest. 2020;130:5967–75. [10] Verdoni L,Mazza A, Gervasoni A,Mazza A, Gervasoni A,Martelli L, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort studyexternal icon. Lancet. 2020;395:1771–8. [11] Belhadjer Z, Meot M, Bajolle F, Khraiche D, Legendre A, Abakka S, et al. Acute heart failure in multisystem inflammatory syndrome in children (MIS-C) in the context of global SARS-CoV-2 pandemicexternal icon. Circulation. 2020;42:429–36. [12] Sperotto F, Friedman KG, Son MBF, VanderPluym CJ, Newburger JW, Dionne A. Cardiac manifestations in SARS-CoV-2-associated multisystem inflammatory syndrome in children: a comprehensive review and proposed clinical approach, 180; 2021; 307–22. [13] Jonat B, Gorelik M, Boneparth A, Geneslaw AS, Zachariah P, Shah A, et al. Multisystem inflammatory syndrome in children associated with coronavirus disease 2019 in a children’s hospital in New York City: patient characteristics and an institutional protocol for evaluation, management, and follow-up. Pediatr Crit Care Med. 2021; 22:e178–91. [14] Ouldali N, Toubiana J, Antona D, Javouhey E, Madhi F, Lorrot M, et al. Association of Intravenous Immunoglobulins Plus Methylprednisolone vs Immunoglobulins Alone With Course of Fever in Multisystem Inflammatory Syndrome in Children. JAMA. 2021;325:855–64. [15] Goldenberg N, Sochet A, Albisetti M, Biss T, Bonduel M, Jaffray J, et al. Consensusbased clinical recommendations and research priorities for anticoagulant thromboprophylaxis in children hospitalized for COVID-19-related illness. J Thromb Haemost. 2020;18:3099–105. [16] BW McCrindle, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of kawasaki disease: a scientific statement for health professionals from the American Heart Association. Circulation. 2017.;135 e927-e999. [17] Belhadjer Z, Méot M, Bajolle F, Khraiche D, Legendre A, Abakka S, et al. Acute heart failure in multisystem inflammatory syndrome in children in the context of global SARS-CoV-2 pandemic. Circulation. 2020;142:429–36.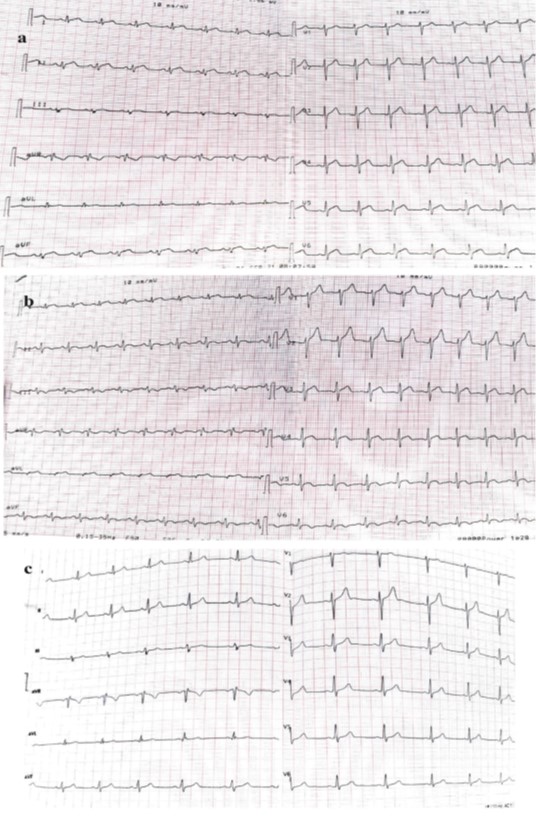
Figura 1 a) elettrocardiogramma di ingresso che mostra sopraslivellamento diffuso dell’ST e riduzione dell’ampiezza del QRS. b) elettrocardiogramma alla dimissione che mostra onde T negative. c) Elettrocardiogramma di follow-up a 3 mesi che mostra il recupero dell’ampiezza del QRS e del tratto ST.
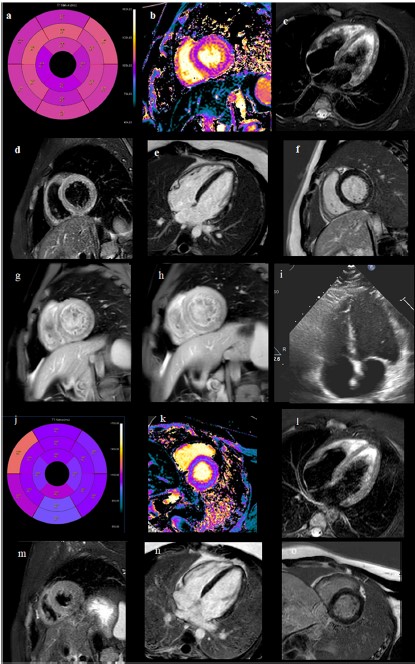
Figura 2 Valutazione dell’imaging seriale a–b). Aumento diffuso del segnale MRI delle pareti del ventricolo sinistro nella sequenza T1 Nativa per lo studio Mapping. c–d) Aumento del segnale con distribuzione “a macchia di leopardo”. all’interno delle pareti del ventricolo sinistro nelle sequenze T2-STIR per l’edema. e–f) Aumento del segnale con distribuzione “a macchia di leopardo” all’interno delle pareti del ventricolo sinistro nella sequenza PSIR per lo studio del late gadolinium enhancement (LGE) compatibile con la necrosi miocardica nella miocardite acuta. g–h) Aree multiple di aumento del segnale con distribuzione media e subepicardica all’interno del ventricolo sinistro nelle sequenze per l’Early Gadolinium Enhancement. i) ecocardiogramma bidimensionale basale normale. j–k) Follow-up a due mesi: riduzione del segnale nella sequenza T1 Nativo per lo studio mapping. l–m) Assenza di edema all’interno delle pareti del ventricolo sinistro nelle sequenze T2-STIR. n-o) Rimodellamento e riduzione delle aree di LGE compatibili con fibrosi.
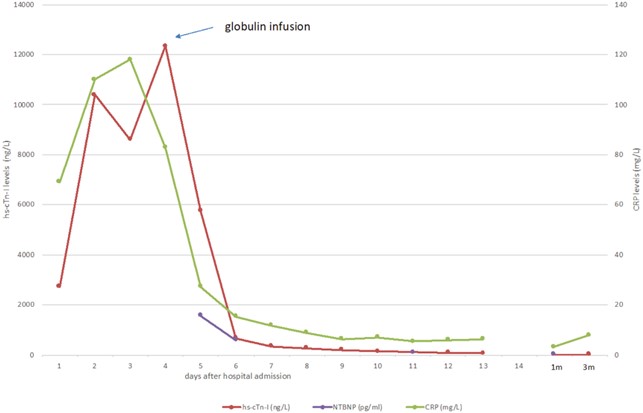
Figura 3 Livelli di troponina ad alta sensibilità, NT-pro-BNP e proteina C-reattiva durante il ricovero e al follow-up.