Different Phases of Disease in Lymphocytic Myocarditis Clinical and Electrophysiological Characteristics
Michela Casella, MD, PHD,a,b,* Alessio Gasperetti, MD,c,* Paolo Compagnucci, MD,a,d Maria Lucia Narducci, MD, PHD,e Gemma Pelargonio, MD, PHD,e,f Valentina Catto, PHD,c Corrado Carbucicchio, MD,c Gianluigi Bencardino, MD, PHD,e Edoardo Conte, MD,g Nicolò Schicchi, MD,h Daniele Andreini, MD, PHD,g,i Gianluca Pontone, MD, PHD,g Andrea Giovagnoni, MD,b,h Stefania Rizzo, MD,j Frediano Inzani, MD,k Cristina Basso, MD, PHD,j Andrea Natale, MD,l Claudio Tondo, MD, PHD,f,m Antonio Dello Russo, MD, PHD,a,d Filippo Crea, MDe,f
a Cardiology and Arrhythmology Clinic, University Hospital “Ospedali Riuniti,” Ancona, Italy;
b Department of Clinical, Special and Dental Sciences, Marche Polytechnic University, Ancona, Italy;
c Department of Clinical Electrophysiology and Cardiac Pacing, Centro Cardiologico Monzino IRCCS, Milan, Italy;
d Department of Biomedical Sciences and Public Health, Marche Polytechnic University, Ancona, Italy;
e Department of Cardiovascular and Thoracic Sciences, Fondazione Policlinico Universitario A. Gemelli IRCCS, Rome, Italy;
f Institute of Cardiology, Catholic University of the Sacred Heart, Rome, Italy;
g Cardiovascular Computed Tomography and Radiology Unit, Centro Cardiologico Monzino IRCCS, Milano, Italy;
h Department of Radiology, University Hospital “Umberto I–Lancisi–Salesi,” Ancona, Italy;
I Department of Clinical Sciences and Community Health, University of Milan, Milan, Italy;
J Cardiovascular Pathology Unit, Department of Cardiac, Thoracic, Vascular Sciences and Public Health, Azienda Ospedaliera-University of Padua, Padova, Italy;
k Department of Woman, Child and Public Health Sciences, Fondazione Policlinico Universitario A. Gemelli IRCCS, Rome, Italy;
l Texas Cardiac Arrhythmia Institute, St. David’s Medical Center, Austin, Texas, USA;
m Department of Biomedical, Surgical and Dental Sciences, University of Milan, Milan, Italy.
ABSTRACT
La miocardite è una patologia del miocardio caratterizzata da un infiltrato di cellule infiammatorie attive e necrosi dei cardiomiociti, solitamente secondaria a fenomeni autoimmuni o infezioni virali (1, 2). La miocardite si può presentare con una pletora di manifestazioni cliniche talora aspecifiche ed eterogenee, che vanno dallo scompenso cardiaco acuto fino ad aritmie ventricolari pericolose per la vita. La diagnosi richiede un approccio multimodale, come suggerito dal position statement dell’European Society of Cardiology Working Group on Myocardial and Pericardial Disease del 2013, e spesso è necessaria una biopsia endomiocardica per la conferma della diagnosi definitiva (3).
In questo lavoro si fa luce sulle caratteristiche cliniche ed elettrofisiologiche delle diverse fasi della miocardite linfocitaria (LM), nello specifico miocardite acuta (AM), miocardite cronica attiva (CAM), e miocardite risolta (HM) (4).
ARTICOLO
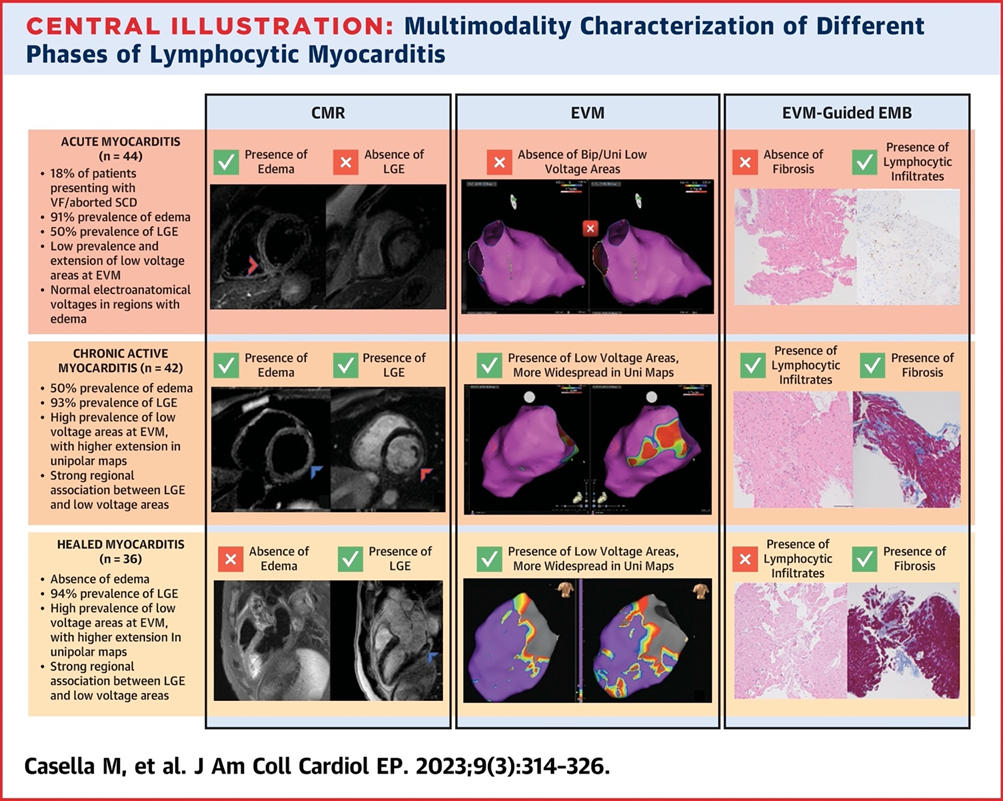
In questo studio sono stati arruolati in maniera prospettica da tre diversi centri (Azienda Ospedaliera Universitaria Ospedali Riuniti di Ancona, Centro Cardiologico Monzino IRCCS di Milano e Fondazione Policlinico Universitario Agostino Gemelli IRCCS di Roma) 122 pazienti con diagnosi istologica di miocardite linfocitaria ottenuta mediante biopsia endomiocardica percutanea guidata da mappaggio elettroanatomico (EAM) ed ecocardiografia intracavitaria (ICE). La maggior parte dei pazienti ha avuto una presentazione aritmica all’esordio. Tutti i pazienti sono stati sottoposti a risonanza magnetica cardiaca (CMR) e a studio elettrofisiologico (EPS). Integrando i dati clinici con i dati strumentali non invasivi ed invasivi secondo un approccio multimodale, come indicato dal Position Statement Europeo, è stato possibile suddividere i pazienti in 3 gruppi: il 36% aveva AM, il 34% CAM e infine il 30% HM.
Le aritmie ventricolari complesse erano molto comuni nella popolazione totale (109, 89%), ma la fibrillazione ventricolare e la morte cardiaca improvvisa abortita erano lievemente più prevalenti all’esordio nella miocardite acuta (P = 0.028) mentre non vi era differenza nella distribuzione delle tachicardie ventricolare sostenute.
Per quanto concerne i risultati della CMR, i gruppi con CAM e HM avevano una più elevata incidenza di late gadolinium enhancement rispetto al gruppo con AM (94.4% vs 92.9% vs 50%; P < 0.001), mentre l’edema era più comune nella AM rispetto alla CAM, ed era completamente assente nella HM (90.9% vs 50% vs 0%; P < 0.001). L’edema alla CMR si è dimostrato essere il predittore clinico indipendente più potente per la presenza di infiammazione attiva all’esame istologico.
Il mappaggio elettroanatomico ha mostrato una minor prevalenza di aree di basso voltaggio nella AM rispetto alla CAM e alla HM. È stata riscontrata una forte associazione tra edema in un determinato segmento miocardico e voltaggi normali in quel sito specifico (odds ratio: 0.24; 95% CI: 0.10-0.54; P < 0.01) specialmente nei pazienti con AM, così come tra la presenza di LGE in una determinata area e i bassi voltaggi nella stessa (odds ratio: 2.86; 95% CI: 1.19-6.97; P = 0.019) specialmente nei pazienti con CAM e HM.
Questi risultati portano a postulare che le aritmie caotiche ventricolari come la FV possano essere il risultato di un insulto miocardico di recente insorgenza caratterizzato da necrosi e infiammazione a livello istologico che sono tipicamente riscontrati nella AM. La successiva fase fibrotica sostitutiva, tipica della HM, potrebbe fornire invece il substrato aritmico di rientro che è alla base di TV monomorfe. La CAM, essendo caratterizzata dal punto di vista istologico sia da infiammazione attiva che da fibrosi sostitutiva, si può presentare con aritmie ventricolari tipiche sia della AM che della HM. Per quanto concerne i risultati del mappaggio elettroanatomico e la loro correlazione con i dati CMR, le aree di bassi voltaggi potrebbero essere più indicative di cicatrice fibrotica che di infiammazione attiva, come accade nella CAM e HM dove è presente fibrosi sostitutiva come risultato di infiammazione cronica e di cicatrice post miocarditica, rispettivamente.
In conclusione, una valutazione multimodale comprensiva di test non invasivi ed invasivi, ed in particolar modo integrando i dati della CMR e del mappaggio elettroanatomico, permette di rivelare le specifiche caratteristiche delle diverse fasi della miocardite con una netta distinzione tra la fase di infiammazione precoce (AM) e i successivi stadi cicatriziali (CAM e HM). Tali osservazioni vanno a rinforzare il concetto dell’approccio fase-specifico alla miocardite, e i dati elettrofisiologici sono importanti al fine di offrire una diagnosi e terapia “patient-tailored”
http://JACC CLINICAL ELECTROPHYSIOLOGY 2023 Mar, 9 (3) 314–326
BIBLIOGRAFIA:
- Cooper, Leslie T Jr. “Myocarditis.” The New England journal of medicine vol. 360,15 (2009): 1526-38. doi:10.1056/NEJMra0800028
- Priori, Silvia G et al. “2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC).” European heart journalvol. 36,41 (2015): 2793-2867. doi:10.1093/eurheartj/ehv316
- Caforio, Alida L P et al. “Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases.” European heart journalvol. 34,33 (2013): 2636-48, 2648a-2648d. doi:10.1093/eurheartj/eht210
- Ammirati, Enrico et al. “Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document.” Circulation. Heart failure vol. 13,11 (2020): e007405. doi:10.1161/CIRCHEARTFAILURE.120.007405
Info sull'autore