Coesistenza di anomalia d’origine aortica dell’arteria discendente anteriore e ALCAPA in un adolescente asintomatico.
Autori
Adelina Selimi1, Francesco Bianco2, Federico Guerra1, Marco Pozzi 2, Antonio Dello Russo1
1 Clinica di Cardiologia e Aritmologia, Università Politecnica delle Marche, AOU Ospedali Riuniti Ancona “Umberto I, G. M. Lancisi, G. Salesi”
2 Cardiochirurgia e Cardiologia Pediatrica e Congenita, AOU Ospedali Riuniti Ancona “Umberto I, G. M. Lancisi, G. Salesi”
Abstract
Le anomalie congenite delle arterie coronarie includono una pletora di malformazioni congenite di origine, decorso, anatomia intrinseca e terminazione che si estrinsecano clinicamente con vari gradi di severità: dalla totale asintomaticità alla morte cardiaca improvvisa (1,2).
Le anomalie d’origine aortica delle coronarie dal seno di Valsalva opposto rappresentano una cardiopatia congenita rara ma potenzialmente letale. Le anomalie più frequenti ed emblematiche sono rappresentate dall’origine dell’arteria coronaria destra dal seno di Valsalva di sinistra e dall’origine dell’arteria discendente anteriore dal seno di Valsalva di destra. La sintomatologia e la rilevanza clinica in termini di morte cardiaca improvvisa dipendono dal successivo decorso della coronaria ad origine anomala (3).
Le anomalie d’origine delle coronarie dall’arteria polmonare sono entità molto rare: nello specifico l’origine dell’arteria circonflessa dall’arteria polmonare (ALCAPA) è spesso letale nel primo anno di vita se non riconosciuta e trattata (3,4).
Presentiamo il caso di un giovane atleta non agonista totalmente asintomatico con duplice anomalia d’origine delle coronarie ed un’anomalia intrinseca alla anatomia.
Caso clinico
Un atleta non agonista di 14 anni altrimenti sano e asintomatico, si è presentato al nostro Dipartimento per riscontro di anomalie all’ECG nelle derivazioni inferiori e laterali (fig. 1).
All’ecocardiogramma si segnalavano spessori parietali lievemente aumentati, soprattutto a carico della parete infero-laterale (fig. 2). Veniva altresì segnalata una lieve ectasia dell’arteria coronaria destra all’origine. Al test ergometrico sub massimale non vi erano segni o sintomi di ridotta riserva coronarica.
Per la prosecuzione dell’iter diagnostico si è deciso di sottoporre il paziente a risonanza magnetica cardiaca (cMR) che mostrava un ventricolo sinistro ai limiti superiori della norma per dimensioni cavitarie e spessori parietali, ed un’accentuata trabecolatura endocardica apico-laterale senza conclamato raggiungimento di criteri cMR per non compattazione miocardica. Non venivano segnalate aree di late gadolinium enhancement (LGE). Veniva segnalata un’ectasia della coronaria destra con probabile anomalia di origine coronarica associata (fig. 3). Veniva pertanto proposto approfondimento Coro-TC (CCTA) per completa valutazione dell’origine e decorso delle arterie coronarie.
Lo studio coro-TC (fig. 4) ha confermato il sospetto di anomalia congenita delle arterie coronarie e nello specifico: 1) anomalia d’origine aortica dell’arteria discendente anteriore dal seno di Valsalva di destra con unico ostio con l’arteria coronaria destra e decorso anteriore pre-polmonare; 2) evidenza di duplicazione dell’arteria discendente anteriore, originante dal seno di Valsalva di sinistra, non biforcantesi; 3) origine anomala dell’arteria circonflessa dal ramo polmonare principale destro. Vi era altresì evidenza di circolo collaterale eterocoronarico.
Il paziente è stato sottoposto a correzione chirurgica con reimpianto dell’arteria circonflessa in corrispondenza del seno di Valsalva di sinistra. Non si sono verificati esiti durante il follow-up.
Discussione
L’origine dell’arteria discendente anteriore dal seno di Valsalva di destra è una condizione molto rara, con una prevalenza dello 0,03% (4). Viene considerata l’anomalia d’origine aortica più maligna a rischio di morte cardiaca improvvisa, a causa dell’esteso territorio di distribuzione a rischio di ischemia (5). La rilevanza clinica è determinata dal successivo decorso: storicamente il decorso inter-arterioso e intramurale risultano essere associati a ischemia miocardica e morte cardiaca improvvisa a causa della compressione in sistole tra i grossi vasi e all’interno della tunica media aortica, rispettivamente (5). Altre caratteristiche anatomiche associate a maggior rischio di ischemia e morte cardiaca improvvisa sono un ostio a “fessura” ed un angolo di take-off acuto (3,5). Al di là di queste caratteristiche “maligne” che conferiscono un maggior rischio di morte cardiaca improvvisa durante sforzo, la maggior parte dei pazienti con anomalie d’origine aortica sono asintomatici e pertanto rimangono non diagnosticati (3).
L’origine anomala dell’arteria circonflessa dall’arteria polmonare è un’anomalia di origine coronarica molto rara ma potenzialmente letale, con una prevalenza dello 0.008% (4). Le manifestazioni cliniche sono conseguenti all’ischemia nel territorio di distribuzione a causa dell’inversione del flusso dall’arteria circonflessa all’arteria polmonare dovuto alla fisiologica riduzione delle resistenze vascolari polmonari dopo la nascita (2). La maggioranza dei pazienti, qualora non diagnosticati e trattati, muoiono nel primo anno di vita per ischemia miocardica e scompenso cardiaco congestizio. Lo sviluppo di circoli collaterali estesi dalla coronaria destra permette la sopravvivenza fino all’età adulta, definendo il sottotipo “adulto” di ALCAPA che sembra correlare con un minor rischio di morte cardiaca improvvisa in soggetti con età superiore a 50 anni (3,6).
La duplicazione dell’arteria discendente anteriore è un’anomalia rara, non emodinamicamente significativa e spesso una delle due arterie origina dalla coronaria destra (4).
Il caso qui presentato risulta essere emblematico per la totale asintomaticità, nonostante la coesistenza di più anomalie coronariche tra cui ALCAPA, anomalia coronarica tipicamente ad elevato rischio di ischemia miocardica, aritmie ventricolari e morte cardiaca improvvisa.
I motivi per cui il nostro paziente era asintomatico sono: 1) il decorso pre-polmonare dell’arteria discendente anteriore, tipicamente benigno, in assenza di altre caratteristiche “maligne” (es. ostio a “fessura”, decorso intramurale e angolo acuto di take-off), 2) la presenza di circoli collaterali nel territorio dell’arteria circonflessa sia dall’arteria coronaria destra che dall’arteria discendente anteriore duplicata.
Studi sulla storia naturale dell’ALCAPA anche in soggetti adulti documentano scarsi outcome se non trattata, con un’elevata incidenza stimata di morte cardiaca improvvisa a 35 anni (6). Pertanto, in base alle linee guida della Società europea di cardiologia (ESC) sulla gestione delle cardiopatie congenite che raccomandano in classe I C la correzione chirurgica dell’ALCAPA, il paziente è stato sottoposto a intervento chirurgico di reimpianto dell’arteria circonflessa (8).
Conclusioni
Un’estesa valutazione funzionale associata all’imaging multimodale (ecocardiogramma, cMR e CCTA) permettono di stratificare il rischio di ischemia e morte cardiaca improvvisa nei pazienti sintomatici e non con anomalie congenite coronariche (5,7).
Nel nostro caso, l’imaging multimodale ha permesso la diagnosi di ALCAPA in un paziente totalmente asintomatico nel contesto di coesistenza di più anomalie coronariche.
References
1. Angelini P. Coronary artery anomalies–current clinical issues: definitions, classification, incidence, clinical relevance, and treatment guidelines. Tex Heart Inst J. 2002;29(4):271-278.
2. Rizzo S, De Gaspari M, Frescura C, Padalino M, Thiene G, Basso C. Sudden Death and Coronary Artery Anomalies. Front Cardiovasc Med. 2021;8:636589. Published 2021 Mar 18. doi:10.3389/fcvm.2021.636589
3. Gentile F, Castiglione V, De Caterina R. Coronary Artery Anomalies. Circulation. 2021;144(12):983-996. doi:10.1161/CIRCULATIONAHA.121.055347
4. Villa AD, Sammut E, Nair A, Rajani R, Bonamini R, Chiribiri A. Coronary artery anomalies overview: The normal and the abnormal. World J Radiol. 2016;8(6):537-555. doi:10.4329/wjr.v8.i6.537
5. Gräni C, Buechel RR, Kaufmann PA, Kwong RY. Multimodality Imaging in Individuals With Anomalous Coronary Arteries. JACC Cardiovasc Imaging. 2017;10(4):471-481. doi:10.1016/j.jcmg.2017.02.004
6. Yau JM, Singh R, Halpern EJ, Fischman D. Anomalous origin of the left coronary artery from the pulmonary artery in adults: a comprehensive review of 151 adult cases and a new diagnosis in a 53-year-old woman. Clin Cardiol. 2011;34(4):204-210. doi:10.1002/clc.20848
7. Cheezum MK, Liberthson RR, Shah NR, et al. Anomalous Aortic Origin of a Coronary Artery From the Inappropriate Sinus of Valsalva. J Am Coll Cardiol. 2017;69(12):1592-1608. doi:10.1016/j.jacc.2017.01.031
8. Baumgartner H, De Backer J, Babu-Narayan SV, et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42(6):563-645. doi:10.1093/eurheartj/ehaa554
Figure
Fig. 1 ECG: anomalie del tratto ST nelle derivazioni inferiori e laterali.
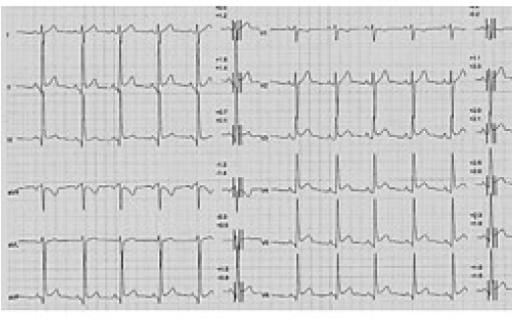
Fig. 2 Ecocardiogramma transtoracico: Apicale 4 camere
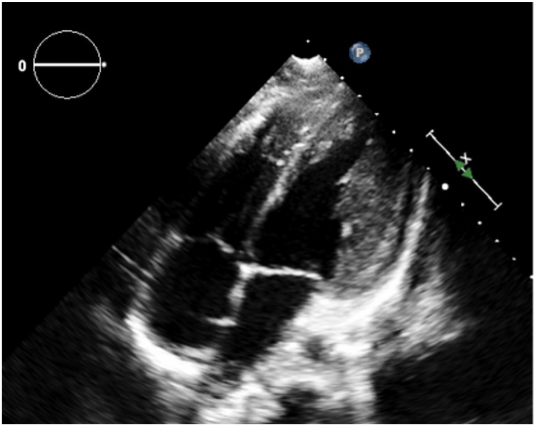
Fig. 3 cMR: vaso a decorso anomalo, sospetta anomalia coronarica.
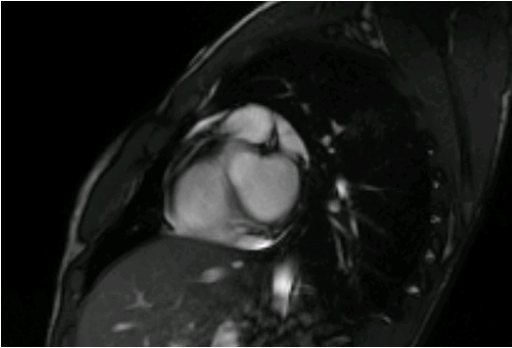
Fig. 4 CCTA: 1) anomalia d’origine aortica dell’arteria discendente anteriore dal seno di Valsalva di destra con unico ostio con l’arteria coronaria destra e decorso anteriore pre-polmonare (IVA 1), 2) evidenza di duplicazione dell’arteria discendente anteriore, originante dal seno di Valsalva di sinistra (IVA 2), 3) origine anomala dell’arteria circonflessa dal ramo polmonare principale destro (Cx).
Info sull'autore